脂肪酶催化合成对映纯硫杂环戊烷动力学模型
2021-04-02唐慧王繁业
唐慧 王繁业

摘要: 为有效提高医药中間体对映纯1,3-氧杂硫杂环戊烷(PR)的产率,本研究对动态动力学拆分,制备PR,并建立其动力学模型。采用一锅法合成对映纯((R)-5乙酰氧基-1,3-氧杂噻喃-2-基)乙基苯甲酸酯(PR),其中,催化剂为固定化丝孢酵母脂肪酶(Trichosporonlaibachii CBS 5791),底物为2-(苯基甲氧基)乙醛(A),1,4-二硫-2,5-二醇(B)和乙酸苯酯(D)。研究结果表明,其转化率可以达到99.6%,产率为97.3%,对映体过量百分率(enantiomeric excess,ee%)为96.5%,所建立的反应体系动力学模型,很好地拟合了实验数据,表明可逆半硫代乙缩醛转化反应动力学遵从幂律方程,而酶催化内酯化反应为带产物抑制的序列机制。该研究可高效合成PR,最大限度地提高了生产效率。
关键词: 动力学模型; 脂肪酶; 半硫缩醛转化; 1,3-氧硫杂环戊烷; 酶促对映选择性合成
中图分类号: TQ463+.21; O643.32文献标识码: A
作者简介: 唐慧(1995-),女,硕士研究生,主要研究方向为药物合成。
通信作者: 王繁业(1965-),男,博士,教授,主要研究方向为制药工程和药物化学。 Email: fywang8209@163.com
手性1,3-氧杂硫杂环戊烷是许多药物的重要中间体,如拉米夫定是用于治疗HIV感染和慢性乙型肝炎最有效的药物之一[1]。酶促不对称合成或拆分制备对映体纯1,3-氧杂硫杂环戊烷,由于其良好的立体选择性,高效、温和的反应条件和环境友好性而受到广泛关注[24]。Ren Y等人[1]通过多酶级联的方法,使用表面活性剂处理枯草杆菌蛋白酶嘉士伯和南极假丝酵母脂肪酶B,制备对映体(2R,5R)-1,3-氧杂硫杂环戊烷,使ee%>99%;Chen Y等人[5]通过产酸克雷伯菌介导的全细胞催化制备对映体富集的拉米夫定前体;Hu L等人[6]提出了加成-环化-乙酰化反应,采用新型表面活性剂处理的枯草杆菌蛋白酶,催化动态动力学拆分制备1,3-氧杂硫杂环戊烷。近年来,动态动力学拆分已在许多复杂的拆分系统中使用[69],但目前酶法合成手性1,3-氧杂硫杂环戊烷中间体仍无法达到满意的对映体纯度和产率。通过不同酶可以获得不同构型的对映体,例如,枯草杆菌蛋白酶通过催化拉米夫定前体进行不对称合成生成拉米夫定,而南极假丝酵母的脂肪酶B、洋葱伯克霍尔德氏菌和荧光假单胞菌的脂肪酶催化结果则与拉米夫定优势构型相反[2,10]。T. laibachii已成功用于酮戊芬[11]的拆分和ε-己内酯的原位开环聚合反应[12]。基于此,本文建立了脂肪酶催化合成对映纯硫杂环戊烷动力学模型,该反应是加成-环化-乙酰化反应[6],反应中需要考虑不同组分之间存在的相互作用[13],可能的反应机制包括乒乓(Bi-Bi)机制[14]或三元复合机制(有序和随机顺序Bi-Bi)[15]。分析结果表明,本研究所建立的动力学模型,可揭示手性1,3-氧杂硫杂环戊烷的反应机理。该研究对提高反应速率具有重要意义。
1实验部分
1.1实验材料及分析测试/实验材料和仪器
2-(苯基甲氧基)乙醛(99%),1,4-二硫-2,5-二醇(98%)和乙酸苯酯(99%)购于阿拉丁公司。以比活力为1 280 U/g的交联固定化T. laibacchiii CBS5791脂肪酶为催化剂,使用前将催化剂真空干燥2 d。采用原位固定化方法制备了交联固定化T. laibacchii CBS5791脂肪酶[16]。对于((R)-5-乙酰氧基-1,3-氧杂硫杂环戊烷-2-基)苯甲酸乙酯(PR)和((S)-5-乙酰氧基-1,3-氧杂硫杂环戊烷-2-基)苯甲酸乙酯(PS),采用高效液相色谱(High-Performance Liquid Chromatography,HPLC)分析,HPLC为Agilent RRLC 1200,色谱柱保持在30 ℃,检测波长为210 nm。采用Chiracel OJ-H柱(4.6 mm×250 mm),进样体积为5 μL,流动相为正己烷∶2-丙醇(即体积比为92∶8),流速为0.8 mL/min。采用气相色谱法(Gas Chromatography,GC)分析2-(苯基甲氧基)乙醛和苯酚的浓度,SHIMADZU GC-2010 plus的毛细管柱为HP-FFAP(Agilent,内径30 mm×0.25 mm,薄膜0.25 μm)。通过程序升温,首先将柱温150 ℃维持在2 min,以10 ℃/min升至200 ℃,并保持1 min,以10 ℃/min升至270 ℃,然后保持15 min。将氮气作为载气,在分流模式下,喷射器温度为250 ℃,分流比为20,火焰离子化检测仪(Flame Ionization Detector,FID)的温度保持在270 ℃。
1.2酶法合成((R)-5-乙酰氧基-1,3-氧杂硫杂环戊-2-基)苯甲酸乙酯
固定化丝孢酵母脂肪酶催化的一锅法反应步骤如下,将10 mL反应瓶置于水浴摇床,摇床转速50~250 r/min,反应温度40 ℃,反应时间48 h。反应体系中,2-(苯基甲氧基)乙醛的浓度为1.6 mmol/L,1,4-二硫-2,5-二醇的浓度为0.8 mmol/L,三乙胺的浓度为0.65 mmol/L,乙酸苯酯的浓度为3.55 mmol/L和四氢呋喃的体积为5 mL,其初始水的质量分数为0.46%。加入酶引发反应,酶浓度为1~6 U/mL。反应结束后,过滤分离脂肪酶,将30 mL乙酸乙酯加入滤液,用饱和碳酸氢钠溶液洗涤。将洗涤的滤液离心分离为水相和有机相,水相用乙酸乙酯(30 mL)萃取两次,最后将合并的有机相用饱和氯化钠洗涤,洗涤的有机相经硫酸镁干燥。真空除去溶剂,并将粗产物使用柱色谱法纯化(己烷∶乙酸乙酯=6.5∶1)。
1.3内、外扩散实验
使用不同粒径的脂肪酶进行内扩散实验,以研究脂肪酶的粒径对化学-酶系统反应速率的影响。酶的粒径为250~850 μm,摇床转速为50~250 r/min,进行了外扩散实验,以研究转速对PR的影响。在内、外扩散实验中,除了反应时间为6.0 h外,其他反应条件与1.2相同。
2模型
2.1反应机理和模型
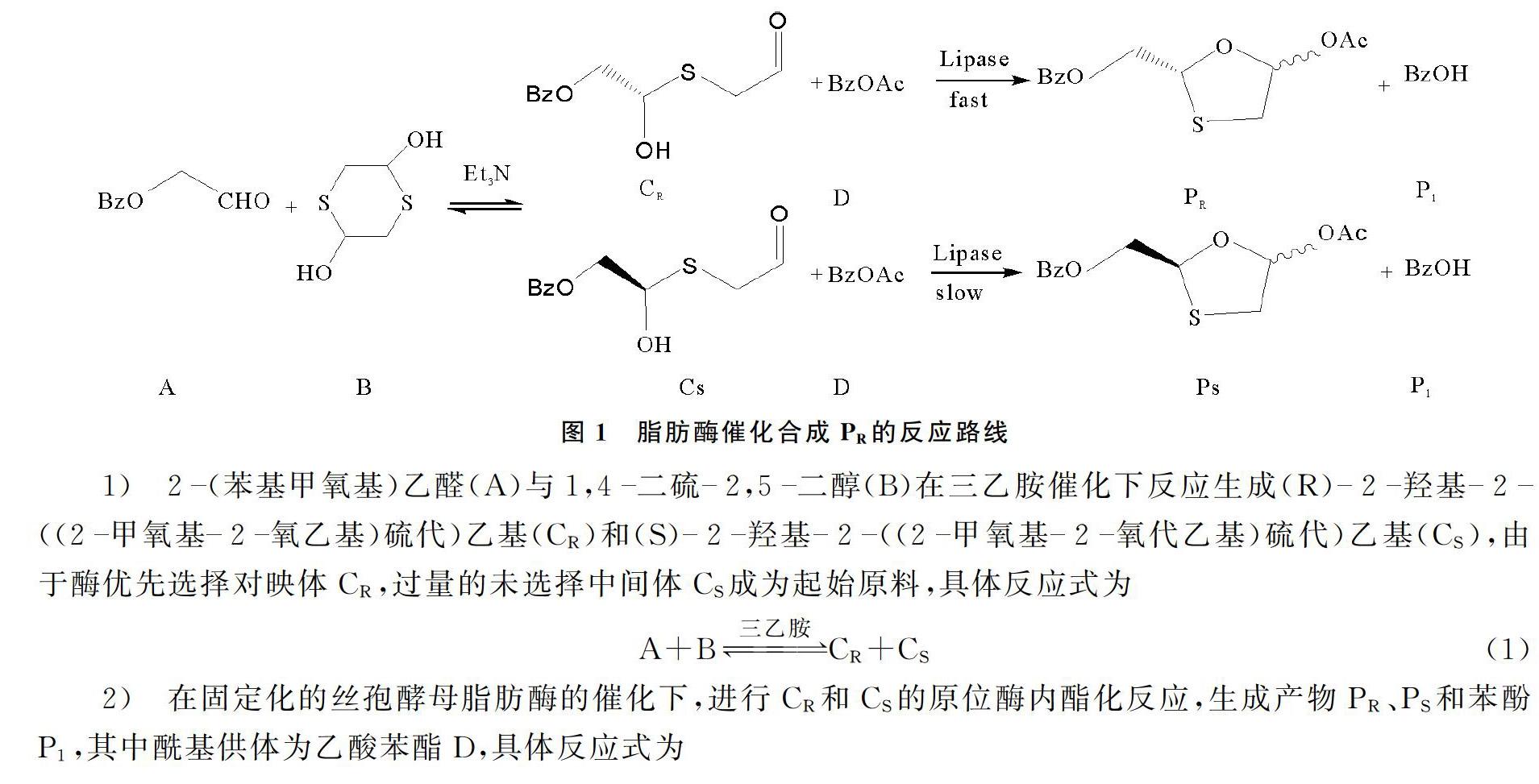
脂肪酶催化合成PR的反应路线如图1所示[11],这是一个动态动力学拆分体系,包含3个反应,其中一个是可逆的半硫代缩醛转化,两个是脂肪酶催化的内酯化反应,生成两个对映体。
对动力学模型进行假设,生成最终产物PR,PS和P1的最后一步是不可逆反应,所建立的动力学模型被认为是固有的反应动力学模型,这一假设将在随后的内部和外部质量扩散实验中得到验证;在整个反应过程中,酶活性的损失可以忽略不计。本研究反应后固定化脂肪酶的剩余活力大于95.4%,反应体系温和[1718],并没有像过氧化物或者酸性物质那样导致酶的失活。该反应中,一种酶同时催化反应式(2)和式(3),具有相同的脂肪酶活性位点,两个平行反应交织在一起。反应式(2)和式(3)中没有离去基团不遵循Bi-Bi机制,离去基团是Bi-Bi机制的特征之一[14]。因此,本研究将考虑顺序机制[15]。CR和CS底物的浓度应近似,因为反应式(2)和式(3)是可逆的半硫缩醛转化。因此,在建立动力学方程式时,CR和CS并未被作为两个真正独立的底物处理,在建立反应动力学模型时,可减少动力学模型参数。
反应式(1)采用带有可逆项的幂律方程作为动力学方程。反应式(2)给出了序列反应机制,用于脂肪酶催化的环化和酯化序列反应机制如图2所示。首先,底物D与脂肪酶E结合形成ED,ED与CR结合,产生脂肪酶三元复合物EDCR,将EDCR转换为EP1PR,产物PR从EP1PR释放,剩下EP1。最后EP1释放产物P1,酶E再转化为原始形式。反应式(3)与反应式(2)类似。式中,k1~k6和k-1~k-6为速度常数项与底物/产物浓度项的乘积。
3结果和讨论
3.1内、外扩散的影响
由于使用了多孔载体的固定化脂肪酶,因此有必要进行内扩散实验。A,B和D初始摩尔浓度分别为0.288,0.144和0.64 mmol/L,固定化脂肪酶的浓度为6.0 U/mL。当温度为40 ℃,搅拌速度为150 r/min,给出不同固定化脂肪酶粒径的实验结果,固定化酶粒径对PR产率的影响如图3所示。由图3可知,随着固定化酶粒径从0.5 mm增加到0.85 mm,PR的产率从46.1%逐渐降低至28.1%,说明在此粒径范围内,粒径的增加与PR的产率成反比,酶催化受扩散限制。因此,如果粒径大于0.5 mm,内扩散对PR产率的影响较大。由图3还可以看出,当珠粒径在0.25~0.5 mm之间变化时,内部传质对PR产率的影响可以忽略。因此,在随后的动力学反应实验中,选择酶大小为0.5 mm。研究表明,如采用合适的酶粒径和酶载荷,可以忽略多孔载体固定化酶的内传质限制[21]。
3.2外扩散的影响
在固液酶促反应中,降低外扩散的影响对于提高反应速率具有重要意义,因此,酶促反应需要在最佳搅拌速度下进行[19]。为研究外扩散对PR产率的影响,在50~250 r/min转速下进行外扩散实验。当温度为40 ℃,粒径为0.5 mm,E0=6 U/mL时,搅拌速度对PR产率的影响如图4所示。由图4可以看出,当搅拌速度从50 r/min增加到150 r/min,PR产率从20.1%增加到46.2%时,搅拌转速对PR产率有较大的影响,反应受外扩散限制。然而当速度从150 r/min增加到250 r/min时,PR产率变化较小,这意味着外扩散影响可以忽略。因此,本实验的最佳反应速度是150 r/min。
上述實验结果表明,当酶粒径和搅拌转速分别为0.5 mm和150 r/min时,内、外扩散阻力均可以忽略,故所研究的是固有动力学模型。
3.3动力学模型
优化式(4)~式(13),优化后的动力学模型参数如表1所示。PR和PS产率模型计算值与实验数据比较如图5所示,由图5可以看出,PR和PS的产率分别为97.3%和1.82%,ee%值为96.5%,取得很好的动态共价动力学拆分效果。由于脂肪酶的高选择性,PR的产率远高于PS,从而得到高ee%。影响对映选择性的另一个因素是底物结构。在本研究中,选择结构比乙二醇醛二聚体大的2-(苯基甲氧基)乙醛与1,4-二硫-2,5-二醇反应,能更适合于酶的活性位点[6]。
A和B剩余率模拟值和实验值如图6所示。由图6可以看出,由于A、B采用等反应量进料,两条剩余率曲线重合,A的最终剩余率为0.4%,相应转化率为99.6%。
当条件温度为40 ℃,粒径为0.5 mm,搅拌速度为150 r/min,E0=6 U/mL时,P1和B的模拟值和实验值的比较如图7所示。由图7可以看出,模拟值和实验数据之间的平均和最大相对偏差分别为8.9%和65.7%。最大相对偏差出现在低PR产率或A、B剩余率处,例如,在PR的低产率下,即使较小的偏差值也会产生较大的相对偏差,因为较小的PR是分母。尽管最大相对偏差为65.7%,但这并不意味着所建立的反应动力学模型与实验数据拟合得不好,而且模拟值与实验数据之间的偏差分布为零轴对称,进一步表明,该模型很好拟合了实验数据。酶反应动力学模型对于研究酶反应机制十分重要[21],模型很好拟合了实验数据,说明设定的反应机制是正确的。反应式(1)遵循幂定律,反应式(2)和式(3)的酶催化反应,则是带有产物抑制顺序机制。在许多由酶催化的动力学模型中,经常使用顺序机制[15]。K13y(8)A0为反应式(2)和式(3)的产物P1抑制项,而K13是P1的产物抑制系数。与其他常数相比,K13数值较大,因此P1的产物抑制对反应具有较强的影响(见表1)。
实际上,在建立化学酶动力学模型时,还考虑了底物抑制和非竞争性抑制等因素。不同动力学模型拟合实验数据如表2所示。表2中,模型方程式分母不同,但分子相同。根据模拟和实验数据之间的平均相对偏差,判断模型是否合适的标准分为四个等级,即非常好(<10%)、好(<15%)、较差(<20%)和差(>20%)。由表2可以看出,不同模型的差别仅出现在式(6)的分母上,如果添加底物抑制或非竞争性抑制,则式(6)分母将改变。其中,只有模型原型(式(6))可以很好地拟合实验数据,而其他5个模型拟合较差。说明P1苯酚产物抑制的假设可以接受,而其他假设,即A和B的非竞争性抑制、PR和PS产物抑制以及CR,CS和D底物抑制的假设是错误的。而具有底物抑制作用的脂肪酶介导的ε-己内酯合成动力学模型[20],其脲素过氧化氢酶和乙酸都具有较强的底物抑制作用。
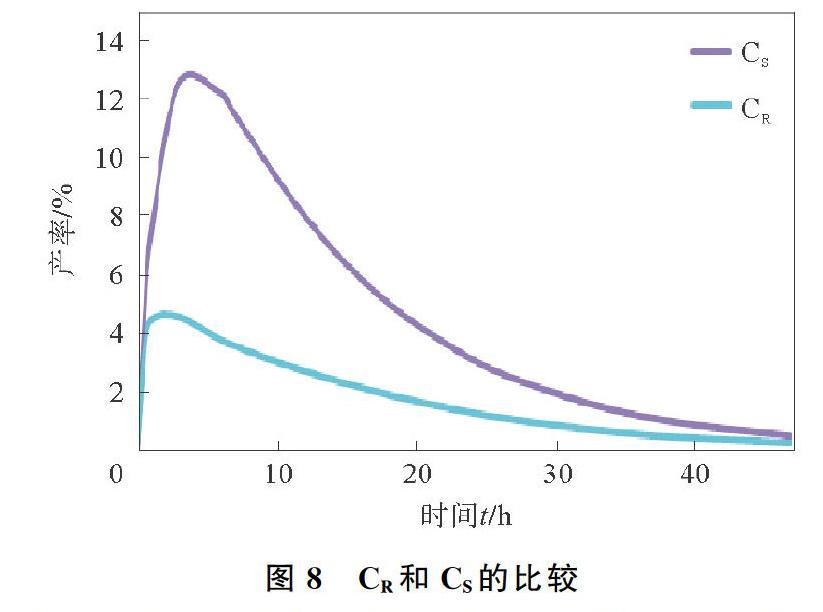
对于化学-酶反应,存在三种可能的情况,酶促反应抑制;酶与化学反应抑制;化学反应抑制。前两种情况增加酶浓度,可减轻由酶促反应引起的抑制,并提高酶促反应的速率。当E0为6 U/mL时,PR的产率为97.3%,而当E0为2 U/mL时,PR的产率仅为89.2%,这表明随着E0的增加,反应产率增加,即增加脂肪酶的量能加快酶促内酯化,使PR产率增加。中间体CR与反应式(1)和式(2)有关,其中反应式(1)生成CR,而反应式(2)消耗CR。因此,在动态共价动力学拆分系统中,CR的量由两个反应确定,CR和CS的比较如图8所示。
由图8可以看出,在反应的初始阶段,CR迅速增加,因为反应式(1)立即开始生成CR,而消耗CR的反应式(2)有延迟。随着反应的进行,CR升高到一定水平时,反应式(2)的速率迅速增加,并超过反应式(1)的速率。结果消耗的CR多于生成的CR,CR随着时间下降。CS与CR相似,但反应式(3)比反应式(2)慢,消耗的CS更少。CS主要通过反应式(1)的可逆反应返回起始原料,因此CS在系统中高于CR。
4结束语
本研究将可逆半硫代乙缩醛转化与脂肪酶催化对映选择性内酯化反应结合,构成了动态动力学拆分体系,采用一锅法丝孢酵母脂肪酶催化,制备了对映纯PR。研究结果表明,其转化率达到99.6%,产率达97.3%,对应体过量百分率达96.5%。本文首次建立的化学-脂肪酶动态动力学拆分体系的固有动力学模型,很好地拟合了实验数据。反应动力学揭示了酶催化内酯化是反应限制环节,因此增加脂肪酶的量,可以加速反应,从而使PR产率显著提高。
参考文献:
[1]Ren Y, Hu L, Ramstrm O. Multienzymatic cascade synthesis of an enantiopure (2R, 5R)-1, 3-oxathiolane anti-HIV agent precursor[J]. Molecular Catalysis, 2019, 468: 52-56.
[2]Zhang Y, Schaufelberger F, Sakulsombat M, et al. Asymmetric synthesis of 1, 3-oxathiolan-5-one derivatives through dynamic covalent kinetic resolution[J]. Cheminform, 2014, 45(24): 3826-3831.
[3]彭燕鸿, 彭燕鸿, 苏爱秋, 等. 微生物嗜热脂肪酶研究进展[J/OL]. 食品与发酵工业: 1-8[2020-10-22]. https: ∥doi. org/10. 13995/j. cnki. 11-1802/ts. 025090.
[4]张灿, 姜国芳, 杨江楠, 等. 多孔材料固定化脂肪酶的研究進展[J]. 分子催化, 2020, 34(4): 378-396.
[5]Chen Y, Zhang X, Zheng G, et al. Preparation of the enantiomerically enriched precursor of lamivudine (3TCTM) via asymmetric catalysis mediated by Klebsiellaoxytoca[J]. Process Biochemistry, 2019, 81(7): 77-84.
[6]Hu L, Schaufelberger F, Zhang Y, et al. Efficient asymmetric synthesis of lamivudine via enzymatic dynamic kinetic resolution. [J]. Chemical Communications, 2013, 49(88): 10376-10378.
[7]Sakulsombat M, Zhang Y, Ramstrm O. Dynamic asymmetric hemithioacetal transformation by lipase-catalyzed γ-lactonization: in situ tandem formation of 1, 3-oxathiolan-5-one derivatives[J]. Chemistry-A European Journal, 2012, 18(20): 6129-6132.
[8]Zhang Y, Hu L, Ramstrom O. Double parallel dynamic resolution through lipase-catalyzed asymmetric transformation[J]. Chemical Communications, 2013, 49(18): 1805-1807.
[9]Pornrapee V, Marcus A, Rikard L, et al. Dynamic combinatorial resolution: direct asymmetric lipase-mediated screening of a dynamic nitroaldol library[J]. Angewandte Chemie International Edition, 2007, 119(6): 9666-968.
[10]李凱. 基于新材料和新策略的洋葱伯克霍尔德菌脂肪酶固定化及其应用研究[D]. 武汉: 华中科技大学, 2019.
[11]Zhang Y Y, Liu J H. Kinetic study of enantioselective hydrolysis of (R, S)-ketoprofen ethyl ester using immobilized T. laibacchii lipase[J]. Biochemical Engineering Journal, 2011, 54(1): 40-46.
[12]Zhang Y Y, Lu P, Sun Q H, et al. Lipase-mediated direct in situ ring-opening polymerization of ε-caprolactone formed by a chemo-enzymatic method[J]. Journal of Biotechnology, 2018, 281: 74-80.
[13]Bornadel A, Cecilia Orellana kerman, Adlercreutz P, et al. Kinetic modeling of lipase-catalyzed esterification reaction between oleic acid and trimethylolpropane: A simplified model for multi-substrate multi-product ping-pong mechanisms[J]. Biotechnology Progress, 2013, 29(6): 1422-1429.
[14]Mathpati A C, Badgujar K C, Bhanage B M. Kinetic modeling and docking study of immobilized lipase catalyzed synthesis of furfuryl acetate[J]. Enzyme & Microbial Technology, 2016, 84: 1-10.
[15]Yadav G D, Trivedi A H. Kinetic modeling of immobilized-lipase catalyzed transesterification of n-octanol with vinyl acetate in non-aqueous media[J]. Enzyme & Microbial Technology, 2003, 32(7): 783-789.
[16]Zhang Y, Liu J. Purification and in situ immobilization of lipase from of a mutant of Trichosporonlaibacchii using aqueous two-phase systems[J]. Journal of Chromatography B, 2010, 878(11/12): 909-912.
[17]Ulrika T, Martin H, Karin S, et al. Structural, functional and chemical changes in Pseudozymaantarctica lipase B on exposure to hydrogen peroxide[J]. Biochimie, 2010, 92(12): 1867-1875.
[18]Trnvall U, Fürst C M, Hatti-Kaul R, et al. Mass spectrometric analysis of peptides from an immobilized lipase: focus on oxidative modifications[J]. Rapid Communications in Mass Spectrometry, 2010, 23(18): 2959-2964.
[19]Waghmare G V, Chatterji A, Rathod V K. Kinetics of enzymatic synthesis of cinnamyl butyrate by immobilized lipase[J]. Applied Biochemistry and Biotechnology, 2017, 183(3): 792-806.
[20]Zhang Y, Zhao Y, Jiang W, et al. Lipase-catalyzed oxidation of cyclohexanone to form ε-caprolactone and kinetic modeling[J]. ACS Sustainable Chemistry & Engineering, 2019, 7(15): 13294-13306.
[21]Kamble M P, Shinde S D, Yadav G D. Kinetic resolution of (R, S)-α-tetralol catalyzed by crosslinked Candida antarctica lipase B enzyme supported on mesocellular foam: A nanoscale enzyme reactor approach[J]. Journal of Molecular Catalysis B: Enzymatic, 2016, 132: 61-66.
Abstract: In order to effectively improve the yield of enantiomeric 1, 3-oxathiolane (PR) of pharmaceutical intermediates, dynamic covalent kinetic resolution was performed in this study to prepare PR and establish its kinetic model. Using one-pot process, enantiopure ((R)-5-acetoxy-1, 3-oxathiolan-2-yl) ethyl benzoate (PR) was synthesized with 99.6% conversion, 97.3% yield and 96.5% ee., and it was performed using an enzyme called Trichosporonlaibachii CBS 5791, with substrates of 2- (phenylmethoxy) acetaldehyde (A), 1, 4-dithiophene-2, 5-diol (B), and phenyl acetate (D). A kinetic model for the resolution was developed for the first time, which fits the experimental data very well. The transformation may follow a power law, and the enzymatic lactonization may follow a sequential mechanism with product inhibition. PR can be synthesized efficiently by the one-pot method, and the mechanism of the reaction is revealed by the kinetic model established.
Key words: kinetic model; lipase; hemithioacetal conversion; 1, 3-oxathiolane; Enzymatic synthesis
