地塞米松通过ROS-PI3K/AKT/GSK3β信号通路诱导成骨细胞凋亡
2021-04-02徐先立韩壮张忠文
徐先立 韩壮 张忠文
1 沈阳农业大学医院骨科,沈阳 110866;2 中国医科大学附属第一医院骨科,沈阳110001
骨坏死是一种比较常见的骨科疾病,指由于循环障碍导致的骨细胞和骨髓细胞缺血性死亡[1]。糖皮质激素(GCs)是广泛用于治疗炎症或自身免疫性疾病的药物,包括关节炎、系统性红斑狼疮和严重过敏反应[2]。近年来,大量研究表明过量使用GCs 会抑制成骨细胞增殖并促进其凋亡,从而导致患者发生非创伤性骨坏死[3-4]。长期接受GCs治疗的患者骨折发生率为30%~50%[5]。因此,探讨GCs介导的成骨细胞增殖和凋亡的分子机制至关重要,这可能有助于开发缓解GCs 诱导骨坏死的有效治疗方法。Dex 是一种人工合成的糖皮质激素,可用于治疗红斑狼疮、牛皮癣、过敏性疾病和慢性阻塞性肺疾病等多种疾病[6]。Sato AY等[7]的研究指出活性氧/内质网应激(ROS/ER)与Dex 诱导的成骨细胞和骨细胞凋亡有关。但仍需更多的研究来进一步探索Dex 诱导成骨细胞凋亡的分子机制。在本研究中,我们旨在研究ROS 在Dex 诱导的成骨细胞凋亡中的作用,为进一步了解Dex 诱导成骨细胞凋亡的分子机制提供可能的思路,并为减轻Dex 诱导的成骨细胞损伤和骨坏死提供可能的治疗靶标。
1 材料与方法
1.1 细胞培养 人成骨细胞株hFOB 1.19 购自美国ATCC 细胞保藏中心。hFOB 1.19细胞为人胚永生化成骨细胞系,是将SV40 LT 抗原基因转染入自然流产的胎儿组织中使其获得永生化的,与人成骨细胞具有高度同源性,是评价药物影响骨代谢的最佳细胞模型。将细胞培养在Ham"s F12和DMEM 1∶1的混合培养基(含10%胎牛血清)中,常规培养。
1.2 细胞干预及分组 细胞经0.25%胰蛋白酶(上海第一生化药业有限公司生产,规格:2.5万U)消化后,调整细胞密度为 5×103个/ml,每孔 200 μl 种植于 96 孔板中,培养24 h 后吸弃培养液,加入0、1、5、25、50、100、200 和300 μM的Dex(美国Sigma-Aldrich 公司),加入培养基至200 μl,每组设4个复孔,于37℃、5%CO2的培养箱中培养48 h,之后采用MTT法检测细胞增殖率。
为检测ROS 在Dex 影响成骨细胞增殖及凋亡中的作用,我们采用ROS 的清除剂抗坏血酸(AA)和N-乙酰-L-半胱氨酸(NAC)处理Dex(广东华南药业集团有限公司生产,规格:075 mg)干预后的成骨细胞,AA 和NAC 均购自美国Sigma-Aldrich 公司。基于此,将 hFOB 1.19 分为 4 组:对照组,Dex 组,Dex+AA 组和 Dex+NAC 组。对照组:不加药物,只培养 48 h;Dex 组:细胞采用 300 μM 的 Dex 处理 48 h。Dex+AA 组:细胞中同时加入 300 μM 的 Dex 及 2 000 μM 的AA,培养 48 h。Dex+NAC 组:细胞中同时加入 300 μM 的Dex及500 μM的NAC,培养48 h。
1.3 细胞增殖率检测 将5×103个/ml密度的细胞以每孔 200 μl 种植于 96 孔板中,细胞干预及分组同 1.2 部分,均以只含有培养基的孔为空白孔。处理48 h 后每孔加入10 μl 的CCK-8 溶液,于37℃孵育 1 h,用酶标仪在450 nm 处 检测 吸 光值(OD)。 细 胞增 殖 率(%)=(OD试验组-OD空白组)/OD空白组×100%。
1.4 细胞凋亡率检测 细胞分组同1.2部分,培养48 h后用 PBS 洗 3 次。然后将 100 μl 的细胞加入至 100 μl 的FITC-Annexin V/PI 检测液中,避光室温孵育30 min。之后采用流式细胞仪检测细胞凋亡率。
1.5 ROS 水平检测 细胞分组同1.2 部分,培养48 h后用 PBS 洗 3 次,然后用 10 μM 的 DCFH-DA 于 37℃避光孵育30 min,之后采用流式细胞仪检测平均荧光强度。活性氧检测试剂盒购自上海碧云天公司,严格按照试剂盒操作。
1.6 碱性磷酸酶(ALP)活性检测 细胞分组同1.2 部分,培养 48 h 后。取 10 μl 的细胞加入 96 孔板中,用碱性磷酸酶检测试剂盒(上海碧云天公司)中的显色底物调整体积至50 μl,摇晃均匀,于37℃孵育10 min。之后每孔加入 100 μl的反应终止液,用酶标仪在405 nm 处检测吸光值。ALP 活性单位的定义为:在pH 9.8 的二乙醇胺(DEA)缓冲液中,37℃条件下,每分钟水解对硝基苯磷酸二钠显色底物产生1 μmol对硝基苯酚所需的ALP 的量定义为一个酶活力单位,也称为一个DEA 酶活力单位。ALP 活性(%)=ALP 活性单位给药组/ALP活性单位对照组×100%。
1.7 Western Blot 细胞分组同1.2 部分,培养48 h 后采用RIPA 裂解液提取各组细胞中的总蛋白,BCA 试剂盒对总蛋白定量。将20 μg的总蛋白加入至上样缓冲液中,采用SDS-PAGE 凝胶电泳分离总蛋白,之后将总蛋白转至PVDF膜上。采用3%胎牛血清封闭45 min后,加入一抗,4℃孵育过夜,TBST 洗 3 次。孵育二抗,室温摇床孵育 1 h,TBST 洗3 次。用电化学发光试剂(ECL)于暗室发光。凝胶成像系统和Image J软件收集处理分析条带,GAPDH为内参。
1.8 统计学分析 所有数据采用均数±标准差表示,符合正态分布,数据采用SPSS22.0 软件进行统计学分析。多组建比较采用单因素方差分析,LSD 多重比较。P<0.05表示差异有统计学意义。
2 结 果
2.1 Dex对成骨细胞增殖和凋亡的影响 如图1所示,与0 μM 的Dex对比,100 μM、200 μM 和300 μM 的Dex可显著抑制成骨细胞的细胞增殖率(均P<0.05)。而且Dex 的半抑制浓度(IC 50)约在300 μM,因此我们选择300 μM 的Dex应用于后续的试验。如表1所示,与对照组对比,Dex组细胞的细胞增殖率显著降低(P<0.05),细胞凋亡率显著增加(P<0.05)。与 Dex 组对比,Dex+AA 组和 Dex+NAC 组细胞的细胞增殖率显著增加(P<0.05),细胞凋亡率显著降低(P<0.05)。
2.2 Dex对成骨细胞中ROS和ALP 水平的影响 如表2 所示,与对照组对比,Dex 组细胞的ROS 水平显著增加(P<0.05),ALP 活性显著降低(P<0.05)。与 Dex 组对比,Dex+AA组和Dex+NAC组细胞的ROS水平显著降低(均P<0.05),ALP活性显著增加(均P<0.05)。
2.3 Dex 对成骨细胞中PI3K 活性的影响 如表3 所示,与对照组对比,Dex 组细胞的p-PI3K 相对表达量和p-PI3K/PI3K 比值显著降低(P<0.05)。与 Dex 组对比,Dex+AA 组和Dex+NAC 组细胞的p-PI3K 相对表达量和p-PI3K/PI3K 比值显著增加(P<0.05)。各组间PI3K 相对表达量对比差异无统计学意义。
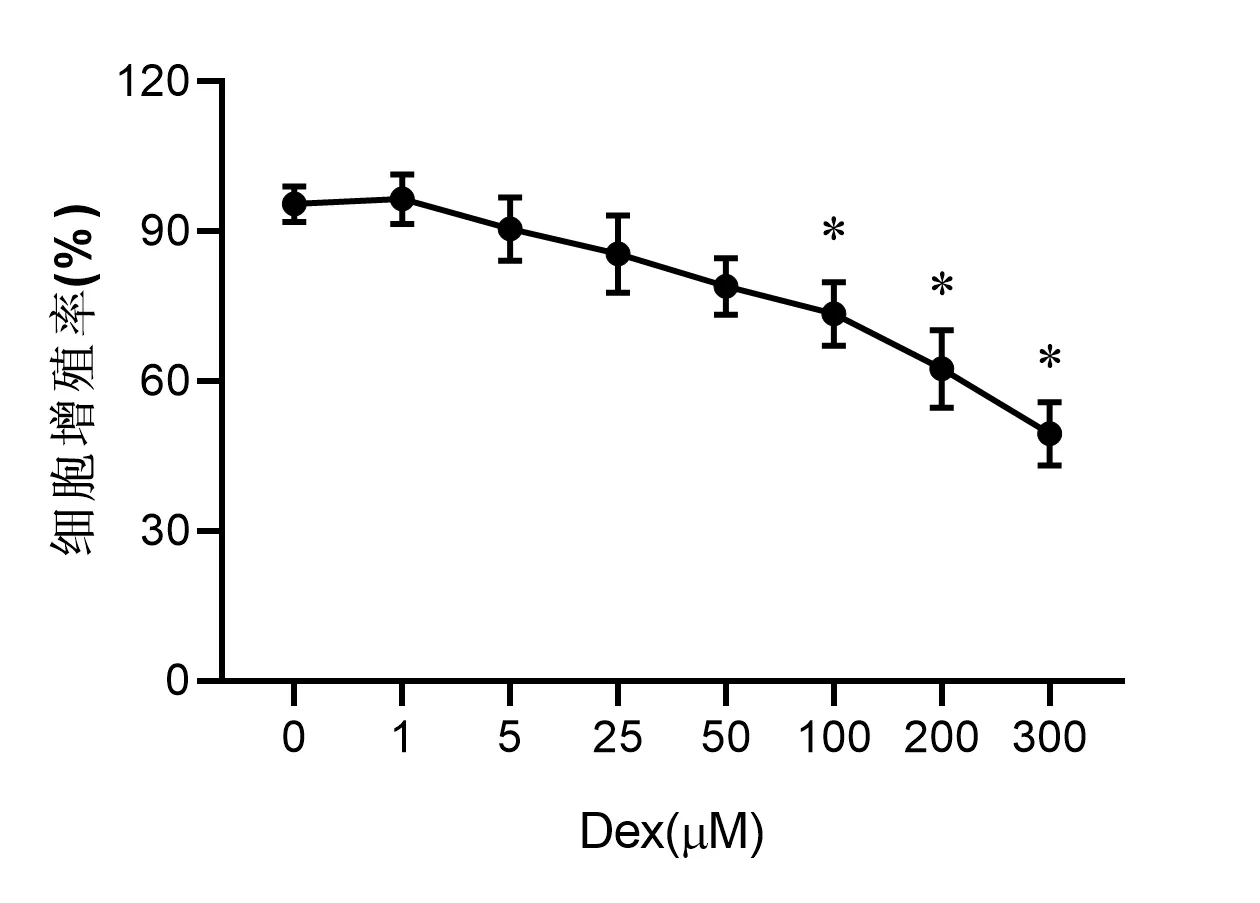
图1 Dex对成骨细胞增殖率的影响
表1 各组细胞增殖率和细胞凋亡率对比(±s,%)

表1 各组细胞增殖率和细胞凋亡率对比(±s,%)
注:与对照组对比,aP<0.05;与Dex组对比,bP<0.05
组别对照组Dex组Dex+AA组Dex+NAC组F值P值细胞增殖率100.00±1.76 51.47±5.62a 89.32±6.74b 94.58±5.01b 44.82<0.001细胞凋亡率3.71±1.16 18.42±3.19a 9.68±2.23ab 8.97±2.07ab 28.61<0.001
表2 各组细胞中ROS和ALP水平对比(±s)

表2 各组细胞中ROS和ALP水平对比(±s)
注:与对照组对比,aP<0.05;与Dex组对比,bP<0.05
组别对照组Dex组Dex+AA组Dex+NAC组F值P值荧光强度1.49±0.37 4.40±1.08a 2.05±0.61b 1.96±0.43b 14.68 0.003 ALP活性(%)100.00±0.83 69.71±7.53a 85.49±8.17ab 92.55±8.01b 14.09 0.002
表3 各组细胞中PI3K活性对比(±s)

表3 各组细胞中PI3K活性对比(±s)
注:与对照组对比,aP<0.05;与Dex组对比,bP<0.05
组别对照组Dex组Dex+AA组Dex+NAC组F值P值PI3K相对表达量0.57±0.13 0.62±0.16 0.63±0.11 0.59±0.14 0.16 0.92 p-PI3K相对表达量0.98±0.17 0.26±0.08a 0.76±0.12b 0.80±0.12b 23.76<0.001 p-PI3K/PI3K 1.72±0.35 0.43±0.10a 1.21±0.27b 1.35±0.21b 18.89<0.001
2.4 Dex 对成骨细胞中AKT 活性的影响 如表4 所示,与对照组对比,Dex 组细胞的p-AKT 相对表达量和p-AKT/AKT 比值显著降低(P<0.05)。与Dex 组对比,Dex+AA 组和Dex+NAC 组细胞的p-AKT 相对表达量和p-AKT/AKT 比值显著增加(P<0.05)。各组间AKT 相对表达量对比差异无统计学意义。
表4 各组细胞中AKT活性对比(±s)

表4 各组细胞中AKT活性对比(±s)
注:与对照组对比,aP<0.05;与Dex组对比,bP<0.05
组别对照组Dex组Dex+AA组Dex+NAC组F值P值AKT相对表达量0.85±0.21 0.86±0.19 0.88±0.23 0.94±0.16 0.16 0.92 p-AKT相对表达量0.56±0.10 0.19±0.06a 0.38±0.11b 0.42±0.08b 11.61 0.007 p-AKT/AKT 0.66±0.19 0.21±0.08a 0.45±0.04b 0.45±0.07b 11.04 0.001
2.5 Dex 对成骨细胞中GSK3β 活性的影响 如表5 所示,与对照组对比,Dex 组细胞的GSK3β 相对表达量、p-GSK3β 相对表达量和 p-GSK3β/GSK3β 比值均显著增加(P<0.05)。与Dex 组对比,Dex+AA 组和细胞的 p-GSK3β相对表达量和p-GSK3β/GSK3β 比值显著降低(P<0.05),GSK3β相对表达量无显著变化。
表5 各组细胞中GSK3β活性对比(±s)

表5 各组细胞中GSK3β活性对比(±s)
注:与对照组对比,aP<0.05;与Dex组对比,bP<0.05
组别对照组Dex组Dex+AA组Dex+NAC组F值P值GSK3β相对表达量0.18±0.05 0.37±0.06a 0.31±0.08 0.30±0.06 6.29 0.008 p-GSK3β相对表达量0.12±0.04 0.49±0.09a 0.26±0.05ab 0.22±0.07b 22.92<0.001 p-GSK3β/GSK3β 0.67±0.15 1.32±0.24a 0.83±0.19b 0.73±0.16b 9.87 0.002
3 讨 论
骨坏死是一种严重的退化性骨疾病,与成骨细胞凋亡有关[1]。成骨细胞是一种骨形成细胞,在骨生成和预防骨坏死中起关键作用[8]。GCs 的使用已成为骨坏死的最常见原因[3]。先前的研究已经证明,Dex对成骨细胞具有抑制作用,原因与其对成骨细胞的细胞增殖和细胞凋亡的作用有关[9]。在本研究中,我们发现100 μM、200 μM 和300 μM 的Dex 作用48 h 可显著抑制成骨细胞hFOB 1.19 的细胞增殖,且 Dex 的 IC 50 约在 300 μM,因此我们选择 300 μM 的 Dex应用于后续的试验。结果还发现,300 μM 的Dex 作用48 h可显著促进成骨细胞的凋亡。这些结果及研究均表明,Dex可抑制成骨细胞的增肌,并促进其凋亡。
过量的ROS 在诱导各种细胞凋亡中具有重要的作用[10]。过量的 ROS 产生将导致细胞内 ROS 压力增加,然后破坏细胞中的脂质、蛋白质和DNA 的结构和功能,从而通过线粒体介导的caspase 凋亡途径导致细胞凋亡[11]。Sato AY等[7]的研究证明ROS应激的增加参与Dex诱导的成骨细胞OB-6 凋亡。在研究中,我们发现Dex 可显著增加成骨细胞中ROS的水平约3倍,推测这可能是Dex诱导成骨细胞凋亡的机制。因此之后我们采用ROS 的清除剂NAC 或AA 与Dex 同时处理成骨细胞,结果表明NAC 或AA 均可降低Dex诱导的ROS 的产生,验证了NAC 或AA 对ROS 的清除效果。此外,我们还发现NAC或AA可增加Dex诱导的成骨细胞增殖,并抑制Dex 诱导的成骨细胞凋亡。这些结果进一步证实,Dex 对成骨细胞的促凋亡作用是通过过量ROS 的产生介导的。
ALP 可使局部钙、磷的浓度升高,并在胶原原纤维内沉积,对矿物质化机制的进行具有有利的作用,是促进骨间质矿化的重要酶。目前认为ALP活性是反映成骨细胞成熟状态的重要标志之一[12]。本研究结果显示,与对照组对比,Dex 组细胞的ALP 活性显著降低。与Dex 组对比,Dex+AA组和Dex+NAC 组细胞的ALP 活性显著增加。这些结果表明,Dex 可降低成骨细胞的活性,而在Dex 诱导的成骨细胞中加入ROS 清除剂后可显著增加成骨细胞的活性,进一步表明ROS在Dex抑制成骨细胞活性中的重要作用。
目前已经发现磷脂酰肌醇3-激酶/蛋白激酶3(PI3K/AKT)信号通路参与细胞增殖、分化、侵袭和凋亡相关的多种信号转导通路[8]。Ma P 等[13]的研究指 PI3K/AKT 信号通路的激活是大鼠成骨细胞增殖和分化的必要条件。在本研究中,我们还发现Dex 处理可下调成骨细胞hFOB 1.19 中p-PI3K 和 p-AKT 的表达,而 NAC 或 AA 可逆转 Dex 诱导的成骨细胞中PI3K/AKT 信号通路的失活。这些结果证实了Dex 通过抑制PI3K/AKT 信号传导途径诱导成骨细胞凋亡,并且ROS 应激的增强在Dex 诱导成骨细胞中PI3K/AKT 信号通路的失活中起重要作用。
糖原合成酶激酶3β(GSK3β)最初被认为是糖原代谢的调节剂[14]。GSK3β 是一种多功能的丝氨酸/苏氨酸激酶,可以调节能量代谢、细胞生长和细胞凋亡[15]。此外,GSK3β是PI3K/AKT 的关键下游底物和效应子[16]。在我们的研究中发现,Dex 可增加成骨细胞中 GSK3β 的活性,而 NAC 或 AA可逆转Dex诱导的成骨细胞中GSK3β 活性的增加。由于已经表明GSK3β是PI3K/AKT的关键下游底物,因此我们可以得出结论,Dex 通过PI3K/AKT/GSK3β 信号通路促进成骨细胞凋亡,并且ROS在其中起重要的调控作用。
本研究还具有一些不足之处,例如缺少动物实验的活体内研究,以及并未做信号通路的阻断实验等等,这些将是下一步研究要解决的问题。
总之,本研究表明Dex 可通过ROS-PI3K/AKT/GSK3β信号通路诱导成骨细胞凋亡,并建议ROS 可能是Dex 诱导的成骨细胞凋亡的治疗或预防靶标。另外,仍需进一步的体内研究以验证本研究中的发现。
利益冲突:作者已申明文章无相关利益冲突。
