影响脑卒中患者脑机接口上肢训练效果的相关因素
2021-04-02吴琼葛云祥马迪庞雪曹莹瑜潘钰窦维蓓
吴琼,葛云祥,马迪,庞雪,曹莹瑜,潘钰,窦维蓓,4
1.清华大学附属北京清华长庚医院/清华大学临床医学院康复医学科,北京市 102218;2.清华大学电子工程系,北京市 100084;3.北京石油化工学院光机电装备技术北京市重点实验室,北京市 102617;4.北京信息科学与技术国家研究中心,北京市100084
脑机接口(brain-computer interface,BCI)是一种人体内外环境交互控制的系统,它不依赖由外周神经、肌肉组成的脑输出通路,可直接反映思维活动过程中的脑神经活动信息[1-2]。基于运动想象的脑机接口(motor imagery brain-computer interface,MI-BCI)可以客观量化并强化运动想象任务的反馈、任务奖励和优化,并通过适当的感觉反馈“闭合”受损的感觉运动回路;影响并量化神经网络可塑性。MI-BCI 训练能显著改善脑卒中患者上肢肌电信号、关节活动度、运动功能和日常生活活动能力[3-4]。但MI-BCI 训练效果可能受患者病程、病灶部位、言语认知功能、精神心理状态、痉挛等多种因素影响,有必要研究影响脑卒中患者MI-BCI 上肢康复疗效的相关因素,以便定制个性化干预策略[5-6]。本研究在评估MI-BCI 训练对脑卒中后上肢运动功能障碍康复疗效的基础上,对治疗效果进行分类,比较不同类型患者间临床特征差异,并分析影响脑卒中患者MI-BCI 上肢训练疗效的相关因素。
1 资料与方法
1.1 一般资料
选取2018 年1 月至2019 年7 月北京清华长庚医院住院脑卒中患者,诊断符合中国急性脑卒中临床研究规范共识2018[7],并经头颅磁共振或CT 检查明确诊断。纳入、排除及脱落标准参考前期研究[8],同时波士顿诊断性失语症检查评分>3级。
最初共纳入29 例。训练中,因BCI 正确率<70%,不宜行MI-BCI 训练排除2 例;自行终止训练2例;未完成末次评估2 例。最终23 例完成训练和数据采集。
本研究经北京清华长庚医院伦理委员会批准(No.18172-0-02),并在中国临床试验注册中心注册(No.ChiCTR1900022128)。所有患者均在试验前签署知情同意书。
1.2 数据采集
采集患者以下数据:性别,年龄,病程,病变性质,病变半球,近3 个月内患侧腕、手部位是否进行过肉毒毒素注射,是否伴有失语症,训练前患侧手指屈肌改良Ashworth 量表(modified Ashworth Scale,MAS)评分和Fugl-Meyer评定量表上肢部分(Fugl-Meyer Assessment-Upper Extremities,FMA-UE)评分。病变部位根据牛津郡社区卒中研究分型[9]。患者一般资料见表1。
1.3 训练方法
患者在常规上肢康复训练基础上接受MI-BCI 上肢功能训练,每周5 d,连续4周。
常规康复训练包括作业治疗、运动疗法、物理因子治疗等,每天1 h。
MI-BCI 上肢训练包括模型建立阶段和实际训练阶段,10 次为1 组,组间允许患者休息1 min,每次训练共完成约100 次运动想象任务,并通过手部外骨骼完成患侧手指被动屈伸,共约1 h。训练前嘱患者避免眨眼、咳嗽、咀嚼、头部和身体移动,具体训练方案与前期研究相同[10]。
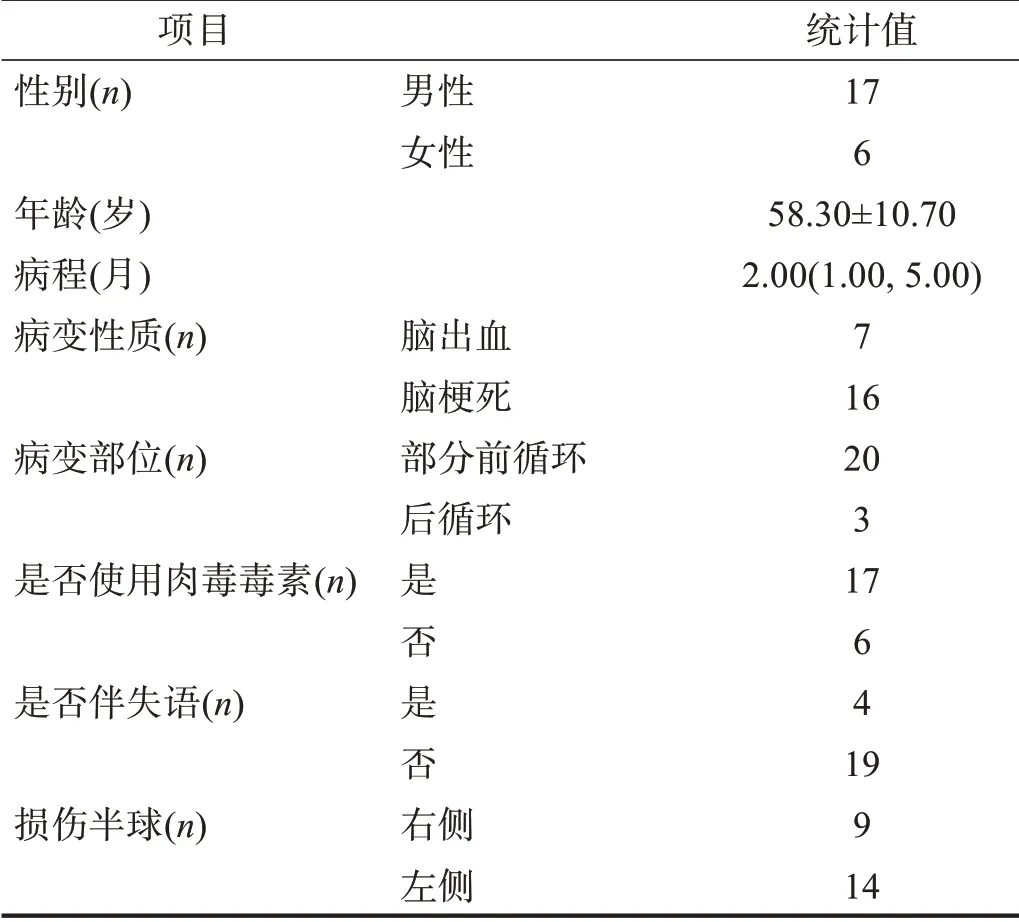
表1 患者一般情况
1.4 功能评定
训练前和训练20 d 后,进行患侧上肢运动功能评定和患侧手指屈肌肌张力评定。
采用FMA-UE 进行患侧上肢运动功能评定,忽略量表中上肢感觉、被动关节活动度、疼痛部分,反射项目部分。按肩、肘、腕、手部和协调/速度分别进行评测,5 项相加得到FMA-UE 总分;以肩与肘评分之和为FMA 上臂评分;腕与手评分之和为FMA 腕手评分。简化版FMA-UE 总分60 分,腕手分24 分,上臂分30分,评分越高功能越强[11]。
采用MAS 评定患侧手指屈肌肌张力[12-13]。为统计方便,0 级计0 分,I级计1 分,I+级计1.5 分,Ⅱ级计2分,Ⅲ级计3分,Ⅳ级计4分[14]。
所有评定均由同一名经过培训的人员进行,评定者对治疗情况不知情。
1.5 统计学分析
鉴于FMA-UE 腕手评分改善<2 分时,患者难以感受手功能变化,根据最小临床重要差异(minimum clinically important difference,MCID)的定义,本研究以训练后FMA-UE 腕手评分提高≥2 分为标准,将患者分为显效组(n=11)和非显效组(n=12)[11-12,15-16]。
采用SPSS 22.0 统计软件进行数据分析。计量资料采用Shapiro-Wilk 检验正态性,符合正态分布的以(±s)表示,采用组内比较采用配对t检验,组间比较采用独立样本t检验;不符合正态分布的用M(QL,QU)表示,组内比较采用配对Wilcoxon 检验,组间比较采用Mann-WhitneyU检验。分类变量采用χ2检验。因变量和自变量均为连续变量,符合正态分布的,采用Pearson 相关性检验;有一项不符合正态分布的,采用Spearson 相关性检验;自变量为分类变量的,使用交叉列联表分析。显著性α=0.05。
2 结果
2.1 训练效果
训练后,所有患者FMA-UE 总分、腕手分、上臂分均显著改善(P<0.001),MAS 评分无明显改善(P>0.05)。见表2。
两组训练后,FMA-UE 总分、腕手分、上臂分均改善(P<0.05);MAS 评分无显著性改善(P>0.05)。训练前,两组FMA-UE 总分、腕手分、上臂分无显著性差异(P>0.05);非显效组MAS 评分明显高于显效组(P<0.01)。训练后,显效组FMA-UE 总分、腕手分、上臂分均高于非显效组(P<0.05);非显效组MAS 评分仍明显高于显效组(P<0.01)。显效组治疗前后FMA-UE 总分、腕手分差值明显高于非显效组(P<0.01),上臂分差值无显著性差异(P>0.05)。见表3~表6。
2.2 相关因素
两组治疗前MAS 评分(表6)和是否使用肉毒毒素(表7)方面有显著性差异(P<0.05),其余变量无显著性差异(P>0.05)。见表7。

表2 患者训练前后上肢功能比较(n=23)
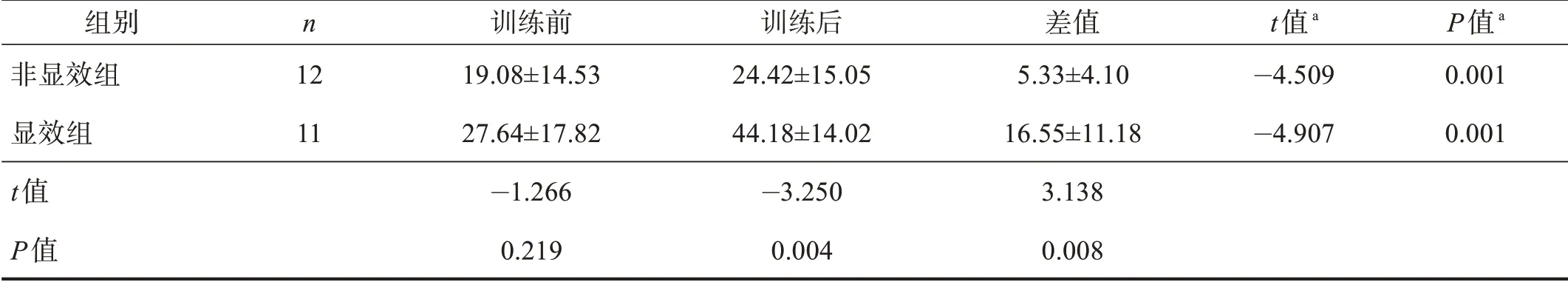
表3 两组训练前后FMA-UE总分比较

表4 两组训练前后FMA-UE腕手分比较

表5 两组训练前后FMA-UE上臂分比较

表6 两组训练前后MAS评分比较
2.3 相关性分析
分别以性别,年龄,病程,病变性质,病变半球,近3 个月内患侧腕、手部位是否进行过肉毒毒素注射,是否伴有失语症,训练前患侧手指屈肌MAS评分和FMA-UE 总分、腕手分、上臂分为自变量,以训练后FMA-UE 总分、腕手分、上臂分为因变量进行相关性分析,结果显示,伴有失语与FMA-UE 总分、上臂分负相关(P<0.05);MAS 评分与腕手分负相关(P<0.05);训练前后FMA-UE总分、腕手分、上臂分之间均呈正相关(P<0.05)。见表8。
3 讨论
本研究显示,经过MI-BCI 上肢训练,亚急性脑卒中患者FMA-UE 评分明显增加,改善程度总体大于MCID,与前期研究一致,提示MI-BCI训练可改善亚急性期脑卒中患者上肢运动功能。分组比较发现,虽然上肢各部分功能基线水平相同,但手部评分改善明显的患者,上肢功能改善程度较好,同时治疗前手指屈肌痉挛程度较低、肉毒毒素使用较少。相关性分析显示,训练后上肢功能水平与基线上肢功能水平、是否伴有失语症、手部痉挛程度相关。总体而言,基础运动功能差、伴有言语障碍和痉挛,可能是脑卒中上肢功能障碍患者MI-BCI训练效果的不利因素。

表7 两组特征变量比较
脑卒中偏瘫患者上肢功能恢复是神经康复的重点和难点,恢复程度存在个体间差异。影响上肢功能恢复的因素国内外报道不一。从神经解剖角度,病变大小、病变位置、下行运动路径,尤其是皮质脊髓束损伤程度,与功能预后显著相关[17-18];从神经生理功能角度,病灶周围乃至双侧半球网络的功能和结构变化导致患者间恢复水平的差异。从临床特征角度,残存运动功能是上肢功能预后最重要的预测因子[17,19-20],诸如早期耸肩动作出现[21]、患侧手指主动伸展[22]以及患手握力残存[23]都提示预后良好。本研究也显示,初始上肢运动功能是训练后上肢各部位运动功能恢复最重要的相关因素。值得注意的是,初始运动功能是皮质脊髓束损伤程度、脑网络功能代偿能力的反映,与患者操纵MI-BCI设备的表现并无相关性[24]。
痉挛是皮质脊髓束损伤的重要临床表现,早期出现严重手痉挛、手腕反射扭矩增大,与皮质脊髓束损伤严重程度相关,提示预后不良[12]。本研究显示,非显效组患侧手指屈肌痉挛程度、肉毒毒素使用均明显高于显效组;同时,患侧手指屈肌痉挛程度与训练后腕、手运动功能负相关,提示该组患者可能存在更严重的皮质脊髓束损伤。是否使用肉毒毒素与训练后上肢功能并无显著相关,可能因为肉毒毒素注射史只是从侧面反映患者存在较为严重的痉挛,并非降低疗效的不利因素。使用肉毒毒素可提高慢性脑卒中患者手部活动运动准确性、平滑性。本研究中,手指痉挛严重患者无法通过外骨骼完成手指被动屈伸,训练前使用肉毒毒素可为训练做好准备。
此外,卒中后抑郁、认知障碍、失语、偏盲、偏侧忽略、二便失禁等并发症也会影响患者上肢运动功能恢复[17,19]。存在自发言语是运动功能恢复的有利因素[25]。本研究中,虽然两组间失语发病率无显著性差异,但伴有失语与MI-BCI 训练后上肢运动功能相关,提示该因素不利于脑卒中上肢功能障碍患者MI-BCI训练效果。可能的原因是,本研究由于训练过程涉及听语音信号-看动作视频-闭眼完成运动想象-睁眼准备下一循环等较为复杂的指令,失语患者虽然言语障碍较轻,但仍然影响患者对信息的接受和表达,还可能涉及注意力和工作记忆等因素,导致训练效率低,康复效果差。失语症对MI-BCI 效果的影响还需进一步研究。
此前研究显示,年龄、性别、利手、优势半球、病变类型、发病部位等因素可能影响脑卒中患者上肢功能预后,但本研究中未显现以上因素对患者MIBCI训练效果有影响。
卒中类型和责任血管与上肢运动功能预后关系尚不明确。Frolov等[26]的随机对照多中心试验发现,MIBCI 对不同病程、严重程度和病变部位的脑卒中患者上肢运动功能均有改善作用。本研究中,病变部位、病变性质也未对患者训练效果产生影响,这符合运动恢复取决于受损和未受损半球功能重组和代偿功能的观点。因此脑卒中患者MI-BCI 神经机制的研究应该着重于脑网络特征而非解剖结构。

表8 影响MI-BCI训练效果的相关因素
双侧大脑半球功能存在明显差异,利手、损伤半球会对脑卒中后上肢运动功能预后造成影响。右利手患者右半球卒中后手功能恢复差于左半球卒中患者,而左半球卒中可能出现双手运动功能障碍[27]。对健康人的研究发现[28],感觉运动节律的侧向性会随优势侧有所不同,左利手受试者完成单次MI-BCI 任务准确性较差。本研究中,患者损伤半球未显现对训练效果的影响,可能与本次纳入患者均为右利手,两组间损伤半球分布较为均衡有关。
鉴于脑卒中康复的复杂性,脑卒中上肢运动功能康复的研究逐渐从临床观察发展为多模式多因素模型研究。van der Ⅴliet等[29]发现,年龄、性别、利手、优势半球、发病部位、伴发患侧忽略和注意力不集中、基础上肢功能评分等,可以预测发病后前6 个月上肢恢复模式。个体间MI-BCI 操纵能力存在巨大差异,也会显著影响临床效果。认知功能、感觉、运动想象能力[24]、心理因素[30]、年龄[31]、利手[32]、感觉运动节律偏侧性[33]以及药物,均可影响健康人MI-BCI 操纵表现。脑卒中患者的神经心理学评分[34]、脑电侧向指数和皮质激活强度[35],可预测脑卒中患者操纵MI-BCI表现,而静息态脑电信号对称指数和MI-BCI 分类准确性可作为患者上肢改善程度的预测指标[26,36]。
鉴于MI-BCI 训练的适用人群,认知障碍、情感障碍、偏侧忽略、肩手综合征等可能影响脑卒中上肢功能预后的因素均示予考虑。由于纳入患者的病程、年龄等基础状态较为集中,样本量较少,对病变类型、部位等因素分类较为简单,可能掩盖上述因素对训练效果的影响。进一步需补充对患者MI-BCI 分类正确率、脑电图、神经影像等脑功能属性特征的分析;扩大样本量、延长随访时间,进行回归分析,建立预测模型;设计个体化MI-BCI 训练方案,提高干预效果,拓展适应人群。
利益冲突声明:所有作者声明不存在利益冲突。
