玛咖多糖的提取条件及体外活性研究
2021-04-02李爱民吴晓磊高晓冬李子杰
冯 康,李爱民,,吴晓磊,高晓冬,李子杰,*
(1.江南大学 生物工程学院/糖化学与生物技术教育部重点实验室,江苏 无锡 214122;2.新时代健康产业(集团)有限公司,北京 102206)
玛咖(LepidiummeyeniiWalp.)原产于南美海拔3 500 m以上的安第斯山区,是叶子椭圆、根茎形似小圆萝卜的十字花科独行菜属一年生草本植物,又称印加萝卜。玛咖营养成分丰富,因在秘鲁具有悠久的栽种历史,所以有“秘鲁人参”“南美人参”的美誉。我国于2003年引种成功,如今在云南和新疆等地已形成了一定规模的种植产业。玛咖多糖的提取工艺有多种,包括热水浸提、超声波辅助浸提以及微波辅助浸提等。郑朋朋等[1]采用热水浸提的方式对玛咖多糖的提取率进行优化,在提取温度82 ℃下提取率达到9.6%。郝利民等[2]优化热水浸提玛咖多糖,提取率达到了15.9%,但提取温度高达100 ℃。研究表明:提取温度会对多糖的结构和生物活性产生影响,多糖在高温提取会发生部分降解,分子质量减少,并且多糖的抗氧化活性也会下降。浦跃武等[3]等通过比较超声波、微波和热水浸提这三种提取方式,发现超声波提取的效果最好,微波次之,热水浸提效果最差。超声波辅助热水浸提可以降低提取温度、减少提取时间[4]。
玛咖多糖具有抗疲劳[5-6]、抗肿瘤、调节免疫能力、调节内分泌等诸多功效[7-11],且毒性很小,作为功能性食品有很好的开发前景。目前对玛咖多糖的活性研究多集中在抗疲劳和抗氧化活性方面,对其降血脂的功效鲜有研究。本研究采用超声波辅助热水浸提的方式对玛咖多糖的提取条件进行优化,降低了提取温度,减少了提取时间;同时本研究利用体外实验研究其可能的降血脂功效,以期为玛咖多糖产品的开发提供依据。
1 材料与方法
1.1 材料与试剂
实验材料玛咖使用的是玛咖根部,采于2017年云南香格里拉地区,自然晾干直至实验。
淀粉酶(384 U/mL)、糖化酶(300 U/mL),诺维信(中国)生物技术有限公司;考来烯胺,上海麦克林生化科技有限公司;无水乙醇、氯仿、正丁醇为分析纯,苯酚为试剂纯,国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼[2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH],质量分数为97%,TCI(上海)化成工业发展有限公司;邻二氮菲(质量分数为99%)、牛磺胆酸钠(质量分数为97%)、甘氨胆酸钠(质量分数为98%)、糠醛溶液(质量分数99%)、胰蛋白酶(250 U/mg),Adamas试剂有限公司。
1.2 仪器与设备
SB25- 12DTDN型超声波清洗机,宁波新芝生物有限公司;HL- 2型恒流蠕动泵,上海沪西分析仪器厂有限公司;DEAE- 650M型离子交换柱、HW- 65F型葡聚糖凝胶柱,日本TOSOH株式会社;BIO- RAD iMark型酶标仪,美国伯乐公司;FD- 1000型冷冻干燥机、N- 1100型旋转蒸发仪,日本东京理化器械株式会社。
1.3 实验方法
1.3.1玛咖多糖的提取
1.3.1.1 提取方法
将玛咖根切块、打碎成粉,过100目筛,制成玛咖粉,取50 g玛咖粉按一定比例与蒸馏水混合,超声波辅助热水浸提,过滤得到玛咖水提物,减压浓缩至250 mL;在玛咖水提液中加入2 mL淀粉酶,60 ℃下反应3 h后加入2 mL糖化酶,60 ℃下反应2 h,100 ℃加热10 min使酶灭活,离心取上清液;向上清液中加入3倍体积无水乙醇,在体积分数为75%乙醇水溶液、4 ℃下醇沉12 h,将沉淀物用蒸馏水复溶;采用Sevag法对复溶液反复多次操作以去除蛋白;将去除淀粉和蛋白的水提溶液冻干,得到玛咖粗多糖(maca crude polysaccharides,MCP)。
1.3.1.2 提取率的测定
先用苯酚硫酸法测定总糖含量(以葡萄糖计),并通过换算因子测定玛咖多糖的提取率。
标准曲线的绘制:准确称取葡萄糖20 mg于100 mL容量瓶用重蒸H2O定容,分别吸取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL葡萄糖母液至试管中,补加水至2 mL,再依次加入1 mL 质量分数为6%的苯酚水溶液和5 mL浓硫酸,振荡10 min,静置10 min显色,于490 nm处测吸光度,以葡萄糖质量浓度ρ葡(mg/mL)为横坐标,吸光度A为纵坐标,绘制标准曲线。
换算因子F的计算见式(1)。
(1)
式(1)中,m1为玛咖多糖质量,mg;ρm为玛咖多糖的总糖质量浓度(以葡萄糖计),mg/mL;D为稀释倍数。
玛咖多糖提取率计算见式(2)。
(2)
式(2)中,w为玛咖多糖提取率;m2为玛咖干粉质量,mg;ρm为玛咖多糖的总糖质量浓度(以葡萄糖计),mg/mL;D为稀释倍数;F为换算因子。
1.3.1.3 响应面试验设计
根据Box- Behnken中心组合试验设计原理,采用4因素3水平的三元二次响应面分析方法,优化玛咖根多糖的提取工艺。在前期单因素试验的基础上,自变量的试验水平分别以-1、0、1进行编码(见表1),共设计29个实验点,中心实验重复5次,用来估计试验误差。

表1 玛咖多糖提取条件的响应面试验设计因素和水平Tab.1 Response surface methodology factors and levels of maca polysaccharide extraction condition
1.3.2玛咖多糖的组分分离
取200 mg玛咖粗多糖,溶于2 mL重蒸H2O,以1 mL/min的洗脱速度通过阴离子交换柱DEAE- 650M分离,先用重蒸H2O洗脱,待中性多糖全部收集之后,再用氯化钠水溶液浓度梯度(0.1、0.2、0.4、0.6 mol/L)洗脱。每管中多糖的含量用苯酚硫酸法测定,将含有多糖的试管收集,50 ℃旋转蒸发浓缩,冷冻干燥得到样品。对冷冻干燥的样品再次用葡聚糖凝胶柱(HW- 65F)分离,采用重蒸H2O洗脱达到脱盐纯化的目的,将含有多糖的样品旋转蒸发浓缩、冷冻干燥,得到纯化后的多糖样品。
1.3.3体外抗氧化活性实验
以维生素C(Vc)作为阳性对照,葡萄糖(Glc)作为阴性对照进行抗氧化活性的对比。
1.3.3.1 DPPH自由基清除活性的测定
取0.5 mL不同质量浓度(1、2、4、6、8、10 mg/mL)的样品与0.5 mL DPPH(0.04 mg/mL,溶于无水甲醇)混合,充分振荡并室温静置40 min,在517 nm处测定吸光度。
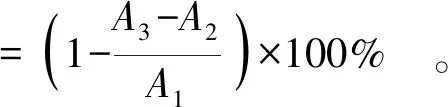
(3)
式(3)中,A1表示用无水甲醇代替样品的吸光度,A2表示用无水甲醇代替DPPH溶液的吸光度,A3表示DPPH溶液和样品混合反应后的吸光度。
1.3.3.2 羟自由基清除活性的测定
取0.5 mL不同质量浓度(1、2、4、6、8、10 mg/mL)的样品水溶液与0.5 mL硫酸亚铁水溶液(6 mmol/L)以及1 mL H2O2(6 mmol/L)混匀,静置10 min,再加入0.5 mL水杨酸溶液(6 mmol/L),混匀,静置30 min,在510 nm处测定吸光度。
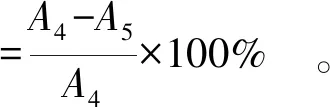
(4)
式(4)中,A4表示不添加样品的吸光度;A5表示添加样品反应后的吸光度。
1.3.4体外降血脂活性实验
玛咖多糖组分体外降血脂活性测定根据文献报道的方法并作适当修改[12-13]。分别取1 mL不同浓度的牛磺胆酸钠和甘氨胆酸钠标准品溶液(0.1、0.2、0.3、0.4、0.5 mmol/L)于具塞试管中,加入1 mL质量分数为0.25%的现配糠醛水溶液,混匀,冰浴5 min,加入5 mL 质量分数为70%的H2SO4水溶液于70 ℃水浴10 min,取出冰浴2 min,在510 nm处测定吸光度。以胆酸盐浓度为横坐标,吸光度为纵坐标绘得胆酸盐浓度标准曲线,根据标准曲线计算样液中胆酸盐的浓度。胆酸盐结合实验流程见图1,在具塞试管中加入20 mg的多糖粉末,加入1 mL 0.01 mol/L HCl溶液,充分混匀,37 ℃振荡消化1 h用来模拟胃消化,然后用0.1 mol/L的NaOH溶液调节pH值至6.3,然后加入2 mL 10 mg/mL的胰蛋白酶,混匀后37 ℃孵育1 h来模拟小肠消化。分别加入2 mL 0.5 mmol/L甘氨胆酸钠和牛磺胆酸钠水溶液混匀,37 ℃振荡1 h,用3 kDa超滤管4 000 r/min离心30 min。如果多糖与胆酸盐结合,透过液中为未与多糖结合的胆酸盐,测定透过液中的胆酸盐浓度,即可得出多糖与胆酸盐的结合率。取1 mL透过液于具塞试管中,加入1 mL质量分数为0.25%的现配糠醛水溶液,混匀,冰浴5 min,加入5 mL质量分数为70%的H2SO4水溶液于70 ℃水浴10 min,取出冰浴2 min,在510 nm处测定透过液吸光度。以葡萄糖作为阴性对照,以考来烯胺为阳性对照,按考来烯胺的结合率为100%,计算各种多糖对胆酸钠盐的结合率。
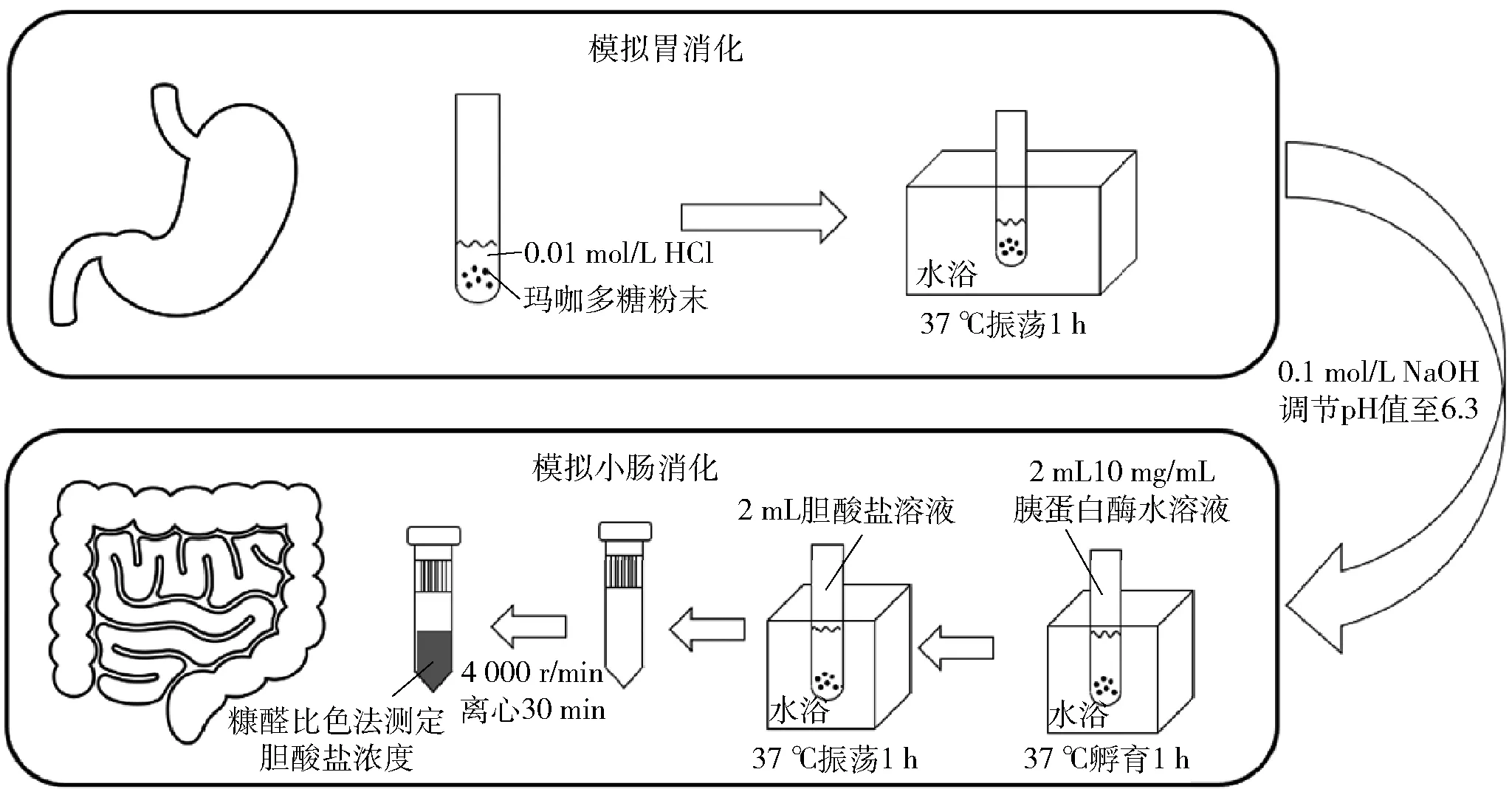
图1 玛咖多糖胆酸盐结合实验流程Fig.1 Procedure for binding ability experiment of maca polysaccharide cholate
1.4 统计分析
响应面试验设计和分析采用Design-Expert 10软件。其余实验数据采用“平均值±标准差”的方式表示,采用Prism 8.0软件做数据处理和显著性分析。
2 结果与分析
2.1 玛咖多糖提取条件的优化
2.1.1响应面试验结果
Zhang等[14]在研究不同温度对桑葚多糖结构和功能的影响时发现30 ℃提取时,多糖分子质量为536.45 kDa,而90 ℃下分子质量只有110.23 kDa,且低温提取的多糖显示出比高温提取更好的抗氧化活性。项浩特等[15]研究了温度和时间对玛咖多糖提取效率的影响,发现在70 ℃以上随着温度和时间的增加,提取率不断降低。因此,本研究选择采用超声波辅助热水浸提的方式提取多糖,并用响应面法优化提取率。采用Design-Expert 10 软件设计实验方案,见表2。根据此实验方案,按照1.3.1.1节的方法提取玛咖多糖,并用苯酚硫酸法测定多糖含量,提取率见表2。
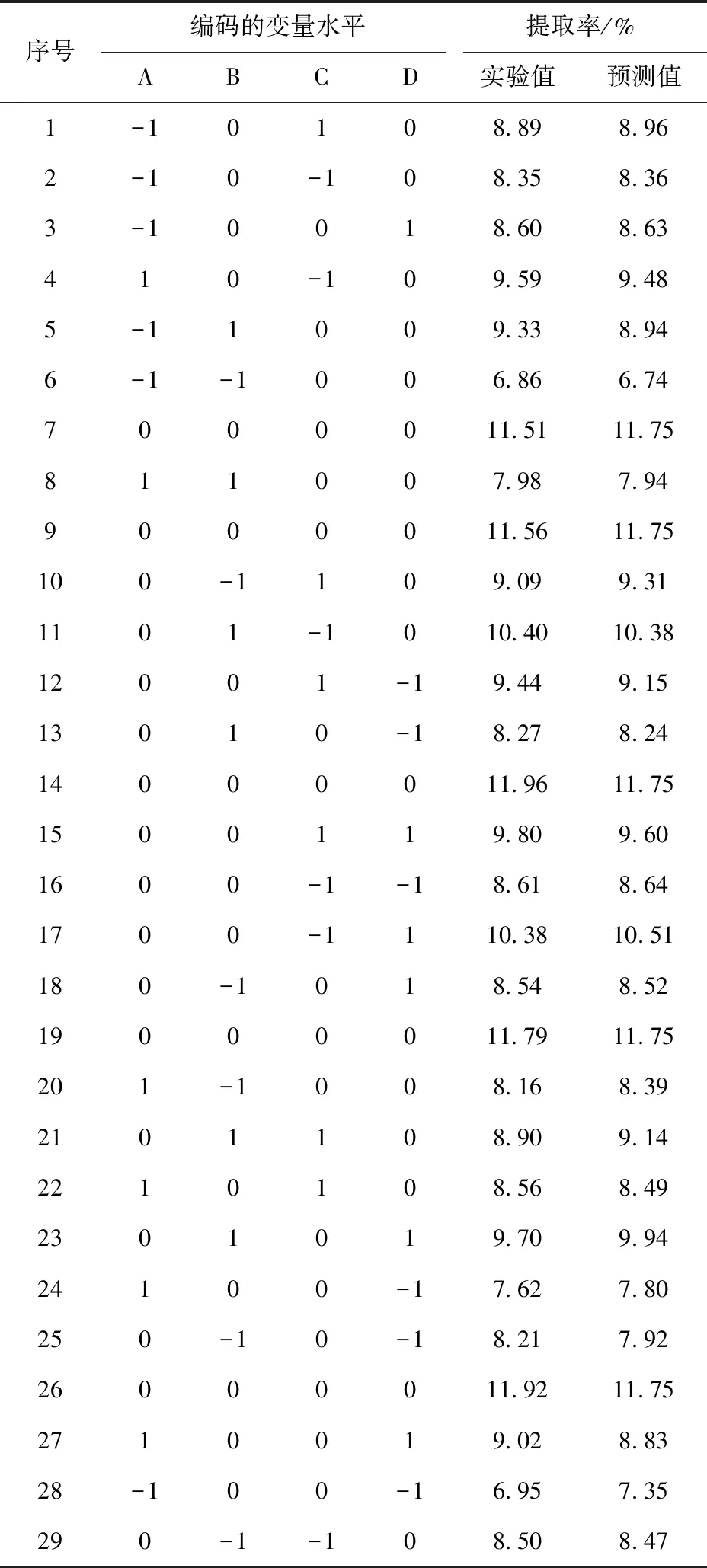
表2 玛咖多糖提取条件的响应面试验结果Tab.2 Results of response surface experiment of maca polysaccharide extraction conditions
2.1.2响应面模型拟合分析
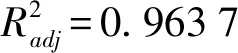
2.1.3各因素交互作用分析
各因素的交互作用对玛咖多糖提取率的等高线与响应面见图2。从等高线可以看出两个因素之间的交互作用的强弱,等高线越圆相互作用越弱,等高线椭圆形越明显,相互作用越强[16]。从响应面曲线可以看出各因素对响应值(即玛咖多糖提取率)的影响程度,曲面越陡,影响程度越大、越平坦,影响程度就越小[17]。从4个因素相互作用中选出3个代表性的结果,对比图2(a)与图2(b),可以发现温度与时间的交互作用比温度与超声功率的交互作用更强,从图2(c)可以看出料液比对玛咖多糖提取率的影响程度比时间大。

图2 各因素的交互作用对玛咖多糖提取率的影响Fig.2 Interaction of different factors on extraction rate of mace polysaccharide
通过软件Design-Expert 10分析,得到较佳的提取条件为提取温度50.23 ℃、超声功率217.74 W、提取时间42.35 min、料液比1∶32.34 g/mL,理论提取率为11.86%,考虑到实际提取的方便性,将各因素的值修正为提取温度50 ℃、超声功率220 W、提取时间42 min,料液比1∶32 g/mL,最后得到的实际玛咖多糖提取率为11.0%,与理论预测值接近。
2.2 玛咖多糖的组分分离结果
采用阴离子交换柱DEAE- 650M对玛咖多糖各组分进行分离,用苯酚硫酸法测定每管中多糖的浓度,见图3。固定洗脱速度为1 mL/min,先用重蒸H2O洗脱,得到含量最多的中性玛咖多糖1(maca polysaccharides 1,MPS1),再用氯化钠浓度梯度洗脱,在0.1 mol/L NaCl和0.2 mol/L NaCl水溶液下分别分离得到2个含量较少组分,分别命名为玛咖多糖2(maca polysaccharides 2,MPS2)和玛咖多糖3(maca polysaccharides 3,MPS3)。之后,对MPS1、MPS2和MPS3进行再次纯化并去除其中的NaCl,如将含有MPS1的试管汇总后冷冻干燥,用1 mL重蒸H2O复溶,用葡聚糖凝胶柱HW- 65F进行再次纯化,收集汇总纯化后的MPS1,再次冷冻干燥,最后得到MPS1多糖样品。

图3 玛咖粗多糖组分分离Fig.3 Separated fractions of maca crude polysaccharide
2.3 玛咖多糖体外抗氧化活性分析
2.3.1DPPH自由基清除效果分析
玛咖多糖对DPPH自由基清除率见图4,由图4可以看出随着多糖浓度的增加,3种多糖对DPPH自由基的清除效果都呈现出上升的趋势,其中,MPS1对DPPH自由基清除效果最佳,在5 mg/mL的浓度下,基本达到了较佳清除率81.8%。MPS2在超过5 mg/mL后清除效果有明显的增加,在10 mg/mL的浓度下清除效果也达到了63.7%。此外,粗多糖MCP在3 mg/mL浓度以下时清除率低于MPS1,之后清除率与MPS1基本持平,在5 mg/mL的浓度下达到较佳清除率83.9%,MCP和MPS1的半数抑制浓度(IC50)分别为2.411 mg/mL和2.339 mg/mL。MCP中MPS1占到绝大部分,MCP的清除率与MPS1类似,说明MPS1组分是起到DPPH自由基清除的主要原因。维生素C在0.001~0.005 mg/mL质量浓度下对DPPH自由基清除效果随着浓度提高急剧提升,从35.8%提高到81.6%,在1 mg/mL质量浓度达到较佳清除率99%,MCP、MPS1和MPS2的清除效果均低于维生素C。

图4 玛咖多糖的DPPH自由基清除效果Fig.4 Scavenging effect of DPPH radical of maca polysaccharide
2.3.2羟基自由基清除效果分析
玛咖多糖对羟基自由基清除率见图5,由图5可以看出MCP、MPS1和MPS2对羟自由基均有较好的清除效果,随着多糖浓度的提高,对羟自由基的清除率也有所提高。其中MCP在10 mg/mL的质量浓度下清除率达到了73.3%,半数抑制浓度(IC50)为2.388 mg/mL。MPS2在10 mg/mL时清除率达到了76.7%,MPS1的清除效果随着浓度增大变化不大,在1 mg/mL时达到39.8%,高于MCP和MPS2,10 mg/mL时清除率达到56.8%,而MPS3对羟基自由基没有清除效果,在各个浓度下清除率均与阴性对照组相似。
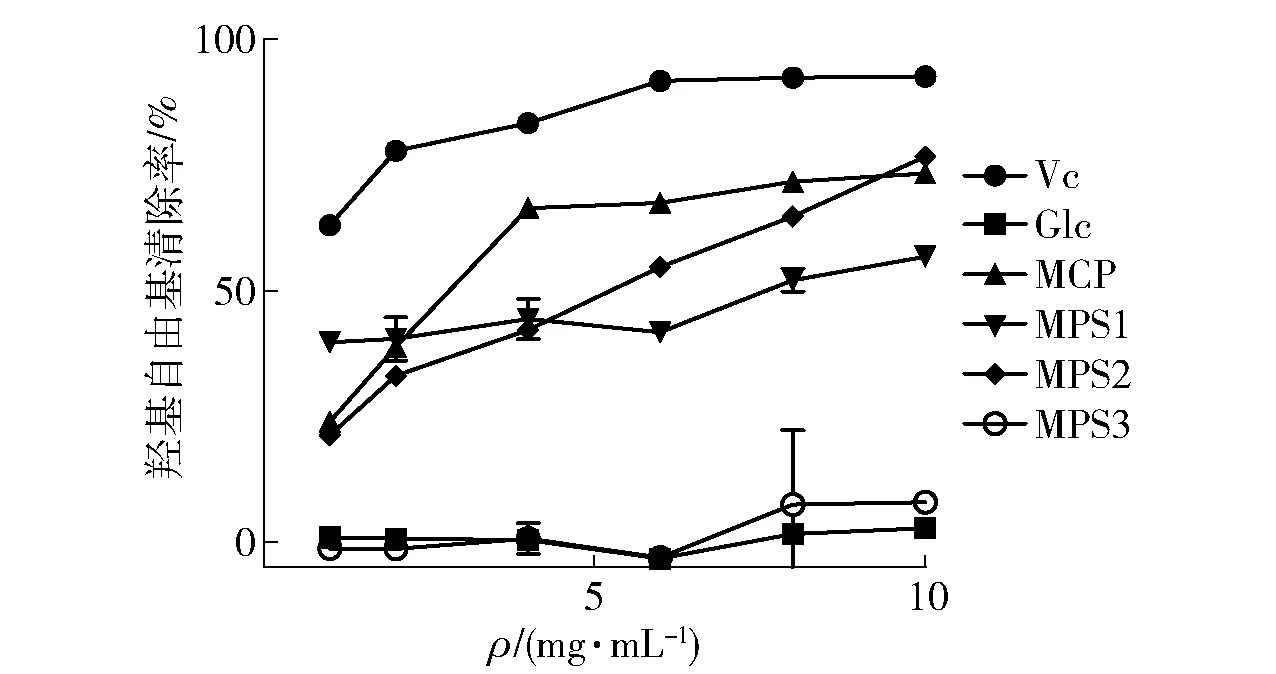
图5 玛咖多糖的羟基自由基清除效果Fig.5 Scavenging effect of hydroxyl radical of maca polysaccharide
2.4 玛咖多糖体外降血脂活性分析
肝脏内的胆固醇降解成胆汁酸排入肠道,其中95%的胆汁酸会通过重吸收经门静脉返回肝脏,形成结合胆汁酸并再次排入肠道,此过程为肝肠循环[18]。胆汁酸对维持人体内胆固醇的平衡起到至关重要的作用,一旦阻碍了胆汁酸的肝肠循环,肝脏就会通过降解更多的胆固醇来弥补胆汁酸的缺失,这就使得血液中的胆固醇流入肝脏,起到了降血脂的作用[19]。而甘氨胆酸和牛磺胆酸均属于结合型初级胆汁酸,常与钠离子或钾离子结合形成结合型初级胆汁酸盐,这是胆汁酸的主要存在形式。多糖类物质降血脂的主要原理是在溶液中形成网状结构,能在小肠中够吸附住胆汁酸,阻止胆汁酸重吸收。
玛咖多糖对2种胆酸盐的结合率见图6,由图6可以看出,与阴性组对比,4种多糖对牛磺胆酸钠的结合均有显著性,但只有MCP和MPS3对甘氨胆酸钠的结合有显著性差异(P<0.05)。以考来烯胺为阳性对照,MPS3在体外对2种胆酸钠盐的结合能力最好,对牛磺胆酸钠的结合率为49.1%,对甘氨胆酸钠的结合率为32.3%,造成两种胆酸钠盐结合能力不一致的原因可能与两种胆酸钠的分子结构有关,牛磺胆酸钠的分子质量比甘氨胆酸钠更大,更易被溶于水后形成网状结构的MPS包裹结合。同时,横向比较4种多糖,可以推测MPS3形成的网状结构可能更加紧密。

图6 玛咖多糖对胆酸钠盐的结合能力Fig.6 Binding capacity of maca polysaccharide toward sodium cholate
3 结 论
研究采用超声波辅助热水浸提的方法,响应面优化之后得到较佳的提取条件为提取温度50 ℃、超声功率220 W、提取时间42 min,料液比1∶32 g/mL,最后得到的实际玛咖多糖提取率为11.0%。MCP、MPS1和 MPS2具有较强的抗氧化活性,对DPPH自由基的较佳清除率分别为83.9%、81.8%和63.7%,对羟基自由基的较佳清除率分别为73.3%、56.8%和76.7%;MPS3虽然没有抗氧化活性,但是在体外对牛磺胆酸钠和甘氨胆酸钠的结合率分别达到了49.1%和32.3%,推测玛咖多糖可能会通过吸附结合胆酸钠盐的方式,减少肝肠循环,从而具有降低血脂的活性。
