沉默GTPBP4基因表达对食管癌细胞增殖、侵袭和化疗敏感性影响*
2021-04-02张翠红吕欣侯春立张建军马博敬范才
张翠红,吕欣,侯春立,张建军,马博敬,范才
050082 石家庄,解放军联勤保障部队第九八〇医院 放疗科(张翠红、张建军、马博敬、范才), 肿瘤科(侯春立);055450 河北 邢台,柏乡县中心医院 医务科(吕欣)
癌症是目前人类最致命的疾病之一,而食管癌在癌症导致的死亡中排名第8,并且大约一半的病例发生在中国,食管鳞状细胞癌占食管癌病例的90%[1-2]。手术辅以放化疗的综合治疗手段是目前临床绝大多数中晚期食管癌患者的主要治疗措施,并且新辅助化疗改善了食管癌患者的预后,大大提高了患者术后5年的生存率[3-4]。因此,如何有效提高肿瘤对化疗药物的敏感性已经成为当前食管癌研究的一个新方向。
GTP结合蛋白4(GTP binding protein 4,GTPBP4)是一种定位于核仁的新型G蛋白,参与核糖体60S亚基合成和成熟的鸟苷三磷酸酶(guanosine triphosphatase,GTPase)的一个新成员,与细胞增殖和生长密切相关,是近年发现的凋亡抑制基因[5-6]。目前仅少部分研究发现GTPBP4可能对结肠癌[7]、神经胶质瘤[8]的生物学行为有一定影响,但有关GTPBP4在食管癌中的研究相对较少,有关其在食管癌化疗敏感性方面的研究更是鲜见。本研究首先通过GEO数据库,分析食管癌患者组织中GTPBP4的表达情况,然后将LV-GTPBP4-siRNA干扰慢病毒转染至食管癌EC109细胞,观察沉默GTPBP4基因后对细胞增殖、细胞周期、侵袭能力及化疗敏感性的影响,为食管癌基础和临床研究提供理论和实验依据。
1 材料与方法
1.1 材料与试剂
人食管黏膜上皮细胞系(human esophageal epithelial cell,HEEC)及食管癌细胞系EC109、EC9706和KYSE-150均购自中国细胞资源库(北京),液氮中保存。DMEM培养基及胎牛血清FBS购自中国Gibco公司;pGCSIL-GFP/LV-GTPBP4-siRNA慢病毒载体购自上海吉凯基因科技有限公司;氟尿嘧啶(5-Fu,每支250 mg,批号:1236),为天津金耀氨基酸有限公司产品;顺铂(100 mg,货号:J-SD8810-100),为上海研谨生物有限公司产品。CCK8试剂购自武汉默沙克生物科技有限公司;TRIzol试剂购自美国Invitrogen公司;PCR引物序列购自上海生工生物股份有限公司;cDNA反转录反应试剂盒和SYBY Green PCR试剂盒购自日本TaKaRa公司;Annexin V-FITC/PI双染细胞凋亡试剂盒购自美国BD公司;兔多克隆抗体GTPBP4和辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔二抗购自中国武汉proteintech公司;细胞裂解及蛋白抽提试剂、蛋白浓度检测试剂考马斯亮蓝、Western blot配胶试剂盒购自江苏碧云天生物技术有限公司;PVDF膜、ECL发光液购自美国Millipore公司。Transwell小室购自美国Millipore公司;Matrigel购自美国BD公司。流式细胞仪购自美国BD公司;PCR扩增仪购自美国MJ Research Inc公司。
1.2 方法
1.2.1 细胞培养 人食管黏膜上皮细胞系HEEC及食管癌细胞系EC109、EC9706和KYSE-150均在含10%胎牛血清、1%青霉素/链霉素的DMEM培养基中培养,于37℃、5%CO2恒温培养箱培养,用含0.25%的胰蛋白酶进行消化传代。
1.2.2 实时荧光定量PCR(real-time quantitative pol-ymerase chain reaction,RT-qPCR)检测GTPBP4mRNA的表达 收集对数生长期的4种细胞,按Trizol操作说明书提取细胞总RNA,检测及确定核糖核酸浓度,使用逆转录试剂盒将总RNA逆转录为cDNA。GTPBP4基因的上游引物序列为5’-GATGAAGTATGGCG-ACTCTCTCT-3’,下游引物序列为5’-GTATTCGGATCAATGGTTGGCA-3’;内参照 β-actin的上游引物序列为5’-CATGTACGTTGCTATCCAGGC-3’,下游引物序列为5’-CTCCTTAATGTCACGCACGAT-3’(引物购自上海生工生物股份有限公司)。PCR反应条件:95℃ 2 min ;95℃ 15 s,60℃ 1 min ;共40个循环。实验中每个样品重复检测3次,以2-ΔΔCt值表示目的基因的相对表达量。
1.2.3 Western blot检测GTPBP4蛋白的表达 收集对数生长期的4种细胞,根据蛋白提取试剂盒操作说明提取细胞总蛋白,考马斯亮蓝法测定蛋白浓度,SDS-PAGE凝胶电泳分离,转膜,封闭,加入一抗(GTPBP4:1∶1 000),4℃摇床孵育过夜,加入HRP标记的山羊抗兔二抗IgG(1∶2 000),室温下孵育1.5 h,化学发光仪上进行显色,β-actin作为内参,利用Image J图像分析系统测定各条带灰度值,以目的蛋白条带灰度值与内参照β-actin条带灰度值的比值表示目的蛋白的相对表达水平。
1.2.4 慢病毒感染EC109细胞 取处于对数生长期的EC109细胞,胰酶消化,制成细胞悬液,以1.5×105个/孔接种于6孔板中,37℃、5%CO2培养箱中培养至细胞融合度达到约30%;根据制造商的指南进行感染,感染复数值(multiplicity of infection,MOI)为10,加入适宜量LV-GTPBP4-siRNA病毒,设为干扰组(LV-GTPBP4-siRNA组);阴性对照组转染含有非特异性干扰序列的阴性病毒(LV-NC组);未做任何处理的细胞为空白对照组(NC组)。感染72 h后显微镜下观察细胞荧光表达情况,荧光率大于80%,收集各组细胞提取RNA和蛋白,以实时PCR和Western blot检测沉默效率;感染效率低于80%的实验组,重新进行感染实验。
1.2.5 CCK-8检测细胞增殖能力 取慢病毒感染72 h后的3组EC109细胞,经胰蛋白酶消化成细胞悬液,以每孔1×105个细胞接种于96孔板中,每孔接种100 μL,每组设5个复孔,96孔板放入孵箱内继续培养24、48、72 h 后,更换新鲜无血清培养基100 μL,各孔加入CCK-8 溶液10 μL,放入37℃孵箱继续培养4 h,用酶标仪检测450 nm波长处的吸光度(optical density, OD),使用GraphPad Prism 7.0软件绘制细胞生长抑制曲线。
1.2.6 流式细胞法检测细胞周期分布 慢病毒感染后72 h的3组EC109细胞,胰酶消化并收集3组细胞,用PBS洗涤并重悬细胞,细胞密度为2×105个/mL,取1mL单细胞悬液,离心去上清,加入1mL 70%的预冷乙醇,4℃固定过夜。染色前用PBS洗涤2次,加入100 mg/L的RNaseA,37℃水浴30 min。再加入500 μL(50 mg/L),碘化丙啶(propidium iodide, PI)染色液混匀,4℃避光反应30 min后,转移至流式细胞仪进行检测,每组重复3次。
1.2.7 CCK8检测EC109细胞对化疗药物的敏感性 慢病毒感染72 h后收集NC组、LV-NC组和LV-GTPBP4-siRNA组细胞,接种于96孔板中,每孔约2×103个细胞,继续培养24 h细胞贴壁后,分别加入0、12.5、25.0、50.0、100.0、200.0 μmol的顺铂,或0、25、50、100、200、400 μmol的5-氟尿嘧啶,其中0 μmol为对照组,同时设立空白组(只含培养基不含药物和细胞)进行校正,每组样品5个复孔。继续培养48 h后,每孔加人CCK8溶液10 μL,继续培养4 h,用酶标仪检测450 nm波长处的OD值,细胞存活率(cell survival rate,CSR)=(ODLV-GTPBP4-siRNA组-OD空白组)/(ODNC组-OD空白组)×100%,细胞抑制率(cell inhibition,CI)=1-细胞存活率。使用GraphPad Prism 7.0软件计算细胞的半数抑制浓度(50% inhibiting concentration,IC50)及绘制细胞存活率曲线。
1.2.8 Transwell小室实验检测细胞侵袭能力 用DMEM培养液将预包被基质胶Matrigel稀释(1∶6),取80 μL加入至Transwell上室,37℃放置过夜。慢病毒感染72 h后收集NC组、LV-NC组和LV-GTPBP4-siRNA组细胞,接种于6孔板中,每孔约5×104个细胞,继续培养24 h,分别加入终浓度为3 μg/mL的顺铂,继续培养48 h后,胰酶消化制备成每孔4×104个细胞悬液,接种至Transwel上室铺匀(已铺基质胶),下室加入600 μL含20% FBS的DMEM培养液,在5% CO2、37℃培养箱中培养24 h,取出Transwell小室,用棉签拭去聚碳酸酯膜表面的Matrigel胶,PBS冲洗,4%的多聚甲醛固定20 min,0.1%结晶紫染色30 min,PBS冲洗晾干,在荧光显微镜下计数穿过基质胶的细胞,以此反映细胞的侵袭能力。
1.3 统计学方法
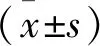
2 结 果
2.1 GEO数据库分析GTPBP4在人食管癌组织中的表达
GEO数据库中分析16例人正常食管组织及配对16例食管癌组织中GTPBP4的表达情况。结果表明,人食管癌组织中GTPBP4明显高于正常食管组织(P<0.001)(图1)。 以上结果提示,GTPBP4基因作为癌基因,可能与食管癌的发生和发展相关。
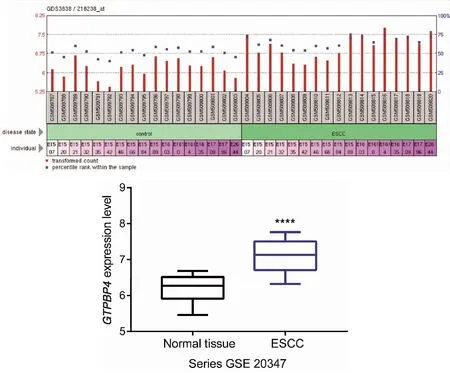
图1 GEO数据库分析GTPBP4在人食管癌组织中的表达(****P<0.001)
2.2 人食管黏膜上皮细胞和食管鳞癌细胞系GTPBP4的表达
RT-qPCR和Western blot法检测人食管黏膜上皮细胞系HEEC及食管癌细胞系EC9706、EC109和KYSE-150细胞GTPBP4mRNA和蛋白表达水平。EC9706、EC109和KYSE-150细胞GTPBP4mRNA相对表达水平分别为2.66±0.32、4.62±0.06、3.38±0.17,明显高于HEEC细胞(均P<0.001)(图2A);EC9706、EC109和KYSE-150细胞GTPBP4蛋白相对表达水平分别为2.46±0.56、3.95±0.36、3.18±0.10,明显高于HEEC细胞(P<0.01,P<0.001,P<0.001)(图2B、C),其中EC109细胞GTPBP4mRNA和蛋白表达水平较EC9706和KYSE-150细胞升高更为明显,故以EC109细胞系作为进一步研究的对象。
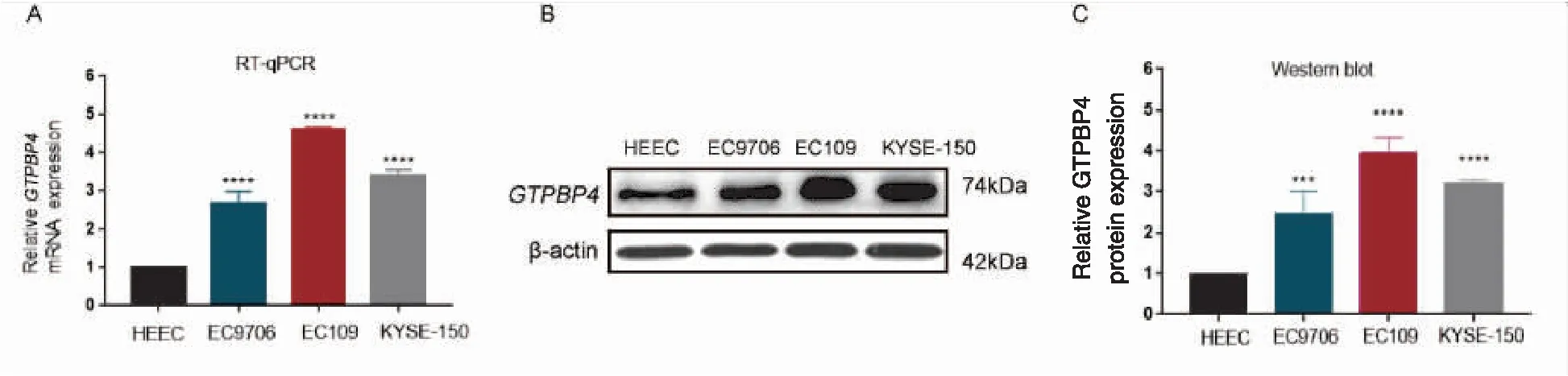
图2 人食管黏膜上皮细胞和食管鳞癌细胞系GTPBP4的表达(*** P<0.01,**** P<0.001)
2.3 GTPBP4基因沉默效果的测定
实时荧光定量PCR检测结果显示,与NC组(1.00±0.00)比较,LV-GTPBP4-siRNA组(0.62±0.06)EC109细胞中GTPBP4mRNA相对表达量明显下降,差异有统计学意义(P=0.030),NC组与LV-NC组之间的差异无统计学意义(P=0.930)(图3A)。
Western blot法检测结果显示,与空白对照组(101.30±4.00)比较,LV-GTPBP4-siRNA组(48.22±2.84)EC109细胞中GTPBP4蛋白的相对表达量明显下调,差异有统计学意义(P<0.001),NC组与LV-NC组之间的差异无统计学意义(P=0.550)(图3B、C)。
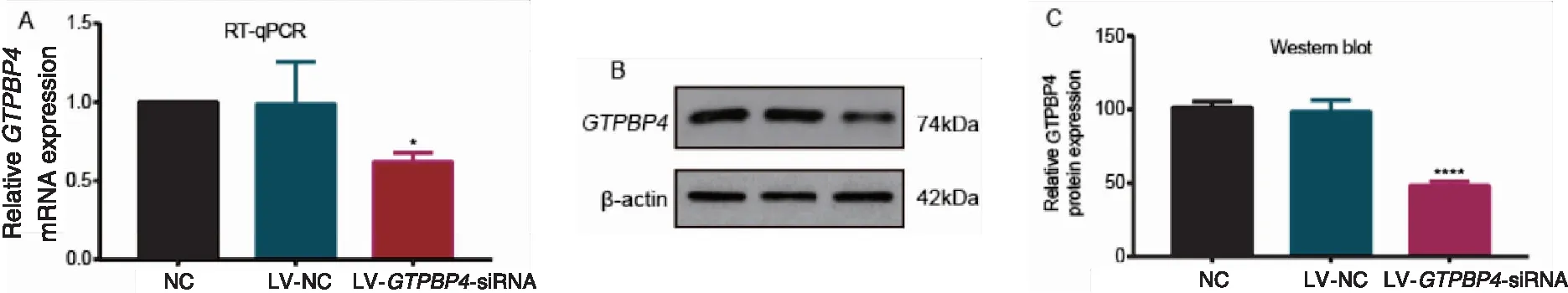
图3 实时荧光定量PCR和Western blot法分别检测沉默GTPBP4表达后EC109细胞中GTPBP4 mRNA和蛋白的表达水平变化(*P<0.05, **** P<0.001)
2.4 CCK8实验检测细胞增殖能力及流式细胞法检测细胞周期
CCK8法分别比较24、48和72 h时3组细胞生长抑制率,双因素方差分析,F组间=366.500,P<0.001,F时间=8 097.000,P<0.001,F组间×时间=98.410,P<0.001,差异有统计学意义。分别比较各时间点3组细胞生长抑制率,24 h时3组细胞的生长抑制率差异无统计学意义(P=0.094);与NC组比较,LV-GTPBP4-siRNA组EC109细胞在48 h、72 h生长抑制明显,差异有统计学意义(均P<0.001),而NC组与LV-NC组之间的差异无统计学意义(P=0.063,P=0.063)。组间比较:与NC组相比,LV-GTPBP4-siRNA组细胞生长受到明显抑制(P<0.001)(图4A)。以上结果提示,沉默GTPBP4基因表达可使食管癌EC109细胞的增殖能力降低。
流式细胞法检测结果显示:与NC组比较(55.31±0.43)%,LV-GTPBP4-siRNA组EC109细胞周期G0/G1期的细胞数增多(70.62±1.21)%,而S期细胞数减少,分别为(26.10±0.76)%,(19.27±1.17)%,差异均有统计学意义(均P<0.001)(图4B、C)。上述结果表明,沉默GTPBP4基因表达可诱导细胞出现G1期阻滞,从而抑制细胞的增殖。
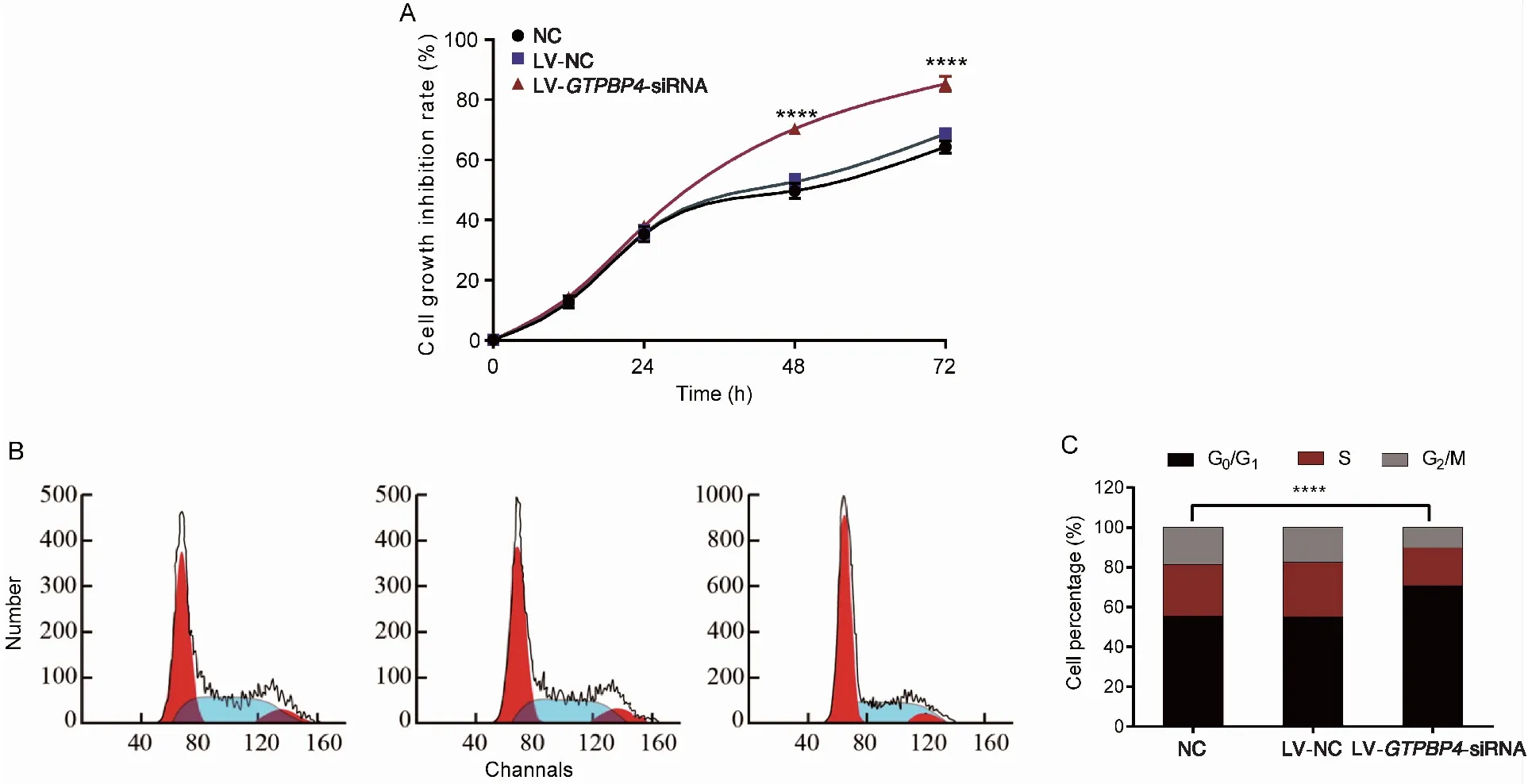
图4 CCK8法和流式细胞法检测沉默GTPBP4基因对EC109细胞生长抑制和细胞周期的影响(**** P<0.001)
2.5 CCK8检测EC109细胞对化疗药物的敏感性
慢病毒感染EC109细胞后加入不同浓度顺铂或5-氟尿嘧啶,结果表明,随着药物浓度增加,细胞的存活率逐渐下降。顺铂处理后NC组IC50为185.60 μmol/L,LV-GTPBP4-siRNA组IC50为150.10 μmol/L;5-氟尿嘧啶处理后NC组IC50为402.20 μmol/L,LV-GTPBP4-siRNA组IC50为203.10 μmol/L,两者差异均有统计学意义(均P<0.05)(图5)。结果表明,沉默GTPBP4基因表达后细胞对两种化疗药物更加敏感。
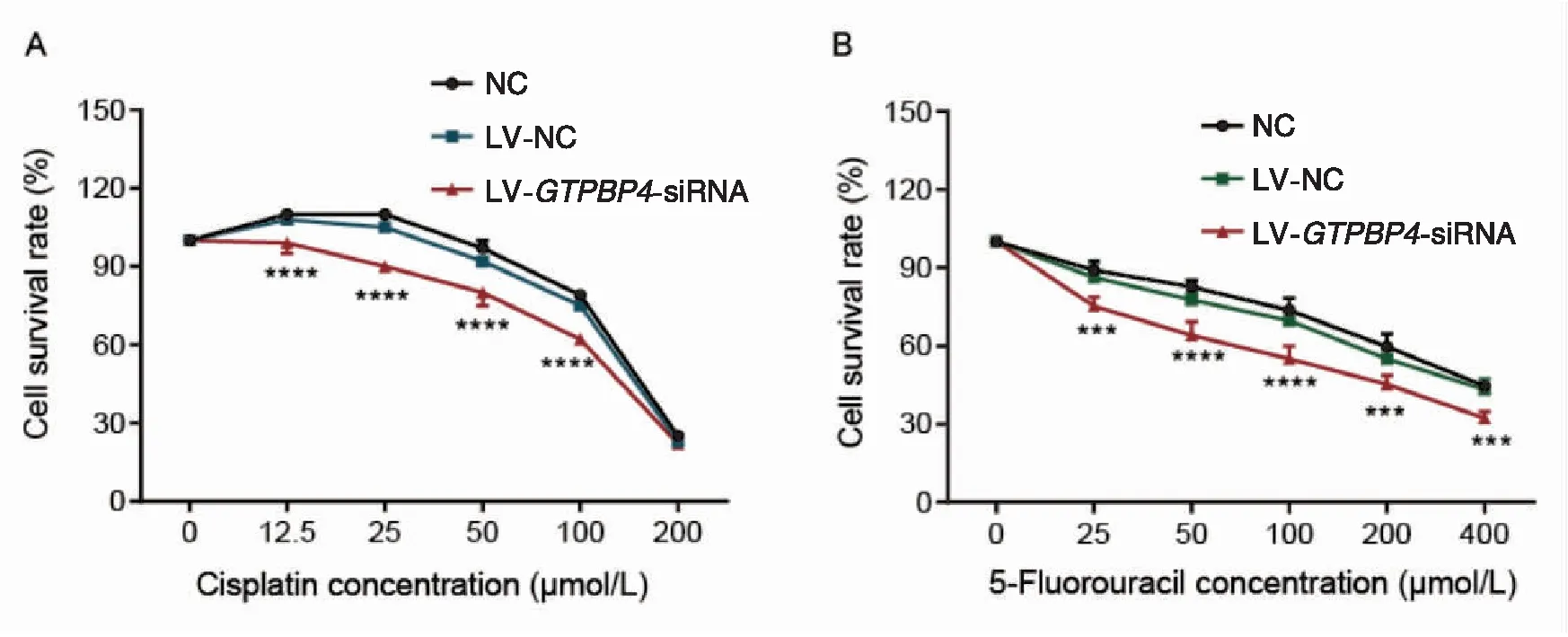
图5 CCK8法检测沉默GTPBP4基因后EC109细胞的化疗敏感性(**** P<0.001, *** P<0.01)
2.6 Transwell实验检测细胞侵袭能力
Transwell小室侵袭实验检测结果显示,慢病毒感染EC109细胞后,细胞的侵袭能力发生了改变,与NC组(976.00±17.58)相比,LV-GTPBP4-siRNA组的穿膜细胞数量(518.00±54.49)明显减少,差异有统计学意义(P<0.001)(图6A、B)。慢病毒感染EC109细胞联合化疗药物顺铂处理后,与NC组(701.00±84.66)相比,LV-GTPBP4-siRNA组的穿膜细胞数量(354.30±49.69)明显减少,差异有统计学意义(P=0.001)(图6C、D)。以上结果提示沉默GTPBP4基因表达,可明显增加顺铂抑制食管癌细胞侵袭的能力,提高药物敏感性。
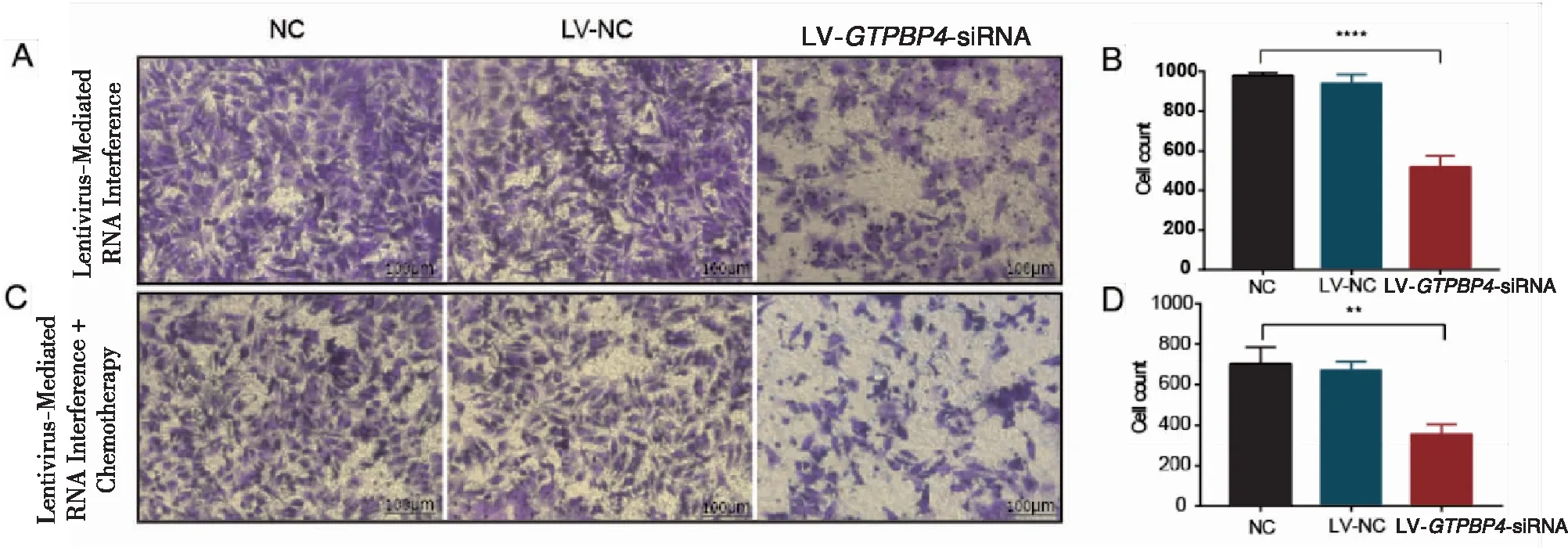
图6 Transwell侵袭实验检测沉默GTPBP4基因表达联合顺铂对EC109细胞体外侵袭能力变化(****P<0.001,** P=0.001)
3 讨 论
GTPBP4,也称为慢性肾功能衰竭蛋白(chronic renal failure geneprotein,CRFG),是由10号染色体长臂14-15区(10q15-14)编码、由633个氨基酸组成的重要功能蛋白,是一种定位于核仁的新型G蛋白,故也称作核仁GTP结合蛋白1(nucleolar GTP-binding protein 1,NOG1)[9-10]。当前,对于该基因的研究较少,许多机制功能需要进一步探究,目前研究显示该蛋白主要参与核糖体60S亚基的合成和成熟,还和肾病末期的发展有密切关系[11-12]。但是对于该基因和肿瘤的关系研究较少。有研究发现,在神经胶质瘤细胞株中,GTPBP4表达水平下调,转染GTPBP4过表达质粒后,可明显降低雪旺氏细胞生长、DNA合成及裸鼠成瘤的能力,进一步研究发现,GTPBP4抑制细胞增殖的能力是通过调节Merlin蛋白、CyclinD1蛋白实现的,从而扮演抑癌基因角色[8]。但也有研究和上述结果不一致,在乳腺癌中,GTPBP4呈高表达,且与预后差、生存期短呈正相关[13-14]。另有研究发现:在胃癌组织、多种胃癌细胞株中GTPBP4表达均升高,GTPBP4高表达与胃癌患者的临床分期、肿瘤侵袭、淋巴结转移和远处转移密切相关,下调GTPBP4表达后,胃癌细胞株MKN-45及AGS的增殖能力及克隆形成减低、凋亡增加[15],提示该蛋白可能在肿瘤中承担潜在癌基因角色。
基于以上研究发现,GTPBP4在恶性肿瘤中的表达水平不同(下调或上调),提示GTPBP4可能是一种癌基因或抑制基因,主要依赖于特定的肿瘤类型。而到目前为止,GTPBP4与食管癌关系及食管癌化疗药物敏感性方面的探讨尚未被研究。所以,综合以上研究,我们首先利用GEO数据库[16],发现食管癌组织中GTPBP4表达水平明显高于正常对照组。为了证实这一现象,我们利用人食管黏膜上皮细胞系HEEC及食管癌细胞系EC9706、EC109和KYSE-150细胞系,检测GTPBP4mRNA和蛋白表达水平,结果发现与正常食管黏膜上皮细胞HEEC相比,GTPBP4在食管鳞癌细胞系EC9706、EC109和KYSE-150中的表达明显升高,并且EC109细胞中GTPBP4表达水平升高更为明显,故以EC109细胞系作为下一步研究的对象。进一步,我们利用慢病毒载体LV-GTPBP4-siRNA感染EC109细胞,从而靶向沉默GTPBP4基因表达,采用RT-qPCR及Western blot实验检测基因沉默效果,结果发现沉默GTPBP4基因后,EC109细胞的中GTPBP4mRNA及蛋白表达水平均明显下降,证实重组慢病毒可以有效沉默GTPBP4基因的表达。CCK8法及流式细胞术检测结果显示,沉默GTPBP4基因表达可有效抑制EC109细胞的生长,诱导细胞出现G1期阻滞,S期细胞明显减少,从而抑制细胞的增殖,与文献报道结果一致[17]。
化疗是食管癌重要的辅助治疗手段,然而在化疗过程中,往往会出现化疗不敏感或者化疗缓解后复发[18-19]。因此,寻找化疗抵抗时的生物学标志物和化疗增敏剂、恢复耐药肿瘤细胞的化疗敏感性具有重要意义。目前临床常用于食管癌化疗的药物是顺铂或氟尿嘧啶,本研究通过慢病毒感染食管癌EC109细胞并经化疗药物顺铂作用后观察细胞生长和侵袭能力变化。CCK8法检测细胞增殖及Transwell侵袭实验结果显示,沉默GTPBP4基因联合顺铂或氟尿嘧啶使细胞的存活率及IC50显著降低,明显增加顺铂抑制食管癌细胞侵袭的能力,提示靶向沉默GTPBP4基因的siRNA和顺铂或氟尿嘧啶具有协同效应,能够大大改善食管癌细胞EC109对化疗药物的敏感性。
既往研究发现,核糖体生物合成受损会影响细胞功能,导致细胞应激反应,而这种应激反应是通过核糖体-Mdm2-p53(ribosomal protein-Mdm2-p53,RP-Mdm2-p53)途径,阻碍了Mdm2与p53结合,致使p53泛素化降解障碍,p53通路激活,细胞周期停滞、损伤修复、自噬等,在肿瘤发生过程中有重要作用[20-22]。另有研究发现,在具有野生型p53的乳腺癌个体中,GTPBP4蛋白表达增加与患者生存率降低相关,提示GTPBP4可能是促癌基因,且可能是通过抑制p53信号通路发挥抑制肿瘤细胞增殖的作用[17]。以上研究报道提示,GTPBP4可能是促癌基因,且可能是通过调节p53信号途径来调节细胞周期,从而促进肿瘤细胞增殖、抑制凋亡而导致肿瘤的发生发展。但对于本实验,该理论还需要我们进一步研究。
综上所述,本研究结果表明GTPBP4基因在人食管鳞癌组织中高表达,LV-GTPBP4-siRNA慢病毒载体可有效沉默食管癌EC109细胞中GTPBP4基因的表达,从而抑制细胞增殖,降低其侵袭能力,增强人食管鳞癌细胞对化疗药物的敏感性。虽然其作用机制还不是很明确, 但该结果为GTPBP4在食管癌发生发展中的作用研究奠定了基础,提供了假设,为探索GTPBP4在食管癌化疗增敏及靶向治疗方面提供了新思路。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
