消痔灵注射液介导TGF-β1/Smad信号治疗放射性直肠炎出血的分子机制研究
2021-04-02何裕智李俊
何裕智,李俊
放射治疗过程中,不可避免地会对周围组织造成损伤,导致急性或慢性放射性损伤,当直肠黏膜受损时便会引发放射性直肠炎(radiation proctitis,RP),是临床放射治疗主要并发症[1]。该病主要见于妇科恶性肿瘤或男性前列腺恶性肿瘤放射治疗,流行病学调查发现,该病五年发病率为12.3%,其中有1.1%的患者确诊为严重直肠炎[1]。便血、腹泻及肠梗阻是该病主要临床表现,病程较长,严重时可出现直肠阴道瘘或膀胱瘘,严重影响患者生存质量。研究发现[2],放射性损伤与放射性途径相关基因有关,其中转化生长因子β1(transforming growth factor beta 1,TGFβ1)基因是研究较多的与放射损伤相关的有关基因之一。TGF-β1/Smad信号通路在电离辐射导致的炎症反应中发挥重要作用[3]。因此,可设想通过阻断TGF-β1/Smad信号通路来达到治疗RP的目的。消痔灵注射液是一种中西药相结合的注射用液体,能使小动脉内血栓形成加快,具有收敛、抑菌、止血等作用[4]。本文将采用消痔灵注射液治疗放射性直肠损伤,探究该药通过TGF-β1/Smad信号通路发挥作用的分子机制。
1 材料与方法
1.1 材料来源
雄性SD大鼠40只,SPF级,6周龄,体质量200~220 g,购于成都达硕实验动物有限公司,许可证号:SCKX川2020-030。将大鼠放在室温15~25 ℃,湿度35%~60%,添加常规饮水及饲料,12 h光照,12 h黑暗,循环进行。
主要试剂及仪器:TGF-β1、Smad 2/3 抗体(Abcam,批号:ab64175、ab63399);逆转录试剂盒(RevertAid First Strand cDNA synthesis Kit)(Fermentas,批号:00130608);高纯总RNA快速提取试剂盒(Gener-ay,批号:1305G0);GAPDH Antibody(Bioworld,批号:321205);HE 染色试剂盒(北京索莱宝,批号:G1120);中性树胶(北京索莱宝,批号:G8590);北京天普UV-1600紫外分光光度计;显微镜(日本尼康,Eclipse 80i);转移脱色摇床(海门其林贝尔仪器制造公司,型号TS-8);垂直电泳槽(北京六一仪器厂,型号DYCZ-20C);直线加速器用瓦里安(Varian)6EX直线加速器(美国);台式冷冻高速离心机(德国 Eppendorf,Centrifuge 5430R);台式低速离心机(湖南赫西仪器装备有限公司,TDZ5-WS)。
1.2 分组及动物模型制作
将40只大鼠分为空白对照组、模型组、消痔灵组、TGF-β1组、TGF-β1联合消痔灵组,各8只。对照组不做任何处理,采用蛋白质含量20%的标准饲料喂养,其他四组均予以固定照射,制作RP模型(图1)。模型制作方法:大鼠肌肉完全松弛后,将大鼠安静地以仰卧体位固定在特制的固定木板上,采用6 MV X射线单次25 GY照射,照射范围自耻骨联合至肛门,照射野面积3 cm×4 cm,放射剂量为20 Gy,剂量率500 cGy/min,仔细观察大鼠接受照射时的情况。消痔灵组在照射后第12周采用消痔灵注射液(吉林省集安益盛药业股份有限公司,产品批号 Z22026175),每晚一次,2 mL/次,间隔一天灌肠1次共7次14 d。TGF-β1组在照射后第4周开始腹腔注射10 mg TGF-β1抑制剂SB-431542,共注射10 d。TGF-β1联合消痔灵组,照射后第4周开始腹腔注射10 mg SB-431542,共注射10 d;第12周开始给予药物灌肠,方法同消痔灵组灌肠方法。
模型鉴定:每天记录5组大鼠一般状况,包括大鼠的体质量、反应状态活动情况、饮水进食量、大便情况等项目。除空白组外,其他四组大鼠在照射后出现如精神疲惫、反应迟钝、活动减少、饮食饮水减少等情况;大鼠大便带血,经八联试纸检测,结果为潜血阳性[5]。
1.3 指标检测方法
干预结束后2周,所有大鼠采集腹主动脉血标本5 mL,用于炎性因子[白细胞介素2(Interleukin-2,IL-2)、白细胞介素6(Interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)]水平检测;处死,自距肛门2 cm以上获取直肠组织约2 cm,平均分成两部分,一部分放在10%的甲醛固定液中,用于HE染色;另一部分-80 ℃冻存,用于检测TGF-β1、Smad2、Smad3蛋白表达情况。
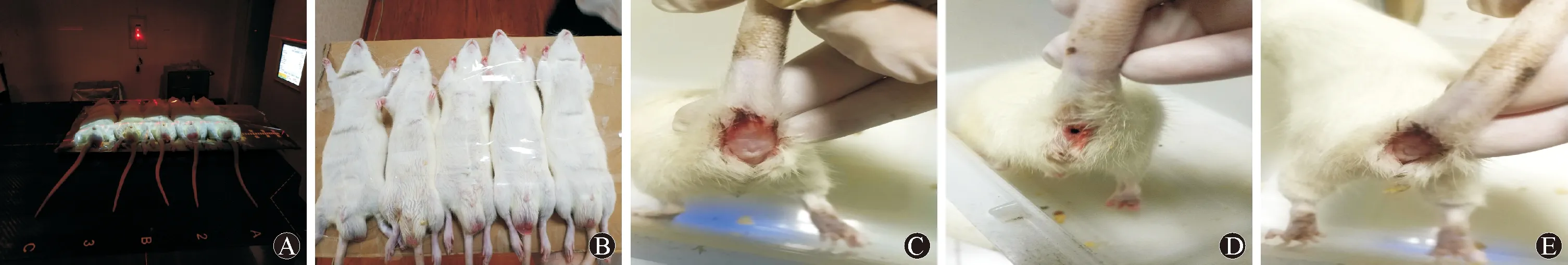
图1 大鼠造模过程及成模后图片 A图:造模中;B图:造模前固定;C图:中度出血;D图:轻度出血;E图:重度出血(伴肛门功能异常)
1.3.1 采用HE染色观察直肠组织病理改变
制备病理切片:取以上冻存组织,水洗后酒精梯度脱水,切去适当形状,采用石蜡包埋;使用轮转机连续切片,切片厚度为5 μm;切片置于42 ℃烤片机,烤片结束后进行HE染色。
HE染色:切片二甲苯脱腊,乙醇梯度冲洗,再用双蒸水冲洗2 min后开始染色;苏木素液染色15 min后自来水冲洗,分化液分化30 s、自来水浸泡5 min;伊红染液染色1min后,自来水冲洗,浸泡5min;将切片放入梯度乙醇中脱水,风干后中性树胶封片。
1.3.2 采用Western blotting检测直肠组织TGF-β1、Smad 2、Smad 3蛋白表达量
称取各组大鼠100 mg直肠组织,置于匀浆器,将其剪碎;加入1 mL RIPA裂解液,10 μL PMSF,研磨碾碎组织;将研磨后的组织置于冰上裂解1 h后,裂解液移至离心管,12 000 r/min离心条件离心15 min,分离上清液,-80 ℃保存;采用BCA蛋白定量测定法测定蛋白总浓度。采用Western blotting技术检测直肠组织中TGF-β1相关蛋白表达情况,首先SDS-PAGE 凝胶电泳,湿法转膜至PVDF膜,摇床低速室温封闭2 h;将PVDF膜浸没在一抗中孵育,4 ℃过夜,GAPDH稀释比为1∶5 000,TGF-β1、Smad2、Smad3稀释比为1∶700;回收一抗后加入TBST摇床3次,将PVDF膜浸没在二抗中,摇床低速孵育1 h;加入TBST高速洗膜3次;将 PVDF 膜放在化学发光凝胶成像系统的黑色托盘上,曝光影像,采用开 Image Lab5.1 软件分析蛋白表达,以GAPDH为内参。
1.3.3 采用酶联免疫吸附法检测血清IL-2、IL-6、TNF-α水平
将血液标本3 000 r/min离心处理10 min后,分离血清,于-80 ℃冰箱保存备用。采用酶联免疫吸附法(贝克曼库尔特,AU5800全自动生化分析仪)检测炎性因子IL-2、IL-6、TNF-α水平。
1.4 统计学方法
2 结果
2.1 直肠组织HE染色结果
肉眼观察:对照组大鼠直肠组织黏膜颜色粉红,未见明显的充血;模型组大鼠直肠组织黏膜颜色暗红,可见明显组织充血、肿胀及大小不等的溃疡点;TGF-β1组大鼠直肠组织外观较模型组明显改善;消痔灵组大鼠直肠组织黏膜颜色鲜红,接近对照组,轻度充血、水肿,溃疡斑点较少;TGF-β1联合消痔灵组大鼠直肠组织改善效果较消痔灵组有所改善。
显微镜观察:对照组大鼠直肠组织结构完整;模型组大鼠直肠黏膜上皮可见明显水肿及炎性改变,腺体结构不完整,组织损伤特征明显;消痔灵组大鼠直肠黏膜上皮未见明显水肿,腺体大部分细胞修复,腺体结构基本完整,仅黏膜下组织轻度充血;TGF-β1组大鼠直肠组织结构较模型组优,与TGF-β1联合消痔灵组比较有显著差异,联合消痔灵注射液治疗能进一步改善大鼠病理改变,见图2。

图2 各组直肠组织HE染色结果(HE×200) A:对照组;B:模型组;C:消痔灵组;D:TGF-β1组;E:TGF-β1联合消痔灵组
2.2 各组TGF-β1、Smad 2、Smad 3蛋白表达量比较
模型组直肠组织TGF-β1、Smad 2、Smad 3蛋白表达量显著高于对照组(P<0.05);消痔灵组、TGF-β1组、TGF-β1联合消痔灵组直肠组织TGF-β1、Smad 2、Smad 3蛋白表达量显著低于模型组(P<0.05);TGF-β1联合消痔灵组直肠组织TGF-β1、Smad 2、Smad 3蛋白表达量显著低于消痔灵组、TGF-β1组(P<0.05);消痔灵组直肠组织TGF-β1、Smad 2、Smad 3蛋白表达量与TGF-β1组比较无统计学意义(P>0.05),见表1、图3。
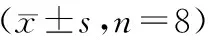
表1 各组TGF-β1、Smad2、Smad3蛋白表达量

图3 各组TGF-β1、Smad 2、Smad 3蛋白表达 A:对照组;B:模型组;C:消痔灵组;D:TGF-β1组;E:TGF-β1联合消痔灵组
2.3 各组炎症因子IL-2、IL-6、TNF-α水平比较
模型组血清IL-2、IL-6、TNF-α水平显著高于对照组(P<0.05);消痔灵组、TGF-β1组、TGF-β1联合消痔灵组血清IL-2、IL-6、TNF-α水平显著低于模型组(P<0.05);TGF-β1联合消痔灵组血清IL-2、IL-6、TNF-α水平显著低于消痔灵组、TGF-β1组(P<0.05);消痔灵组血清IL-2、IL-6、TNF-α水平与TGF-β1组比较无统计学意义(P>0.05),见表2。
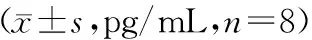
表2 各组炎症因子IL-2、IL-6、TNF-α水平
2.4 便血疗效分析
对照组大鼠及其它四组大鼠照射前大便次数正常,质地较硬,未见便血等情况。照射第2天内出现稀便、黏液脓血便,大便潜血检测均先后呈阳性。便血检测呈阴性(-)、可疑阳性(±)视为治疗有效,呈阳性(+)、中等阳性(++)及强阳性(+++)为治疗无效。消痔灵组、TGF-β1组、TGF-β1联合消痔灵组大鼠便血疗效分别为75.00%、50.00%、87.50%,见表3。
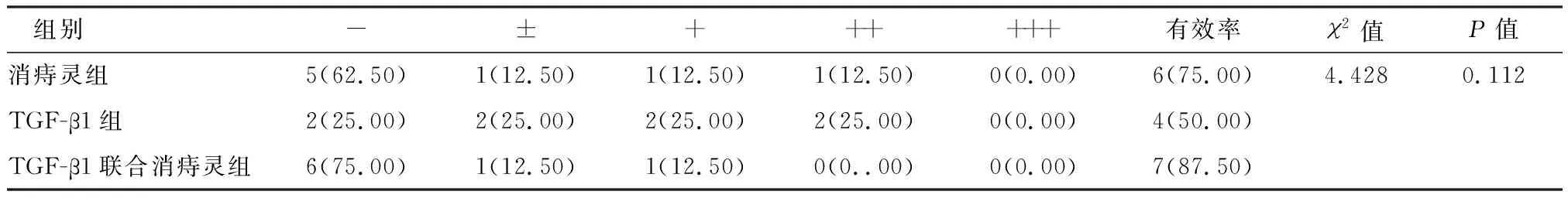
表3 便血疗效分析 [n(%)]
3 讨论
RP是腹腔、盆腔肿瘤放射治疗后出现的一种并发症,是肠道非特异性炎症。西医治疗RP以镇痛、止血、抗感染及减轻胃肠道痉挛等对症治疗为主,同时辅以饮食、肠道营养治疗及高压氧治疗[6]。中医通过分析该病腹泻、便血及腹痛三大主要症状,结合高能电离辐射病因,将其归为“泄泻”范畴[7],认为该病病位在肠,病因为高能电力辐射,病机为热毒蕴结致使脾胃肠道受损。故中医治疗多以清热燥湿止血、凉血滋阴养血为原则,在此基础上根据病情变化加减[8]。消痔灵注射液为中成药,主要成分为五味子提取物、明矾等,具有消炎、抑菌、收敛、止血功效。该药含有鞣酸、低分子右旋糖酐、枸橼酸钠、亚硫酸氢钠等化学成分,对静脉曲张性混合痔出血具有较好疗效,可使用药区局部组织出血性坏死,进而发挥止血作用[9]。
近年来,精准医学的提出使综合性分析RP病理机制成为重点,致力于研究该病治疗方法在分子水平的作用机制。TGF-β是一种促纤维化因子,能诱导成纤维细胞增殖分化。研究表明,TGF-β及其信号通路在动物肠道疾病发生发展中发挥重要调控作用,可通过调节干扰素-γ(interferon-γ,IFN-γ)、白细胞介素(Interleukin,IL)的信号传导,抑制肠道炎症的发生[10]。Smads蛋白家族是TGF-β家族信号传导的主要介质,是TGF-β受体直接作用底物,TGF-β/Smad信号通路表达异常及失常会导致机体免疫抑制性功能障碍[11-12]。TGF-β1作为TGF-β家族中的重要一员,在细胞增殖、凋亡、迁移及炎症反应中发挥重要作用。多项研究报道[13-14],放射治疗患者血清中TGF-β1水平与组织放射性损伤有关。Smads介导的TGF-β信号途径及其生物学效应,在放射性组织损伤中起至关重要的作用[15-17]。GTGF是一种多肽,TGF-β/Smad通路下游重要靶基因,研究证实[18-19],TGF-β可通过TGF-β/Smad通路促进下游GTGF的表达,进而促进炎症反应发生。
为探究消痔灵注射液介导TGF-β1/Smad通路治疗RP的分子机制,本研究制作了RP大鼠模型,模型大鼠在照射后出现精神疲惫、反应迟钝、活动减少及便血等症状;另外直肠组织黏膜颜色暗红,明显组织充血、肿胀,且直肠组织TGF-β1表达量较正常对照组显著上升,说明大鼠RP模型制作成功。消痔灵组TGF-β1、Smad2/3蛋白表达较模型组显著下降,提示消痔灵注射液有抑制TGF-β1、Smad2/3的表达作用。采用TGF-β1抑制剂干预RP模型大鼠,发现其TGF-β1、Smad2/3蛋白表达较模型组显著下调,在此基础上采用消痔灵注射液治疗,发现直肠组织中TGF-β1、Smad2/3蛋白表达量与抑制剂组比较无显著差异,进一步提示消痔灵注射液主要通过介导TGF-β1/Smad信号通路发挥抗RP出血作用。TGF-β还能聚集炎症细胞,促进释放大量炎性细胞因子,如TNF-α、IL-4、IL-6、IL-13等[20]。本研究发现,模型组大鼠血清中IL-2、IL-6、TNF-α水平较正常对照组显著上升,TGF-β1组炎性因子水平较模型组有所下降,消痔灵组和TGF-β1联合消痔灵组大鼠血清炎性因子水平均明显下降,但组间比较有显著差异,后者下降水平更加明显,说明消痔灵注射液可通过TGF-β1/Smad信号通路在RP出血中发挥抗炎作用;TGF-β1联合消痔灵组炎性因子下降水平较TGF-β1组明显,提示消痔灵注射液还可能通过其他信号途径发挥抗炎作用。照射前各组大便质地较硬,未见便血,照射后出现黏液脓血便,大便潜血检测均先后呈阳性,消痔灵注射液及TGF-β1抑制剂干预后,各组大鼠便血情况得到改善,消痔灵组和TGF-β1联合消痔灵组疗效较高,有效率分别为80%、90%,提示消痔灵注射液可能通过其他通路或者机制治疗RP,但具体机制有待进一步研究。
综上所述,消痔灵注射液能够下调RP组大鼠直肠组织中TGF-β1、Smad2/3表达,该药治疗治疗RP出血主要通过介导TGF-β1/Smad信号通路发挥作用,但其具体药理作用机制仍需进一步探究。
