丹参及其制剂促缺血心肌血管新生的机制研究进展△
2021-04-01彭瑞爽荣华马晓慧汤依群
彭瑞爽,荣华,马晓慧*,汤依群
1.中国药科大学,江苏 南京 211198;2.天士力医药集团股份有限公司 创新中药关键技术国家重点实验室,天津 300410
血管新生在机体的生理和病理过程中都发挥着重要的作用,其机制复杂,受许多因素调节[1]。当血管生长失调时,将对健康产生重大影响[2]。缺血性心脏病是由于冠脉循环改变引起的冠脉血流供应与心肌需求之间不能平衡所导致的心肌损害[3]。心肌缺血将导致心肌梗死、心功能不全,甚至心衰,严重危害人类健康[4]。因此,增加缺血组织周围毛细血管密度,建立缺血区域的侧支循环,恢复冠脉血流供应与心肌需求间平衡成为关键[5]。
活血化瘀类中药对缺血性心脏疾病的治疗效果显著[6]。丹参是唇形科植物丹参SalviamiltiorrhizaBge.的干燥根和根茎,作为我国的一种传统中药,首载于《神农本草经》,具有活血祛瘀、凉血清心、养血安神等功效[7];临床上被广泛用于治疗冠脉粥样硬化、心肌梗死、心室重构和其他心血管疾病[8]。丹参可以通过扩张冠状动脉并增加冠脉血流量、改善侧支循环、促进毛细血管网开放、改善心肌能量代谢[9]等机制改善心肌缺血[10]。有研究发现,丹参活性成分及其制剂可以通过促进血管新生、改善缺血组织血流供应达到治疗心肌缺血的疗效[11-12]。本文总结了丹参中主要活性成分及丹参复方或制剂调节血管新生作用的机制,探讨丹参制剂药物治疗心血管疾病的潜在机制,为研究活血化瘀类中药作用机制研究提供思路。
1 丹参活性成分及其相关制剂
丹参活性成分包括水溶性酚酸类化合物和脂溶性二萜醌类化合物两大类。其中水溶性成分包括丹参素(tanshinol,DSS)、丹酚酸A(salvianolic acid A,SalA)、丹酚酸B(salvianolic acid B,SalB)、原儿茶酸(protocatechuic acid,PCA)、咖啡酸(caffeic acid,CA)等;脂溶性成分主要有丹参酮Ⅰ(tanshinone Ⅰ,Tan Ⅰ)、丹参酮ⅡA(tanshinoneⅡA,TanⅡA)、隐丹参酮(cryptotanshinone,CTS)等。含有丹参的心血管制剂有注射液、滴丸、胶囊、颗粒及片剂等。以丹参为主药的丹酚酸注射液、丹参注射液、丹红注射液等注射剂广泛用于心血管疾病的临床急救治疗[13]。复方丹参滴丸、芪参益气滴丸作为临床上治疗冠心病、心绞痛的常用药,具有扩冠脉、增加血流量、降低心肌耗氧量、加强心肌收缩、改善外周循环等作用[14]。根据病机、病因与患者的病情差异,还有许多含有丹参的不同配伍配比的中药组方,如益气活血组方、双参通冠方、和血生络方等,对于活血化瘀、改善心肌缺血具有良好的效果[15-17]。
2 促进血管新生的药效研究
新生血管主要由血管内皮细胞(vascular endothelial cells,ECs)组成,常用ECs标志物有CD34、CD31、血管性血友病因子(von Willebrand Factor,vWF)和α-平滑肌肌动蛋白(alpha-smooth muscle aorta,α-SMA)等。通过免疫组化或免疫荧光来标记ECs,进行微血管计数(microvessel count,MVC)与微血管密度(microvessel density,MVD)的计算,可判断血管新生情况[18]。目前已有不少研究通过小型猪、大鼠、鸡胚绒毛尿囊膜和斑马鱼等模型证实了丹参具有促进血管新生的效果。
Han等[19]运用小型猪心肌缺血再灌注(ischemia/reperfusion,I/R)模型,验证了丹参多酚酸盐具有增加MVD、减小梗死面积的作用。丹酚酸B[20]、丹参注射液[21]、丹参多酚酸盐[22]、益气活血组方[23]和丹参素[24]等均被报道可以增加急性心肌缺血大鼠MVC与MVD,改善心肌组织血流供应。丹酚酸A[25]与丹酚酸B[26]都可以明显促进鸡胚绒毛尿囊膜(CAM)模型血管生成。含有丹参素、丹参酮ⅡA等丹参活性成分的双丹颗粒对斑马鱼节间血管具有促进作用[27]。崔国祯等[28]发现,丹参素衍生物具有增加正常斑马鱼肠下静脉血管(subintestinal veins,SIV)血管直径及修复血管内皮细胞生长因子受体酪氨酸激酶抑制剂(vascular endothelial growth factor receptor kinase inhibitor,VRKI)造成的节间血管损伤的效果。
3 促进血管新生的机制
丹参活性成分或其制剂可以从多个环节对血管新生产生影响:1)细胞水平,提高内皮细胞与内皮祖细胞的增殖、迁移、分化及血管生成能力;2)分子水平,通过增强缺氧诱导因子的转录活性从而调节一系列下游血管新生相关因子的表达。
3.1 上调VEGF/VEGFR通路,提高内皮细胞的增殖、迁移与成管能力
ECs在各种内源性或外源性刺激信号引起的机体血管新生过程中都发挥着关键作用。血管内皮生长因子(vascular endothelial growth factor,VEGF)是最强大有效的血管生成因子,同时也是生理及病理情况下所有血管形成的主要驱动力[29]。VEGF特异性结合其受体血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2),VEGF/VEGFR2通路能够介导ECs增殖和迁移,促进蛋白酶的分泌,抑制细胞凋亡[30-31]。
丹参多酚酸盐可以增加血管内皮生长因子mRNA(VEGF mRNA)及蛋白在梗死心肌边缘的表达,从而促进血管新生[22]。许波华等[32]研究结果显示,丹酚酸B可以通过上调人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)对VEGF的表达与分泌,提高HUVECs的增殖、迁移和管腔形成能力。丹参酮ⅡA经过水溶性结构修饰的丹参酮ⅡA磺酸钠,在VRKI诱导血管损伤斑马鱼模型中通过上调VEGF及受体表达来促血管新生和保护血管[33]。丹参酮ⅡA磺酸钠同样可以通过上调VEGFA及其受体增强HUVEC细胞生物学功能,并在海绵植入小鼠模型观察到血管新生[34]。周丹等[20]则发现,丹酚酸B诱导VEGF表达上调与激活核转录因子E2相关因子2/血红素加氧酶-1(Nrf2/HO-1)信号通路有关。同时,丹酚酸A可上调VEGF/VEGFR2及基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)水平[35],而MMP-9通过降解细胞外基质,提高ECs和血管内皮祖细胞(EPCs)的侵袭能力,在血管生成的调节中发挥重要作用[35]。
3.2 激活SDF-1/CXCR4通路,提高内皮祖细胞的趋化与归巢能力
由于成熟的ECs处于终末分化状态,增殖潜力有限,因此其产生新血管的能力是有限的[36],在组织严重缺血时需要EPCs的参与,EPCs是一种具备分化潜能的前体细胞,具有干细胞的特性。1997年,Asahara等[37]首次根据表面分子CD34与Flk-1(VEGFR2)从人体外周血分离出EPCs,并发现其可在体外分化成ECs。成人外周血含有骨髓来源的EPCs,在由缺血组织分泌的一系列趋化因子的趋化作用下,EPCs可归巢至新血管形成的部位,通过分泌血管生成因子,形成毛细血管结构,在心肌缺血与肿瘤发展过程中发挥促进血管新生作用[36]。缺血组织的基质细胞衍生因子-1α(stromal derived factor-1,SDF-1α)表达上调是介导干细胞和祖细胞归巢到缺血组织参与新生血管形成的首要因素之一。SDF-1α主要受体为CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4),表达CXCR4的EPCs可沿着缺血组织的SDF-1α浓度差定向迁移归巢,进而发挥EPCs促进血管新生的作用[38]。
有文献报道,复方丹参滴丸、芪参益气滴丸具有动员EPCs进入外周血的作用,提高EPCs克隆形成、增殖、黏附及迁移能力[15,39]。基于此,多人研究发现,丹参素、丹酚酸B、丹红注射液和益气活血组方等可提高EPCs在缺血心肌组织中表达与分泌VEGF、SDF-1α、CXCR4,从而提高EPCs的增殖活力并抑制细胞凋亡,促进细胞迁移与管腔形成[15,24,40-42]。赵先锋等[43]运用C57BL/6小鼠颈总动脉损伤模型,探索丹酚酸B对EPCs功能的改善作用,丹酚酸B可以在体内增加EPCs骨髓动员的效率,帮助EPCs黏附于胶原表面,同时还可以上调SDF-1和白细胞介素-8(interleukin-8,IL-8)的水平。
3.3 增强缺氧诱导因子的转录活性,调节血管新生相关因子的表达
缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)作为一种用于感应和适应细胞氧含量的转录因子,可转录激活调节氧稳态和代谢活化的基因[44]。组织中氧的减少导致HIF-1蛋白的核积累,通过与靶基因中的增强子元件结合而增强其转录活性,其调控的基因包括VEGF、SDF-1α、促血管生成素(angiopoietin,Ang)及其受体Tie-2、血小板衍生生长因子-β(platelet-derived growth factor-β,PDGFR-β)、成纤维细胞生长因子(fibroblast growth factor,FGF)、类胰岛素生长因子-1(insulin-like growth factor-1,IGF-1)和一氧化氮合酶(nitric oxide synthase,NOS)等[38,45-47]。
Ai等[48]发现,丹参注射液通过激活HIF-1α/VEGFA通路促进血管新生,改善冠状动脉左前降支(left anterior descending,LAD)结扎小鼠心功能。王永刚等[45]发现,双参通冠方可增加急性心肌缺血(AMI)大鼠心肌细胞中HIF-1α表达,激活HIF-1α/VEGF通路,促进血管新生和侧支循环形成,增加缺血区心肌组织血供,减少心肌梗死面积。曹昌霞等[49]发现,丹参可以增加 HIF-1α、VEGF、促红细胞生成素(EPO)表达,促进中小血管新生,从而保护心肌细胞膜和细胞器的结构和功能。张腾等[50]探讨芪参益气滴丸对心肌缺血大鼠的血管新生作用机制时,关注了心肌缺血后3~28 d内,具有不同效应的促血管新生相关因子与血管成熟相关因子表达的动态变化。结果发现,给药3 d能促进血管新生相关因子VEGF、Ang-1表达,7~14 d可使血管新生及成熟相关因子VEGF、Ang-1、碱性成纤维细胞生长因子(bFGF)、血小板衍生生长因子-β(PDGFR-β)表达均增加,28 d可促进新生血管成熟相关因子bFGF表达。该实验证明,芪参益气滴丸抗心肌梗死、促进心肌血管新生及成熟的作用机制与其缺血后不同阶段对相关因子不同趋势的调节相关。侯仙明等[17]发现,和血生络方则可以通过提高血清中NO和VEGF含量促血管新生。张瓅方等[51]发现,以丹参多酚酸为主的丹参水提液,可上调EPCs中VEGF、VEGFR2、Ang-1和内皮型一氧化氮合酶(eNOS) mRNA与蛋白的表达。Lin等[52]发现,丹酚酸B可以上调VEGF表达,抑制心肌细胞凋亡,促进自噬与血管新生发挥对急性心肌缺血的保护作用。丹酚酸B可以上调HUVECs与EPCs中VEGF和bFGF的水平[42,53],并且该作用可以提高骨髓间充质干细胞移植后在缺血心肌处形成新生血管[54]。丹参活性成分或其制剂促进血管新生的实验模型与作用机制见表1。
4 结语与展望
中药制剂成分众多,具有多组分、多靶点、多环节的作用特点,对冶疗发病机制复杂的疾病具有优势。丹参活性成分及其制剂调控血管新生的作用机制同样是多靶点、多环节的,见图1。丹酚酸、丹参素、丹参注射液、丹红注射液和益气活血组方等作用于动物或CAM模型时都可以在组织水平上观察到MVC与MVD的增加;丹参素、丹酚酸和复方丹参滴丸等还在细胞水平上展现了提高内皮细胞与内皮祖细胞的增殖、迁移、分化及成管能力的效果;而双参通冠方和丹参注射液等可以从分子水平通过提高HIF-1的活性,从而促进下游一系列血管新生相关因子表达。
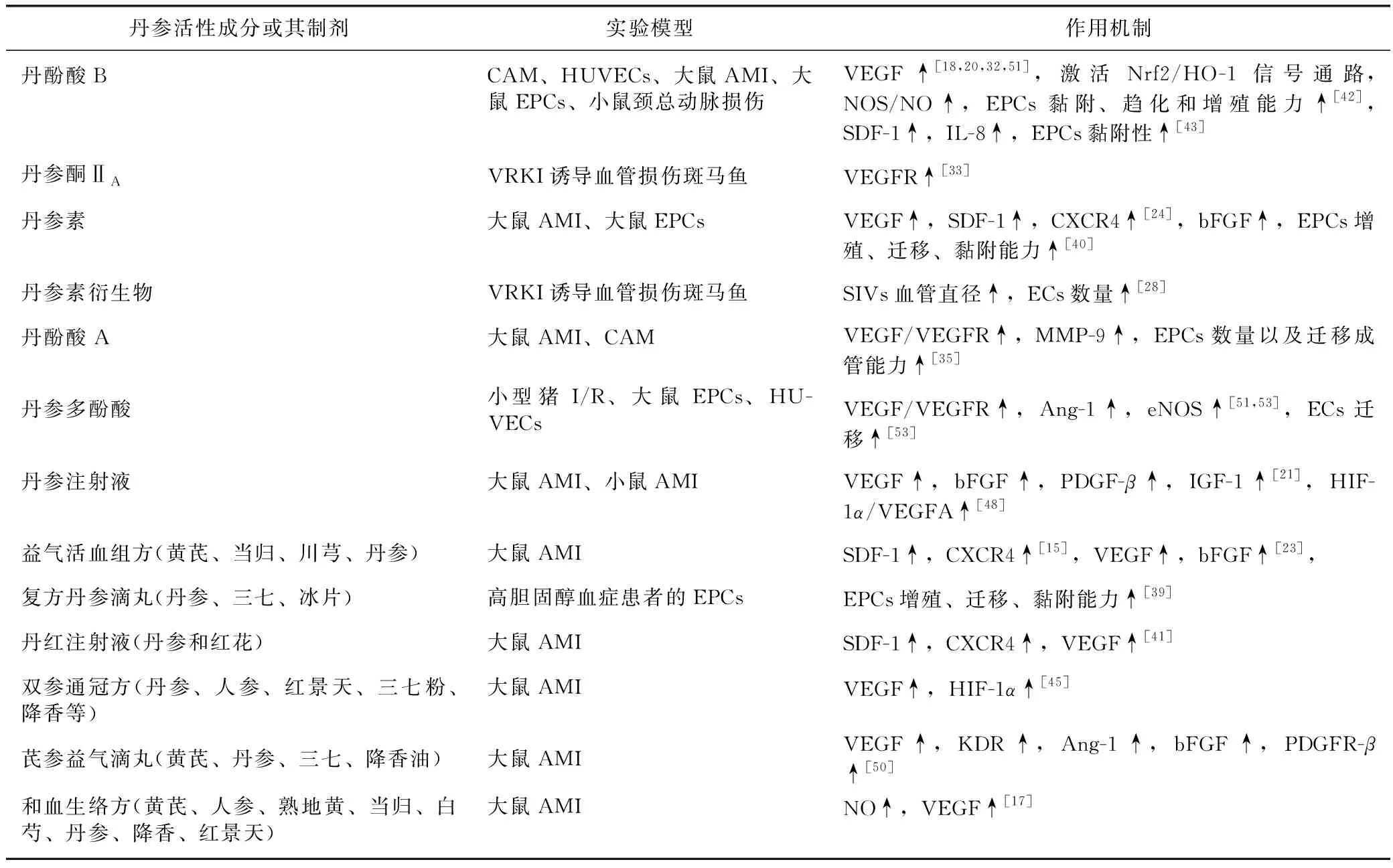
表1 丹参活性成分或其制剂促进血管新生的实验模型与作用机制

图1 丹参活性成分与制剂促进血管新生治疗心肌缺血的机制
现代医学对于缺血性心脏病的治疗重点在于建立有效循环,方法有溶栓治疗、经皮冠状动脉介入治疗等,但是存在溶栓后出血、手术后再狭窄等风险。因此,治疗性血管新生体现了相对安全与可控的优势,受到广泛关注[17]。中医药具有悠久的历史,在中医理论中心肌缺血的临床表现被描述为“心痛”“胸痹”等,病因病机归结于“气滞血瘀”,因此需要“祛瘀生新”“活血生肌”。“活血化瘀”药物治疗心肌缺血的机制包括促进血管新生、改善微循环、抑制血小板活化,从而抑制血栓形成、改善内皮细胞功能等[17],其中血管新生与“益气生脉”“和血生络”建立了中医理论与现代医学的联系。近年来,活血化瘀药物丹参在缺血性心脑血管疾病领域应用日趋广泛[6],并且丹参活性成分及其制剂在调节血管新生上进展显著,但是目前的研究尚存在一定的困难与不足。主要体现在:1)丹参等中药成分复杂、作用靶点丰富,在不同的病理状态下发挥作用的成分可能不同,不同的药物剂量也可能通过不同的机制发挥药效,尚需要在不同的实验条件下进行全面、系统的机制研究;2)目前对于血管新生的研究多集中于基础研究,与临床分析缺少关联,尚需大量临床试验为丹参促进血管新生,发挥改善心肌缺血的作用提供科学依据。
随着中药国际化进程的加快,还需要更加深入研究丹参类活血化瘀中药及其复方制剂促进血管新生的机制,建立传统中医理论与现代医学之间的联系,为传统中药走向世界奠定基础。
