稻瘟病菌MGG-01005的表达纯化与生物信息学分析
2021-04-01赵秀平闫星伊陈永胜李国瑞
赵秀平,王 双,闫星伊,段 强,张 帅,陈永胜,李国瑞
(内蒙古民族大学 生命科学与食品学院,内蒙古自治区高校蓖麻产业工程技术研究中心,内蒙古自治区蓖麻育种重点实验室,内蒙古自治区蓖麻产业协同创新中心,蓖麻产业技术创新内蒙古自治区工程研究中心,内蒙古 通辽 028043)
水稻是重要的粮食作物,在我国有超过60%的地区以稻米为主食[1-2]。稻瘟病是水稻破坏性最强的病害之一,可造成水稻在世界范围内年减产至少10%,大规模发病时可引发绝产[3-5]。稻瘟病菌(Magnaportheoryzae)是一种丝状子囊菌,可引发水稻患稻瘟病,严重影响水稻的产量和品质[6-7]。该病菌也可附着在谷子、小麦等多种重要经济作物植株表面侵染致病[8-10],其具有丝状病菌的典型特征,已成为丝状病原菌相关研究的模式生物[11]。因此,与稻瘟病菌生长发育相关的研究均具有重要意义。
MGG-01005是与稻瘟病菌的菌丝生长相关的基因,其所编码的蛋白属于Tctex-1家族成员。有研究表明,缺失该基因会导致稻瘟病菌的菌丝生长缓慢,并且它不依赖动力蛋白调节菌丝生长,该基因的59~65区段可能与菌丝生长相关[12-13]。动力蛋白由重链、中链和轻链等组分组成,Tctex-1是在细胞质和鞭毛动力蛋白中发现的轻链,是动力蛋白轻链中的一种[13-14]。Tctex-1不存在于植物体中,最初因其突变体可导致雄性不育,被确定为参与动力蛋白复合体的组装[15]。Tctex-1是由2个α-螺旋和4个β-链构成的同源二聚体[16],参与许多基本的细胞活动过程:可与包括动力蛋白中间链、视紫红质、Fyn和Trk激酶等在内的众多细胞质蛋白相互作用[13];在病毒发病机制中扮演重要角色[17];参与纤毛形成与伸长的调控等[18]。
本研究利用生物信息学技术预测了MGG-01005的一般理化性质、结构域、功能位点等基本特性,成功构建了原核表达载体pETM13-MGG-01005,利用IPTG诱导该重组蛋白表达,并通过镍离子亲和层析、阴离子交换层析以及分子筛层析进行蛋白纯化,以期为该蛋白的功能以及稻瘟病菌的后续相关研究提供一定的理论与实践依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
本实验使用的MGG-01005的氨基酸序列来自Uniprot数据库,种间聚类分析的多物种氨基酸序列来自NCBI数据库。大肠埃希菌表达载体pETM13,由本实验室提供;大肠埃希菌克隆菌株DH5α及表达菌株E.coliBL21(DE3)的感受态细胞,购自北京庄盟国际生物科技有限公司。
1.1.2 主要试剂
IPTG、AMP、Tris-HCl、NaCl、SDS、咪唑,Amersco公司;蛋白质Marker,TaKaRa公司;Ni sepharose 4FF、Resource Q、SuperdexTM75 increase 10/300 GL,GE生命科学部。
1.2 仪器与设备
琼脂糖凝胶成像系统、SDS-PAGE电泳仪,伯乐生物技术有限公司;蛋白质纯化系统(KTA purifierTM UPC-10)、蛋白质纯化系统(KTA purifierTM 10),GE Healthcare。
1.3 试验方法
1.3.1 生物信息学分析
利用在线软件ExPASy-ProtParam(https://web.expasy.org/protparam)和Prot Scale(http://web.expasy.org/protscale/)分析MGG-01005的一般理化性质及亲疏水性[19-21];使用NCBI Blastp 在线分析MGG-01005的保守结构域和序列同源性[22];在线软件ExPASy Prosite(http://prosite.expasy.org/)预测MGG-01005结构功能位点[23-24];在线软件TMHMM(http://www.cbs.dtu.dk/services/)和Signal P(http://www.cbs.dtu.dk/services/Signal p)预测MGG-01005跨膜结构域和信号肽位点[25-26];在线软件NetPhos 3.1(http://www.cbs.dtu.dk/services/)预测MGG-01005的潜在磷酸化位点[27];在线软件SOPMA(http://npsa-prabi.ibcp.fr/)和Phyre 2(http://www.sbg.bio.ic.ac.uk/phyre2) 预测MGG-01005的二级和三级结构[28-30];MEGA7.0.软件采用邻接法(N-J法)建立系统发育树进行聚类分析,修改部分参数:在Test of Phylogeny选择Bootstrapmethod;No.of Bootstrap replications输入2000;Mode/Method选择Poisson model;Rates among sites选择Uniform rates;Gaps/Missing Data Treatment选择Compele deletion[31]。
1.3.2 pETM13-MGG-01005蛋白的构建
根据MGG-01005基因序列设计引物,克隆MGG-01005基因;用Sticky-End法将MGG-01005基因与表达载体pETM13连接形成重组表达载体pETM13-MGG-01005,通过热激法将重组表达载体转化至大肠埃希菌克隆菌株DH5α,对重组子进行PCR扩增检测并将阳性质粒测序[7]。
1.3.3 pETM13-MGG-01005蛋白表达与纯化
将重组蛋白pETM13-MGG-01005热激转化至E.coliBL21(DE3)中。在含100 μg·mL-1氨苄青霉素的LB液体培养基中37 ℃、220 r·min-1振摇8 h,培养至D600为0.5~0.6。以0.1 mmol·L-1IPTG为诱导剂,18 ℃、180 r·min-1诱导16 h后收集菌体[32-33]。菌体重悬液中加入裂解缓冲液(20 mmol·L-1Tris-HCl,pH 8.0,500 mmol·L-1NaCl)经超声裂解后得到蛋白粗提液,15 000 r·min-1离心后,上清过Ni-亲和柱,用20 mmol·L-1Tris-HCl,500 mmol·L-1NaCl,浓度梯度为20~300 mmol·L-1(20、40、60、80、100、200、300 mmol·L-1)的咪唑缓冲液洗脱结合蛋白,将含有大量蛋白的咪唑洗脱液使用截留相对分子质量为3 ku的浓缩管进行适当浓缩[34-35]。根据该蛋白的理论等电点,选用ResourceTMQ离子交换层析柱进一步纯化(A泵缓冲液为20 mmol·L-1Tris-HCl,pH 8.0;B泵缓冲液为20 mmol·L-1Tris-HCl,pH 8.0,1.0 mol·L-1NaCl)[36]。纯化前需进行脱盐处理,缓冲液为20 mmol·L-1Tris-HCl,pH 8.0。纯化后再次浓缩洗脱液。最后进行分子筛层析纯化,选用SuperdexTM75 10/300GL层析柱,缓冲液为20 mmol·L-1Tris-HCl,pH 8.0,150 mmol·L-1NaCl[37]。收集高含量洗脱液浓缩至8 mg·mL-1,-20 ℃保存备用。以上操作结果均使用SDS-PAGE进行检测。
2 结果与分析
2.1 生物信息学结果分析
2.1.1 一般理化性质分析
通过在线软件ExPASy-ProtParam 分析MGG-01005的一般理化性质。数据结果表明:该蛋白相对分子质量为16 471.49 u,编码153个氨基酸,包含20种不同氨基酸;不稳定指数为40.58,平均亲和性为-0.443,表明该蛋白为不稳定亲水性蛋白,与在线软件Prot Scale分析结果一致(图1),其等电点为6.27,正电荷残基数(Arg+Lys)14个,负电荷残基数(Asp+Glu)16个,总原子数2 285个,脂肪指数67.06。
2.1.2 保守结构域及功能位点分析
通过NCBI blastp分析MGG-01005的保守结构域,结果表明:此蛋白含有Tctex-1保守结构域,属于Tctex-1家族(图2)。ExPASy Prosite预测结构功能位点的结果为无活性位点。
2.1.3 跨膜结构域及磷酸化位点分析
使用在线软件TMHMM和Signal P对MGG-01005进行跨膜结构域和信号肽预测,结果表明:该蛋白无跨膜结构和明显信号肽(图3)。利用在线软件NetPhos 3.1预测MoMGG-01005的潜在磷酸化位点,表明:MGG-01005具有23个磷酸化位点,分别为14个丝氨酸(Serine)、8个苏氨酸(Threonine)和1个酪氨酸(Tyrosine)(图4)。

图1 蛋白亲疏水性分析Fig.1 Analysis of Protein Hydrophilicity and Hydrophobicity
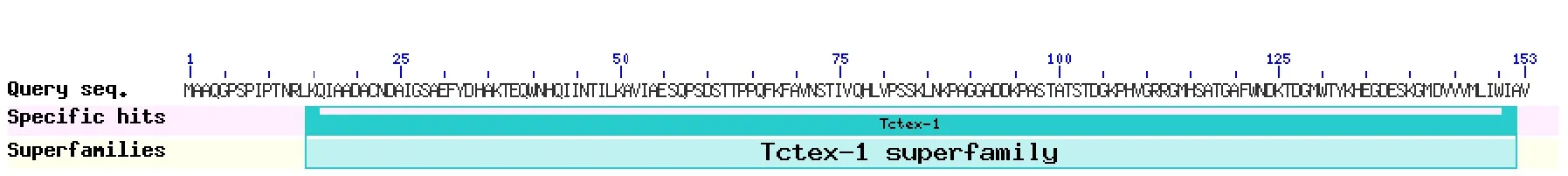
图2 蛋白质保守结构域预测Fig.2 Protein conserved domain mapping
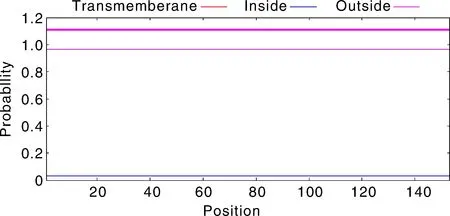
图3 蛋白质的跨膜结构Fig.3 Protein transmembrane structure diagram
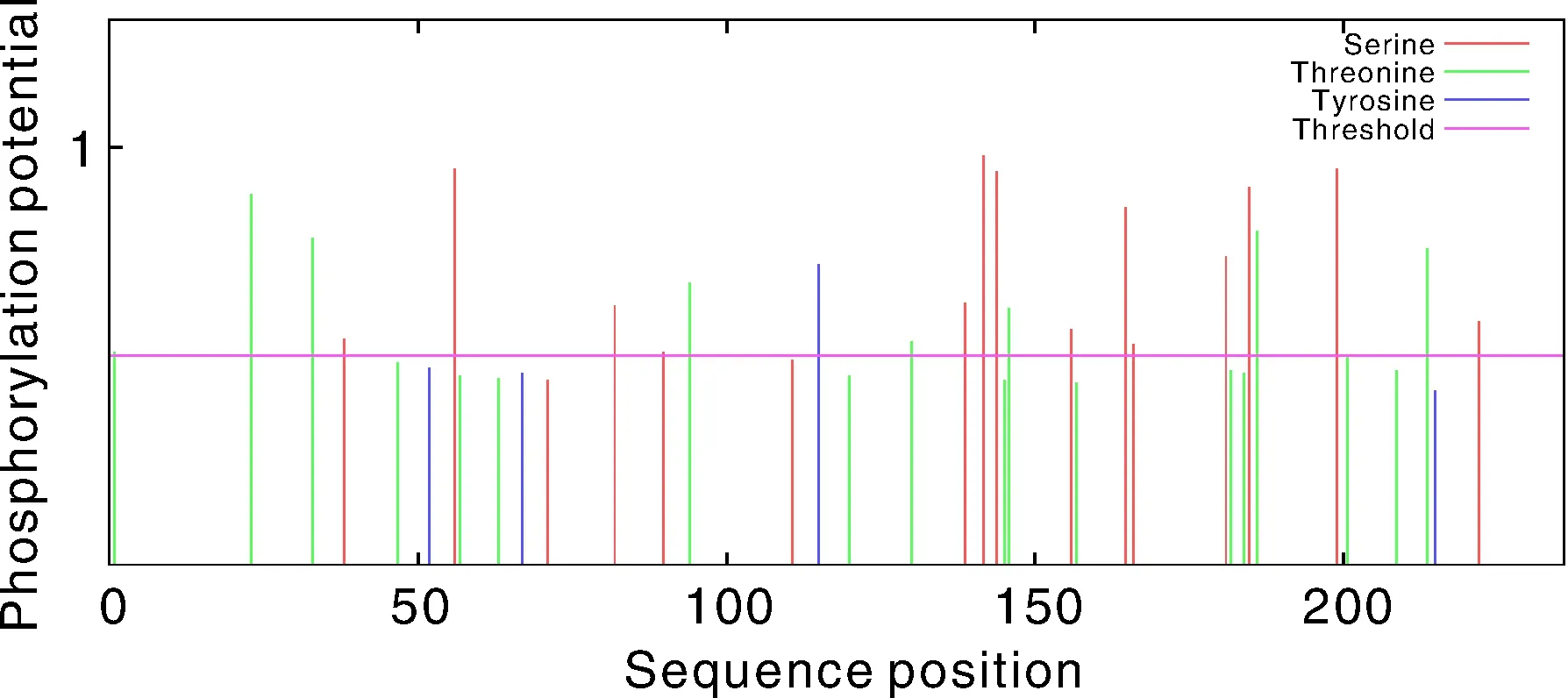
图4 蛋白磷酸化位点预测Fig.4 Prediction of protein phosphorylation sites

图5 蛋白二级结构预测Fig.5 Protein secondary structure prediction
2.1.4 蛋白质结构预测分析
通过在线软件SOPMA和Phyre 2预测MGG-01005的二级结构和三级结构。结果表明:该蛋白的二级结构包括α-螺旋(Alpha helix)、延伸链(extended strand)、β-转角(Beta turn)和无规则卷曲(random coli),分别占总氨基酸的31.37%、13.73%、4.48%和50.33%(图5);三级结构见图6。
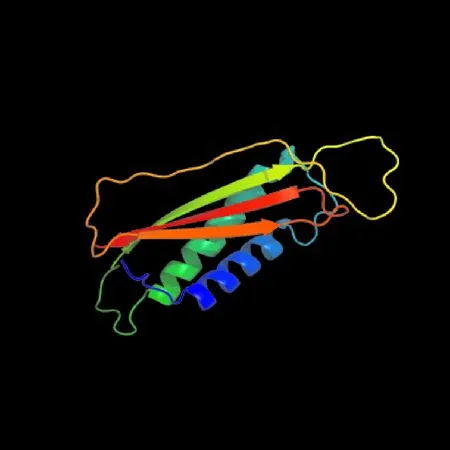
图6 蛋白三级结构预测Fig.6 Protein tertiary structure prediction
2.1.5 同源性分析及聚类分析
通过NCBI blastp对MGG-01005进行物种间同源性分析,经ClustalX比对序列后,再使用MEGA7.0软件建立系统发育树,进行聚类分析。NCBI数据库提供的诸多序列,从中选取相似度高于80%的序列进行聚类分析(共选取8个序列)。结果见图7,MGG-01005与PspLS_03243和动力蛋白轻链Tctex-1A链聚类到一起,表明与这两个蛋白亲缘关系更近。
2.2 pETM13-MGG-01005蛋白表达与纯化结果分析
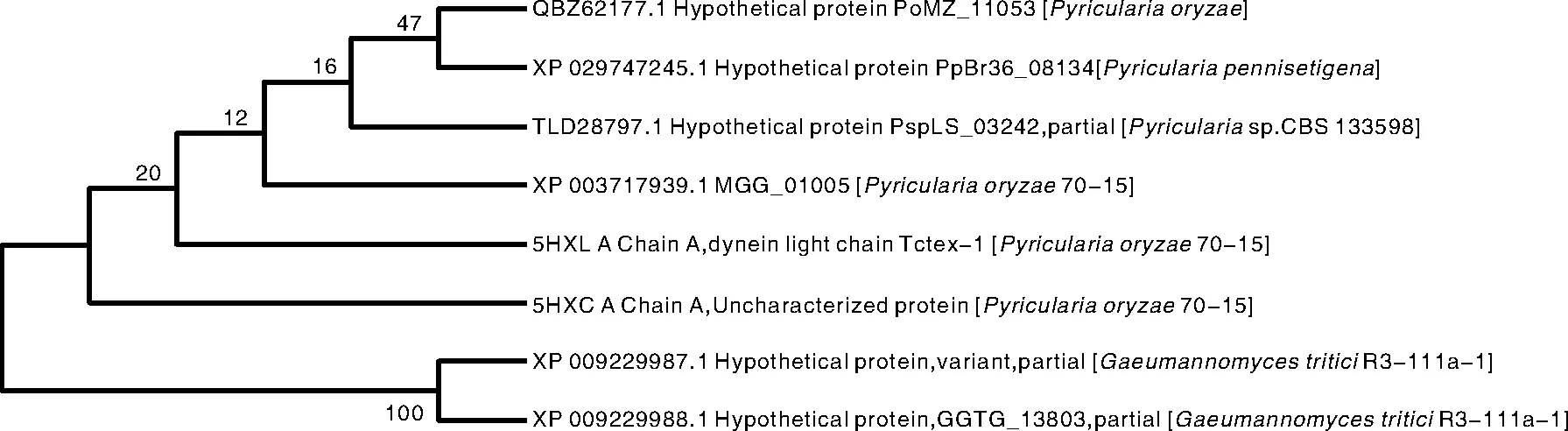
图7 系统进化树Fig.7 Phylogenetic tree
通过重组蛋白pETM13-MGG-01005的诱导表达和NI-亲和层析结果(图8)可看出,该蛋白可溶于裂解后的上清中,能够用于后续蛋白纯化。SDS-PAGE检测显示,当咪唑浓度为80~300 mmol·L-1时均可洗脱蛋白,其中80 mmol·L-1可洗脱大量蛋白,但随咪唑浓度增加,可洗脱蛋白量减少,表明在实验浓度中80 mmol·L-1为最佳咪唑浓度。洗脱蛋白相对分子质量约为16 ku,与目标蛋白大小相符。蛋白脱盐和离子交换层析的结果显示(图9),目的蛋白主要存在于脱盐穿出液B液中,可使用B液进行阴离子交换层析纯化。纯化结果显示,该蛋白洗脱峰较单一,带电性质均一且对低盐条件具耐受性。SDS-PAGE检测显示,洗脱液A2中蛋白含量最高,但存在少许杂带,仍需进一步纯化分析。分子筛结果显示(图10),该蛋白的洗脱峰形态单一,对称性好,在层析柱约11 mL左右出峰,相对分子质量约为35 ku,与该蛋白相对分子质量所对应的理论出峰位置不符,推测该蛋白以二聚体形式存在。SDS-PAGE检测发现洗脱液A2中该蛋白含量最高且无杂带,本实验最终成功纯化该重组蛋白。
3 讨论
稻瘟病菌没有特定的发病时期和部位,它的菌丝和分生孢子可寄宿在病植体内越冬,待次年条件适宜时可迅速繁殖导致流行病害[38-39]。菌丝生长可侵染邻近细胞使病菌得到扩展,其生长速度影响着病菌致病力和侵染力[40]。目前已有许多研究发现了与稻瘟病菌菌丝生长相关的基因,如缺失MAC1基因会导致菌丝生长缓慢;MPS1基因缺失会导致减少菌丝生长[41];转录因子Pcg1、Pcg2和HOX1、HOX4、HOX6、HOX8的基因缺失均会抑制菌丝生长[42-43]。MGG-01005是新发现的与稻瘟病菌菌丝生长发育相关的基因,并且它不依赖动力蛋白调节菌丝生长。稻瘟病菌具潜育期短,繁殖速度快并且可远距离传播等特点[39]。目前对其防治的主要手段是开发化学药剂和培育抗病新品种,但该病菌变异能力强,易于产生化学药剂抗药性和新抗病品种抗性[43]。因此,对稻瘟病菌的发生、菌丝生长发育以及致病的分子机制的相关研究对于稻瘟病的防治具有重要意义。

20~300依次表示洗脱液中咪唑浓度(20、40、60、80、100、200、300 mmol·L-1)。20-300 represented the concentration of imidazole in the elution buffer(20, 40, 60, 80, 100, 200, 300 mmol·L-1), respectively.图8 pETM13-MGG-01005 亲合层析的SDS-PAGE检测Fig.8 Affinity chromatography (Ni-NTA) and SDS-PAGE analysis of pETM13-MGG-01005
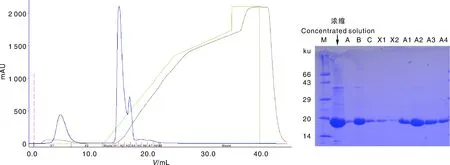
M,蛋白分子量标准;A-C,脱盐A-C液;X1-X2,穿出;A1-A4,洗脱液。M, Protein marker; A-C, The liquid of desalt A-C; X1-X2, Protein exudates; A1-A4, Eluents.图9 pETM13-MGG-01005离子交换层析(Resource Q)及SDS-PAGE检测Fig.9 Ion-exchange column chromatography (Resource Q) and SDS-PAGE analysis of pETM13-MGG-01005
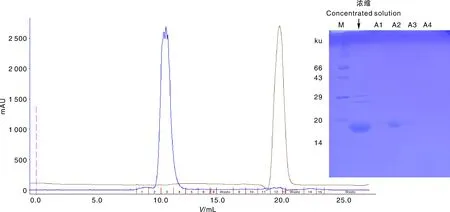
M,蛋白分子量标准;A1-A4,洗脱液。M, Protein marker; A1-A4, Eluents.图10 pETM13-MGG-01005分子筛分析(Superdex 75 10/300 GL)及SDS-PAGE检测Fig.10 Gel filtration (Superdex 75 10/300 GL) and SDS-PAGE analysis of pETM13-MGG-01005
本研究中通过对MGG-01005的表达纯化以及生物信息学分析结果表明该蛋白分子量约为16 ku,属于动力蛋白轻链Tctex-1家族成员,以二聚体形式存在,此结果与李国瑞等[13]的研究结果一致。在KEGG数据库中查询不到MGG-01005参与的相关信号转导通路,因此,该基因具体功能仍暂不明确。对其进行表达纯化以及生物信息学分析对于进一步研究该基因的功能有一定理论与实践意义,可以为今后针对稻瘟病菌菌丝的生长发育以及相关致病的分子机制的研究奠定一定的基础。
4 结论
本研究使用生物信息学技术,了解到MGG-01005属于Tctex-1家族成员,相对分子质量约为16 471.49 u,共编码153个氨基酸,等电点为6.47。该蛋白不具备跨膜结构和信号肽,不是分泌蛋白,有23个磷酸化活性位点。二级结构含有α-螺旋、β-转角、延伸链和无规则卷曲。该蛋白可在0.1 mmol·L-1IPTG,18 ℃,180 r·min-1,16 h条件下被诱导表达。亲和层析的最适缓冲液组分为20 mmol·L-1Tris-HCl,500 mmol·L-1NaCl,80 mmol·L-1咪唑。阴离子交换层析表明,该蛋白对低盐条件有耐受性;当分子筛层析的缓冲液为20 mmol·L-1Tris-HCl,pH 8.0,150 mmol·L-1NaCl时具有均一对称构象,洗脱峰出峰位置所对应的蛋白分子量约为35 ku,推测该蛋白以二聚体形式存在。本研究成功纯化并获得大量重组蛋白,可为进一步探索MGG-01005蛋白的功能以及与稻瘟病菌菌丝生长的相关研究提供一定的理论与实践依据。
