产细菌素屎肠球菌的筛选鉴定及其抑菌特性
2021-03-31张明,罗强,魏婕,刘巧,罗璠
张 明,罗 强,魏 婕,刘 巧,罗 璠
(西南民族大学生命科学与技术学院,青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041)
屎肠球菌是人和动物肠道内的常见菌种,也是发酵食品中的正常菌种,在饲料、医药和食品中发挥着重要作用。屎肠球菌是我国农业部发布的《饲料添加剂品种目录(2013)》中的益生菌之一,能提高畜禽的生长性能和营养物质的消化率[1],降低粪便中病原微生物的数量[2-3];屎肠球菌也用于调节人的肠道菌群,治疗因肠道菌群失调引起的腹泻[4]。屎肠球菌在发酵食品中得到了广泛应用: Moreno等[5]将屎肠球菌DPC 1146作为发酵剂添加到切达干酪中,提高了干酪成熟过程中的稳定性;Pingitore等[6]将屎肠球菌添加到新鲜米纳斯奶酪中,延长了奶酪的保质期。
肠球菌素是肠球菌核糖体合成机制产生的一类具有抗菌活性的蛋白质类物质的统称,1975年,Kramer等[7]首次报道了屎肠球菌E1可以产生细菌素enterocin E1,到目前为止已经报道了很多产细菌素的屎肠球菌[8-9]。屎肠球菌素应用最广泛的主要有enterocin A和enterocin B[10],属于II类细菌素,这类细菌素为小分子多肽或蛋白质,具有良好的热稳定性和广谱抑菌性,对单核细胞性李斯特菌具有很强的抑制作用。屎肠球菌素常被用于肉制品和乳制品防腐。Chakchouk-Mtibaa等[11]的研究表明,在4 ℃保存的火鸡肉样品中添加屎肠球菌素BacFL 31,可以延长火鸡肉保质期并增强感官属性。Vandera等[12]研究表明,将屎肠球菌KE82添加到牛奶中可以产生enterocin A和enterocin B,抑制李斯特菌的生长,延长了牛奶的保质期。
益生菌商业化的关键因素之一是其能否长期维持遗传稳定。近几年对于益生菌的遗传稳定性有相关研究,Min等[13]针对基因组进行研究,发现两歧双歧杆菌和长双歧杆菌在连续传代过程中整个基因组序列保持高度的遗传稳定性;孔亚楠[14]对1 株植物乳杆菌进行了4 000 代连续传代,发现菌株在连续传代过程中,细胞形态、碳水化合物代谢能力、对肠胃液和胆盐的耐受性及自凝集能力保持高度的遗传稳定性。但是关于细菌素遗传稳定性的研究鲜有报道。本研究拟从四川红原地区采集的传统发酵乳样中,筛选高产抑菌物质的乳酸菌。通过对菌株所产细菌素的生物学特性、遗传稳定性及抑菌特性的研究,筛选遗传稳定的高产菌株,以期为后期工业开发提供备选菌种。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
传统发酵酸奶样品8 份,均采自四川阿坝州红原县。
1.1.2 指示菌
大肠杆菌ATCC 8099、枯草芽孢杆菌、蜡样芽孢杆菌、地衣芽孢杆菌、金黄色葡萄球菌、单核细胞性李斯特菌、植物乳杆菌、短乳杆菌、禾谷镰刀霉菌、鞘氨醇单胞菌、海氏肠球菌、耐久肠球菌,以上非标准菌株均为本实验室筛选鉴定保藏。
1.1.3 培养基与试剂
MRS培养基、改良MC培养基、LB培养基 青岛海博生物技术有限公司;细菌基因组DNA提取试剂盒天根生化科技有限公司;中性蛋白酶、碱性蛋白酶、蛋白酶K、酸性蛋白酶、胃蛋白酶、胰蛋白酶、过氧化氢酶德国Biofroxx公司;乳酸链球菌素 北京索莱宝生物科技有限公司。
1.2 仪器与设备
ST16R高速冷冻离心机 赛默飞世尔科技有限公司;GH6000电热恒温培养箱 天津泰斯特设备有限公司;ETC811基因扩增聚合酶链式反应(polymerase chain reaction,PCR)仪 北京东胜创新生物科技有限公司;Tanon2500凝胶成像系统 中国天能公司;Vortex-BE1旋涡混合器 江苏其林贝尔仪器制造有限公司;UV1900紫外-可见分光光度计 上海佑科仪器公司;ELX-800酶标仪 美国伯腾仪器有限公司;R40-IIB2超净工作台 中国青岛海尔有限公司;GI54DW高压蒸汽灭菌锅 厦门致微仪器有限公司。
1.3 方法
1.3.1 乳酸菌的分离纯化
取1 mL酸奶于10 mL灭菌的EP管中,采用10 倍稀释法进行梯度稀释,选取100 μL 10-3~10-5稀释度的样品涂布于灭菌的改良MC培养基上,30 ℃静置培养24~48 h。挑取产生钙溶圈的菌落,在MRS固体培养基中反复划线培养直至单菌落,将分离得到的菌株进行革兰氏染色和触酶实验,革兰氏阳性且触酶阴性的菌株作为后续筛选的出发菌株,保藏备用。
1.3.2 发酵上清液制备
将菌株接种于MRS液体培养基,30 ℃静置培养24 h,将发酵液于6 000 r/min、4 ℃离心15 min,取上清液,用1 mol/L HCl溶液和1 mol/L NaOH溶液将上清液pH值调至6.0,用0.22 μm无菌滤膜过滤,4 ℃冷藏备用。
1.3.3 产细菌素乳酸菌的筛选
1.3.3.1 96 孔板初筛
以标准菌株为指示菌,采用96 孔板法测定菌株发酵液的抑菌效果[15]。取15 µL指示菌菌悬液(108CFU/mL)和185 µL菌株发酵上清液,置于无菌96 孔细胞培养板中,30 ℃静置培养12 h,用酶标仪测定OD600nm值,以等量指示菌接种于空MRS培养基为空白对照,按下式计算抑菌率。抑菌率达到50%及以上的菌株进一步复筛。
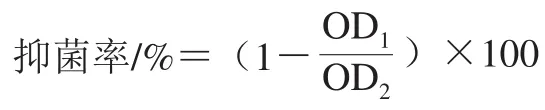
式中:OD1表示指示菌在乳酸菌发酵上清液中培养12 h后的OD600nm值;OD2表示指示菌在空白MRS培养基中培养12 h后的OD600nm值。
1.3.3.2 平板打孔法复筛
采用平板打孔法测定抑菌活性[16]:用1.5%的素琼脂10 mL铺底层,晾干后上面均匀放置牛津杯,将含108CFU/mL的指示菌菌液100 μL加入到10 mL的LB培养基中,混匀后倒入平板,晾干后取出牛津杯,每个孔内加入100 μL的发酵上清液,冰箱中放置2 h扩散,37 ℃静置培养5~12 h,用游标卡尺测量抑菌圈直径。以乳酸链球菌素作为阳性对照,以无菌水为阴性对照,以大肠杆菌ATCC 8099和金黄色葡萄球菌作为指示菌(后续的平板抑菌实验,未特殊说明的均以此设置阴性对照、阳性对照和指示菌)。
1.3.4 H2O2排除
将过氧化氢酶溶解并按照终质量浓度为1 mg/mL添加到菌株发酵上清液中,37 ℃水浴2 h后沸水浴煮沸5 min使酶灭活,用平板打孔法测定其抑菌活性[17]。
1.3.5 形态观察与生理生化鉴定
对SC-Y12进行形态学观察及生理生化实验。将菌株在MRS固体培养基30℃静置培养24 h,观察菌落形态。美兰牛奶生长实验、溶明胶实验、吲哚实验和糖发酵实验参照文献[18-19]。
1.3.6 基因同源性分析
1.3.6.1 16S rDNA序列同源性分析
用细菌基因组DNA提取试剂盒提取细菌总DNA,PCR扩增16S rDNA基因片段。16S rDNA引物序列[20]:上游引物Eu27F:5’-AGAGTTTGATCCTGGCTCAG-3’;下游引物1541R:5’-AAGGAGGTGATCCAGCC-3’。PCR扩增体系:采用25 µL体系,DNA模板1 µL,上游引物2 µL,下游引物2 µL,2×TaqMaster Mix预混酶12.5 µL,无菌双蒸水7.5 µL。PCR扩增程序:95 ℃预变性5 min,94 ℃变性45 s,58 ℃退火45 s,72 ℃延伸45 s,循环30 次,72 ℃延伸8 min,4 ℃保存。
凝胶电泳检验合格后送生工生物工程(上海)股份有限公司进行测序。将测序结果拼接后在NCBI中进行同源性比对,选取GenBank数据库中同源性达99%以上的部分序列进行比对。
1.3.6.2rpoA序列同源性分析
以菌株的DNA基因组为模板,将其管家基因RNA聚合酶α亚基基因进行扩增。rpoA引物序列[21]:上游引物rpoA-21-F:5’-ATGATYGARTTTGAAAAACC-3’;下游引物rpoA-23-R:5’-ACHGTRTTRATDCCDGCRCG-3’。PCR扩增体系:采用25 µL体系,DNA模板1 µL,上游引物2 µL,下游引物2 µL,2×TaqMaster Mix预混酶12.5 µL,无菌双蒸水7.5 µL。PCR扩增程序:95 ℃预变性5 min,3 次循环(95 ℃变性60 s,46 ℃退火135 s,72 ℃延伸75 s),30 次循环(95 ℃变性35 s,46 ℃退火75 s,72 ℃延伸75 s),72 ℃延伸7 min,4 ℃保存。
凝胶电泳检测扩增产物合格后将PCR产物送交生工生物工程(上海)股份有限公司进行测序。序列与GenBank中已知菌株的rpoA基因序列进行同源性分析,用MEGA 7.0软件构建系统发育树。根据16S rDNA及ropA序列同源性分析对菌株进行菌种鉴定。
1.3.7 抑菌活性与生长量测定
将菌株以1%的接种量转入MRS液体培养基中,30 ℃静置培养24 h,每2 h取样一次,测定OD600nm,采用96 孔板法测定发酵上清液的抑菌活性,绘制菌株抑菌活性曲线和生长曲线。
1.3.8 遗传稳定性分析
将菌株以1%的接种量接种到MRS液体培养基进行连续传代,取每个传代周期第16小时的发酵液制备发酵上清液,用96 孔板法测定其抑菌活性,检测该菌株在传代过程中抑菌性能的稳定性。
1.3.9 抑菌物质特性分析
1.3.9.1 pH值敏感性
将菌株的发酵上清液调节到pH 3.0、5.0、6.0、7.0、9.0,室温放置30 min,再将pH值回调到pH 6.0,用平板打孔法测定发酵液的抑菌活性,以pH 6.0的发酵上清液作为对照。
1.3.9.2 蛋白酶的敏感性
将菌株的发酵上清液分别用酸性蛋白酶、碱性蛋白酶、胃蛋白酶、胰蛋白酶、中性蛋白酶、蛋白酶K在酶最适的作用条件下温浴处理30 min,冷却至室温,将pH值调节到6.0,平板打孔法测定发酵上清液的抑菌活性,以未加蛋白酶处理的发酵上清液(pH 6.0)作为对照。
1.3.9.3 热稳定性
将菌株的发酵上清液分别在60、80、100 ℃条件下水浴30 min,冷却至室温,采用平板打孔法测定发酵液的抑菌活性,以室温条件下处理的发酵上清液作为对照。
1.3.10 抑菌谱的测定
采用平板打孔法测定发酵上清液对各种指示菌的抑菌效果,保证指示菌细菌的终浓度为106CFU/mL,霉菌的终浓度为104CFU/mL[22]。
1.4 数据分析和处理
2 结果与分析
2.1 菌株的分离筛选
通过革兰氏染色、触酶实验以及改良MC培养基钙溶圈筛选,从8 份样品中共分离得到308 株供试菌株。通过菌种的初筛和复筛,最后选取1 株对大肠杆菌和金黄色葡萄球菌有明显稳定抑菌效果的菌株(图1),编号为SC-Y112,作为后续研究的出发菌株。

图 1 平板抑菌结果Fig. 1 Results of antibacterial tests on agar plates
2.2 H2O2排除
通过H2O2排除实验发现,用过氧化氢酶排除H2O2后菌株的抑菌能力几乎没有变化(P>0.05),结果如表1所示,说明发酵上清液的抑菌效果不是由于H2O2造成的。

表 1 H2O2对菌株抑菌性能的影响Table 1 Effect of H2O2 on the antibacterial properties of the strain
2.3 菌株鉴定
2.3.1 形态观察和生理生化实验
菌株在MRS固体培养基生长时形成的菌落直径为0.2~0.3 mm,表面光滑,质地均匀,乳白色。菌株在美兰牛奶中培养48 h,美兰牛奶褪色,糖发酵实验结果如表2所示。
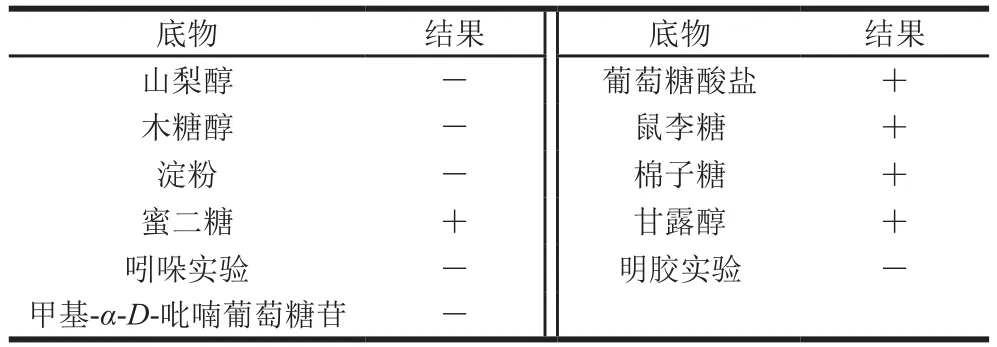
表 2 生理生化特性Table 2 Physiological and biochemical characteristics of the strain
2.3.2 16S rDNA序列同源性分析
通过16S rDNA基因序列测定(NCBI序列号为MT032338)及同源性分析,发现该菌株与肠球菌属的同源性均高达99%以上。16S rDNA序列鉴定能确定该菌株是肠球菌属,但不能确定该菌株的种水平,因此采用管家基因进一步鉴定。
2.3.3rpoA序列同源性分析

图 2 SC-Y112的ropA基因序列系统进化树Fig. 2 Phylogenetic tree of strain SC-Y112 based on ropA gene sequence
将菌株的rpoA基因测序并进行序列同源性分析,进一步构建了菌种的系统进化树,结果如图2所示。该菌株与标准菌株屎肠球菌(Enterococcus faecium)聚为一类。结合菌落形态和生理生化实验结果、16S rDNA基因以及rpoA基因序列分析,判定该菌株为屎肠球菌。
2.4 抑菌活性与生长量测定结果
细菌素的产生与其菌株生长具有一定的关联,研究表明细菌素的产生一般在对数生长期[23-24]。菌株SC-Y112的生长和细菌素代谢曲线如图3所示,菌株在接种后4 h开始进入对数生长期,16 h进入稳定期。菌株对大肠杆菌和金黄色葡萄球菌的抑制效果较为一致,均是在接种后6 h开始分泌抑菌活性物质,在12 h抑菌活性达到较高值并保持稳定,20 h后抑菌活性开始下降。这可能是由于在酸性条件下抑菌物质能吸被产生菌细胞表面吸附[25],或者抑菌物质被胞外蛋白酶水解,从而引起了发酵液中抑菌活性物质浓度下降。

图 3 菌株生长量与抑菌活性的关系Fig. 3 Relationship between SC-Y112 growth and its antibacterial activity
2.5 遗传稳定性分析
通过生长曲线测定,发现SC-Y112以16 h为一个传代周期,在每个传代周期内,菌体数量以接近指数形式(2n)增殖,即一个传代周期内的生长代数(细菌进行分裂的次数)为log2100≈6.64 代[26]。将菌株连续传代至110 代,检测每个世代的菌株发酵上清液(16 h)的抑菌活性,结果如表3所示。在13~80 代之间抑菌活性保持稳定,在86 代以后抑菌活性有明显下降(P<0.05),但仍保持约80%抑菌活性。白梅[26]的研究证明干酪乳杆菌(Lactobacillus caseiZhang)在2 000 代的传代中其表型特征,对胃液、肠液、胆汁的耐受性均保持稳定,基因组突变率也较低,说明有良好的稳定性。刘衍芬[27]研究嗜热链球菌和保加利亚乳杆菌,在连续传代至约85 代时表型特征、发酵性能、随机扩增多态性DNA标记(random amplified polymorphic DNA,RAPD)、全蛋白质十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)均无显著变化;但在传代至约113 代时,嗜热乳杆菌的全细胞蛋白质电泳图谱显示有一些高分子质量的蛋白质不再表达,保加利亚乳杆菌RAPD和全蛋白质SDS-PAGE均有变化。本研究表明抑菌物质在86 代以后出现明显下降,可能是由菌种衰退造成,具体原因有待进一步分析。
2.6 抑菌物质特性分析
2.6.1 pH值稳定性
如表4所示,发酵上清液在pH 9.0条件下处理后,不显示抑菌活性,在pH 3.0~7.0范围内处理后仍表现抑菌活性,但随着pH值的上升抑菌活性明显下降(P<0.05),说明该菌株所产的抑菌物质在酸性条件下较稳定,而在碱性条件下不稳定,该结果与前期很多研究结果相似[28-30]。

表 4 不同pH值处理发酵上清液的抑菌活性Table 4 Diameters of inhibition zones of the fermentation supernatant under different pH conditions
2.6.2 酶的敏感性

表 5 不同蛋白酶处理发酵上清液的抑菌活性Table 5 Diameters of inhibition zones of the fermentation supernatant after being treated with diffeent proteases
如表5所示,SC-Y112的发酵上清液经蛋白酶K处理后抑菌效果完全消失,可以初步判断SC-Y112所产的抑菌物质属于蛋白质性质。而SC-Y112的抑菌物质表现出对酸性蛋白酶、胃蛋白酶和胰蛋白酶的敏感性,与多数研究结果[31]一致,结合pH值稳定性实验推测SC-Y112产生的抑菌活性物质可能在碱性条件下不稳定,因而出现碱性酶处理后活性消失,也可能是被胰蛋白酶水解而造成的活性消失;而该种物质能够被酸性蛋白酶类水解从而失去活性。该抑菌物质表现出对中性蛋白酶作用不敏感,该特性与尚楠等[32]报道的1 株双歧杆菌所产细菌素的性质相似。
2.6.3 热稳定性

表 6 高温处理发酵上清液的抑菌活性Table 6Diameters of inhibition zones of the high temperature-treated fermentation supernatant
如表6所示,SC-Y112发酵上清液在高温处理后仍具有抑菌效果,在100 ℃处理30 min后对指示菌仍具有约87%的抑菌效果,温度对SC-Y112发酵上清液的抑菌效果影响不显著(P>0.05),说明SC-Y112发酵上清液中的抑菌物质有较好的耐热性。大量研究也证明了细菌素具有良好的热稳定性[33-34],能在100 ℃甚至121 ℃条件下仍保持稳定。
2.7 抑菌谱测定结果

表 7 屎肠球菌发酵上清液的抑菌谱Table 7 Antibacterial spectrum of the fermentation supernatant of E. faecium
由表7可见,抑菌谱实验表明,SC-Y112产生的抑菌物质具有一定的广谱抑菌性,对部分革兰氏阳性指示菌(金黄色葡萄球菌、枯草芽孢杆菌、单核细胞性李斯特菌、蜡样芽孢杆菌)和革兰氏阴性指示菌(大肠杆菌、沙门氏菌、鞘氨醇单胞菌)均具有较好的抑菌效果,其中对单核细胞性李斯特菌的抑菌效果最好,对霉菌没有抑制效果。屎肠球菌产生的细菌素普遍能抑制革兰氏阳性菌,尤其是单核细胞性李斯特菌,对金黄色葡萄球菌也有抑制效果[35]。而对革兰氏阴性菌株和真菌的抑菌效果,则表现出差异,屎肠球菌TJUQ1[36]所产细菌素不仅能抑制大肠杆菌和沙门氏菌,而且还能抑制鲁氏酵母;屎肠球菌ZJ19[37]能抑制革兰氏阴性菌(大肠杆菌和沙门氏菌);而屎肠球菌AS 1.2025[38]、屎肠球菌M-2[39]所产细菌素不抑制大肠杆菌。另外,本研究中菌株SC-Y112产生的细菌素对大肠杆菌(革兰氏阴性菌)和金黄色葡萄球菌(革兰氏阳性菌)的抑菌效果接近,这与许多研究结果[40]有所差异,造成这种差异的原因目前鲜见相关的杀菌机理的深入研究报道,需进一步探索。SC-Y112产生的抑菌物质对乳酸杆菌(植物乳杆菌和短乳杆菌)没有抑制效果,这种抑菌特性与多数研究报道有差异[41],这也是其在食品领域可能具有更好的应用效果。同时,SC-Y112对亲缘关系更近的肠球菌(海氏肠球菌和耐久肠球菌)有抑制效果,相似的抑菌特性在许多研究中均有报道[42],这种抑菌特性为多数细菌素所共有。
3 结 论
屎肠球菌是乳酸菌中肠球菌属重要菌种,能发酵糖类产生多种酸、醇和细菌素,具有高产酸能力、抗氧化能力和拮抗致病菌等能力。大量研究表明屎肠球菌可以产生细菌素,从而在食品及饲料行业中广泛应用。本研究从川西北阿坝地区传统发酵酸奶中分离筛选出1 株具有较高抑菌活性的菌株SC-Y112,经过16S rDNA和rpoA序列同源性分析,结合菌落形态和生理生化实验,鉴定为屎肠球菌。经过排酸及排除H2O2后,发酵上清液仍具有明显抑菌特性,采用不同蛋白酶处理后,抑菌物质的抑菌活性出现下降或消失,确定该菌株产生的抑菌物质含有蛋白质成分,由于该物质具有较强的热稳定性,初步推测其是一种小肽。通过菌株连续传代实验,证明该菌株在110 代内能保持较好的抑菌性,说明该菌株具有良好的遗传稳定性,该抑菌物质在pH 3.0~7.0的条件下有较好的抑菌性,对革兰氏阳性菌和革兰氏阴性菌均有一定抑菌效果。该菌株抑菌效果明显,遗传特性稳定,有望成为商业开发的备选菌株。
