促酱醪发酵芽孢杆菌的筛选及应用
2021-03-31吴博华蒋雪薇张金玉阮志强梁胜男陈永发周尚庭
吴博华,蒋雪薇,2,*,张金玉,阮志强,梁胜男,陈永发,2,周尚庭
(1.长沙理工大学化学与食品工程学院,湖南 长沙 410114;2.湖南省调味品发酵工程技术研究中心,湖南 长沙 410600;3.加加食品集团股份有限公司,湖南 长沙 410600)
酱油起源于中国,至今已有2 500多年的历史[1]。酱油是以大豆和小麦为主要原料,经过微生物及其酶系的长期作用,形成的具有特殊色泽、香气、滋味和体态的液态调味液[2]。传统酱油酿造是一个开放式的自然发酵过程,混合菌群的发酵体系赋予了酱油独特的风味和营养价值,但开放式发酵容易使酱油受到污染微生物的影响,质量不稳定,加之发酵周期长,从产量到品质都难以适应当下酱油企业发展的要求。现代酱油发酵工艺采用封闭连续式制曲、人工添加风味菌的罐式高盐稀态发酵,制曲及发酵得到了有效的控制,有利于保证产品品质[3]。酱油酿造的关键工艺——制曲和发酵均与微生物的代谢活动密切相关,其中制曲主要是米曲霉(Aspergillus oryzae)或酱油曲霉(A. sojae)的生长及产生降解蛋白质、淀粉等大分子物质相关的蛋白酶、淀粉酶等,为后续发酵中产生糖类、多肽,氨基酸等酱油风味物质奠定了基础[4];酱醪发酵则是以鲁氏酵母(Saccharomyces rouxii)等酵母菌和植物乳杆菌(Lactobacillus plantarum)等乳酸菌为主体的混合菌群发酵体系,在稀醪状态下代谢产生醇、酯、酸、酮、醛、酚和杂环类化合物等物质,赋予酱油特殊的风味[5]。
芽孢杆菌是传统发酵食品中常见的微生物[6-7],具有良好的耐受性和蛋白酶及淀粉酶分泌能力,在发酵中能促进原料降解和提升发酵食品风味[8-9]。有研究报道,高产谷氨酰胺酶的芽孢杆菌能提升酱油氨态氮的含量[10];随着对酱油发酵过程中微生物群落结构研究的深入,发现芽孢杆菌也是酱醪中的优势菌群,在发酵过程中发挥重要的作用[11-14]。可以看出,芽孢杆菌对酱油发酵的呈味增香具有比较关键的作用。鉴于芽孢杆菌的存在影响成品酱油的灭菌效果[15],对酱醪中芽孢杆菌的研究一直不够重视,随着酱香型白酒中芽孢杆菌对酱香及功能因子贡献的深入研究[16-17],芽孢杆菌作为酱油酿造菌种的基因资源及种质资源将逐渐受到关注。本研究从高盐稀态发酵酱醪中分离、筛选、鉴定出3 株促进酱醪发酵的芽孢杆菌,并将其应用到酱醪的盐卤发酵中,发现有提升发酵酱油氨态氮、还原糖含量和吡嗪类物质及其前体乙偶姻和2,3-丁二醇含量的作用,为芽孢杆菌在酱油发酵中的应用奠定了基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与试剂
高盐稀态发酵酱醪采自湖南某酱油厂;枯草芽孢杆菌(B. subtillis)CS1.03,分离自晒露法酱醪,由湖南省调味品发酵工程技术研究中心(长沙理工大学分中心)保藏。
福林-酚 上海麦克林生化科技有限公司;L-酪氨酸上海博奥生物科技有限公司;刚果红 北京化学试剂公司;羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC-Na)、酪蛋白、3,5-二硝基水杨酸 国药集团化学试剂有限公司;其他试剂均为分析纯。
1.1.2 培养基
50 g/L盐质量浓度牛肉膏蛋白胨培养基:蛋白胨10 g/L、牛肉膏3 g/L、琼脂20 g/L、NaCl 50 g/L,pH 7.0,121 ℃灭菌20 min;50 g/L盐质量浓度酪素培养基:干酪素4 g/L于碱性条件下溶解后调节pH值至中性,115 ℃灭菌20 min后与50 g/L盐质量浓度牛肉膏蛋白胨培养基混匀;50 g/L盐质量浓度淀粉培养基:取牛肉膏5 g/L、蛋白胨10 g/L、氯化钠50 g/L、可溶性淀粉2 g/L、琼脂20 g/L,pH 7.0,121 ℃灭菌20 min;50 g/L盐质量浓度CMC-Na培养基:CMC-Na 10 g/L、磷酸二氢钾1 g/L、酵母粉10 g/L、蛋白胨10 g/L、氯化钠50 g/L、琼脂20 g/L、pH 7.0,121 ℃灭菌20 min;制曲培养基:蒸煮豆粕-炒麦-水以2∶1∶1质量比混匀后装瓶,121 ℃灭菌20 min。
1.2 仪器与设备
E200显微成像系统 尼康仪器(上海)有限公司;UV1800紫外-可见分光光度计 日本岛津公司;ZWY-2102C恒温振荡培养箱 上海智城分析仪器制造有限公司;PE28 pH计 梅特勒-托利多仪器(上海)有限公司;VERITI梯度聚合酶链式反应(polymerase chain reaction,PCR)扩增仪 美国应用生物系统公司;ChampGel 5000 Plus凝胶成像系统 北京赛智创业科技有限公司;436GC/EVOQ TQ/PAL气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪美国布鲁克科技有限公司;Rxi-5Sil MS色谱柱 瑞思泰康科技(北京)有限公司;50/30 μm DVB/CAR/PDMS固相微萃取(solid-phase microextraction,SPME)针美国色谱科公司。

图 1 促酱醪发酵芽孢杆菌的筛选流程Fig. 1 Flow chart of the screening process of Bacillus promoting moromi fermentation
1.3 方法
1.3.1 芽孢杆菌筛选流程
芽孢杆菌筛选见图1。
1.3.2 产蛋白酶芽孢杆菌的初筛
称取不同发酵时间(2、3、4 个月)的高盐稀态发酵酱醪样品30 g,于无菌条件下加入到100 mL无菌水中,混匀,85 ℃水浴处理10 min,梯度稀释后涂布于50 g/L盐质量浓度酪素培养基平板,37 ℃恒温培养48 h,挑取水解圈与菌落直径比(D/d值)较大的菌株进一步分纯获得纯培养菌株。
1.3.3 牛津杯法复筛高蛋白酶、淀粉酶、纤维素酶活性菌株
挑取纯培养菌株接种至50 g/L盐质量浓度牛肉膏蛋白胨液体培养基培养,37 ℃、180 r/min,培养24 h,收集菌体,制备成菌细胞数为108个/mL的菌悬液,取0.1 mL菌悬液接种到插在50 g/L盐质量浓度酪素培养基的牛津杯中[18],37 ℃恒温培养48 h,测量水解圈直径。挑取优选得到的高蛋白酶活性菌株,按照酪素培养基所述方法接种到插在50 g/L盐质量浓度淀粉培养基、羧甲基纤维素钠培养基的牛津杯中,37 ℃恒温培养48 h,将碘液喷洒在淀粉培养基上,测量淀粉水解圈直径,将1 mg/mL刚果红溶液喷洒在羧甲基纤维素钠培养基上,染色1 h后,用1 mol/L NaCl溶液洗涤1 h,测量纤维素水解圈直径。
1.3.4 酶活性测定
取1 mL菌细胞数为108个/mL的芽孢杆菌菌悬液接种于制曲培养基中,37 ℃恒温培养72 h,分别培养0、12、24、36、48、60、72 h取样测定蛋白酶、淀粉酶、纤维素酶活性。
1.3.5 菌种鉴定
1.3.5.1 菌落及菌体形态鉴定
挑取少量菌落在50 g/L盐质量浓度牛肉膏蛋白胨培养基上划线,37 ℃恒温培养48 h后观察结果,并对菌株进行革兰氏染色和芽孢染色,显微镜成像系统观察形态并成像。
1.3.5.2 16S rRNA序列分析鉴定
提取所筛菌株的基因组DNA,并以此为模板,以通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)为引物扩增菌株16S rRNA基因。PCR反应体系(50 μL):模板2 μL,上下游引物各2 μL,Taq聚合酶1 μL,dNTP 4 μL,MgCl23 μL,10×PCR Buffer 5 μL,ddH2O补齐50 μL。PCR条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环25 次;72 ℃延伸10 min。扩增产物送至生工生物工程(上海)股份有限公司进行测序,测序结果与NCBI数据库中序列进行比对,并利用MEGA 7.0软件构建进化树。
1.3.6 制曲及盐卤发酵
将1 mL菌细胞数为108个/mL的芽孢杆菌菌悬液接种到发酵体系中制曲72 h后,按曲-盐水质量比为1∶2拌入16.7%的盐水,置于37 ℃恒温发酵,总计发酵时间为28 d,分别在发酵第0、7、14、21、28天取酱醪压榨酱油。
1.3.7 酶活性测定
1.3.7.1 蛋白酶、淀粉酶活性测定
蛋白酶活性、淀粉酶活性参照GB 1886.174—2016《食品添加剂食品工业用酶制剂》[19]测定,蛋白酶活性以干质量计,计算如下式:
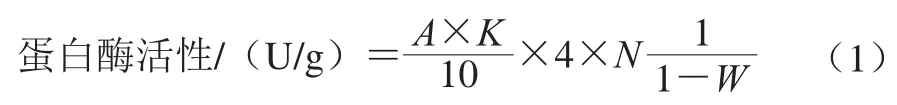
式中:A为在680 nm波长处测得的吸光度;K为吸光常数,本实验K=98.88;N为稀释倍数,本实验N=40;10为反应时间/min;W为曲的质量分数,本实验中W=60.98%。
淀粉酶活性以干质量计,计算公式如下:

式中:c为测试酶样浓度,查询GB 1886.174—2016附录B获得;N为稀释倍数,本实验N=6。
1.3.7.2 纤维素酶活性测定
采用3,5-二硝基水杨酸比色定糖法[20],1 个纤维素酶活性单位(U)定义为1 g干质量曲中纤维素酶在40 ℃、pH 4.8条件下,1 min分解CMC-Na产生葡萄糖的量/mg,纤维素酶活性以干质量计,计算公式如下:

式中:A为待测样品吸光度在标准曲线中对应的标准葡萄糖质量;N为稀释倍数,本实验N=2。
1.3.8 发酵酱油还原糖、总酸、氨态氮测定
还原糖含量测定参照GB 5009.7—2016《食品中还原糖的测定》[21];总酸、氨态氮含量测定参照GB 5009.235—2016《食品中氨基酸态氮的测定》[22]。
1.3.9 发酵酱油中挥发性风味物质分析
样品准备:取发酵相应时间的压榨酱油,添加5 μL质量浓度为0.816 μg/μL的2-甲基-3-庚酮作为内标物,总体积为2 mL;SPME条件:振荡器50 ℃,将酱油样品加热振荡25 min;GC条件:进样口温度250 ℃,程序升温,40 ℃保持2 min,以5 ℃/min升温至120 ℃,保持2 min,再以10 ℃/min升温至230 ℃,保持5 min,载气为高纯氦气,流速为1.2 mL/min,分流比为10∶1;MS条件:电子电离源,电子能量70 eV,发射电流200 μA,离子源温度250 ℃,质量扫描范围m/z30~500。挥发性化合物定量计算公式如下:

式中:C1为挥发性化合物浓度;C2为内标物浓度;A1为挥发性化合物峰面积;A2为内标物峰面积。
1.4 数据处理
使用SPSS Statistics 25软件对水解圈直径进行差异显著性分析,酶活性测定重复3 次,对酱油中挥发性风味物质含量进行数据标准化处理,对挥发性风味物质类别进行聚类分析。
2 结果与分析
2.1 促酱醪发酵芽孢杆菌筛选
酱油是以豆粕和小麦为原料经微生物发酵酿造而成的传统调味品,蛋白酶通过水解原料中的蛋白质产生氨基酸,形成酱油独特的鲜甜风味。本研究以菌株蛋白酶活性为筛选重点,同时以淀粉酶和纤维素酶活性为参考依据,筛选有潜力促进酱醪发酵的芽孢杆菌。用酪素平板法从发酵2、3、4 个月的酱醪中挑选出56 株蛋白酶活性较好的菌株。采用牛津杯法对菌株酶活性大小进行复筛,得到11 株酪素水解圈较大的菌株,牛津杯法筛选高酶活性菌株省去了制曲环节,可减少工作量及筛选时间,实验采用相同浓度的菌悬液,结果重复性好、误差小。再将11 株蛋白酶活性强的菌株接种到牛津杯淀粉平板和牛津杯羧甲基纤维素钠平板上,测量水解圈直径。通过牛津杯法筛选出5 株酶活性强的菌株,其中菌株CS1.21、CS1.17、CS1.13蛋白酶活性较强,菌株CS1.12淀粉酶活性较强,菌株CS1.11纤维素酶活性较强(表1)。

表 1 菌株在不同平板上水解圈直径Table 1 Hydrolysis circle diameters of selected strains on different plates
2.2 筛选菌株酶活性测定

图 2 筛选菌株酶活性测定Fig. 2 Enzymatic activities of five selected strains
为测定筛选菌株酶活性及探究酶活性随时间变化情况,按照1.3.4节方法分别将筛选得到的5 株芽孢杆菌接种到制曲培养基中,测定菌株的蛋白酶、淀粉酶、纤维素酶活性(图2)。通过对制曲不同时间样品的酶活性测定发现,5 株菌蛋白酶活性在制曲第36小时达到最大,酶活性大小为CS1.13>CS1.21>CS1.17>CS1.11>CS1.12,其中菌株CS1.13蛋白酶活性最大,为6 500.2 U/g;淀粉酶活性在制曲第60小时达到最大,酶活性大小为CS1.11>CS1.12>CS1.21>CS1.17>CS1.13,其中菌株CS1.11淀粉酶活性最大,为59.2 U/g;纤维素酶活性在制曲第36~48小时达到最大,酶活性大小为CS1.17>CS1.11>CS1.13>CS1.12>CS1.21,其中菌株CS1.17纤维素酶活性最大,为3.42 U/g。通过比较5 株菌淀粉酶、蛋白酶、纤维素酶活性的测定结果,发现菌株CS1.11是产淀粉酶和纤维素的优势菌,有利于酱油发酵过程中还原糖的积累,为微生物的生长代谢提供营养;菌株CS1.13和CS1.17是产蛋白酶活性和纤维素酶的优势菌,有利于酱油发酵过程中蛋白质和纤维素的水解,提升酱油中氨态氮及还原糖的含量,对改善酱油的滋味、促进美拉德反应有帮助,故对以上3 株芽孢杆菌进行鉴定及发酵研究。
2.3 菌种鉴定
2.3.1 形态学鉴定
将菌株CS1.11、CS1.13和CS1.17在50 g/L盐质量浓度牛肉膏蛋白固体平板上划线培养48 h,菌落为乳白色,形状不规则,中间区域有褶皱隆起。通过革兰氏染色和芽孢染色实验,确定3 株菌均为革兰氏阳性菌、短杆状、有芽孢产生(图3)。

图 3 3 株菌菌落和菌体形态Fig. 3 Colonies and morphological features of three strains with the highest enzymatic activity
2.3.2 分子生物学鉴定
以筛选菌株的基因组DNA为模板,经PCR扩增后,将所得的产物用1%琼脂糖凝胶进行DNA检测,得到单一、明亮、长度为1 600 bp左右的条带(图4)。对PCR扩增产物进行测序,将测得的序列在GenBank中进行BLAST核酸序列比对,下载同源性高的序列,通过MEGA7.0软件进行同源性分析,并使用软件中的Neighbor-Joining(N-J)法构建系统发育树(图5),分支点数值是基于N-J法自展1 000 次后的自展值(≥50%)。结合形态学结果将CS1.11鉴定为贝莱斯芽孢杆菌(B. velezensis)、CS1.13鉴定为甲基营养型芽孢杆菌(B. methylotrophicus)、CS1.17鉴定为枯草芽孢杆菌(B. subtilis)。枯草芽孢杆菌是传统发酵食品中常见微生物,以产酶种类丰富及较好的酶活性对发酵食品风味做出贡献;贝莱斯芽孢杆菌和甲基营养型芽孢杆菌近年来也在传统发酵食品的发酵过程中被分离和鉴定,有报道其对发酵食品的品质有改善作用[6-7]。菌株CS1.11、CS1.13和CS1.17的培养及预备发酵实验中发现其能产生令人愉悦的酱香,且未发现其在发酵中产生变质等不良影响,因此,对这3 株菌进一步开展酱醪发酵研究,考察其对发酵的影响。3 株芽孢杆菌的16S rRNA基因序列已上传至GenBank数据库中,并获取登录号(CS1.11:MN865798.1;CS1.13:MN865799.1;CS1.17:MN865800.1)。

图 5 基于16S rRNA基因序列系统发育树Fig. 5 Phylogenetic tree based on 16S rRNA sequence
2.4 添加芽孢杆菌促酱醪发酵研究
2.4.1 添加芽孢杆菌促酱醪发酵过程中理化指标的变化
以本实验室筛选并已报道对酱香有促进作用的枯草芽孢杆菌CS1.03[23]为参照菌,采用与目前酱油发酵一致的原料,在不添加米曲霉的情况下,单独对贝莱斯芽孢杆菌CS1.11、甲基营养型芽孢杆菌CS1.13和枯草芽孢杆菌CS1.17及CS1.03进行制曲及盐卤发酵,研究其在酱醪发酵中的作用,测定发酵过程中压榨酱油的理化指标,其结果见图6。酱油中的氨态氮主要是由蛋白酶水解原料中的蛋白质而产生的,氨态氮含量能够显示酿造酱油的呈味能力,是国标中酿造酱油分级的重要指标[24]。以蒸煮豆粕和炒麦为原料添加芽孢杆菌制曲72 h,水解蛋白质、淀粉等原料产生氨基酸、葡萄糖,为后期酱醪发酵提供充足养分,加入盐水进行盐卤发酵,发酵第0天,酱油中氨态氮含量大小为CS1.13>CS1.17>CS1.11,与上述菌株产蛋白酶活性大小保持一致,说明蛋白酶活性高的菌株在盐卤发酵初期能水解蛋白质获得较高的氨态氮含量;随着发酵时间的延长,3 株实验菌与对照菌样品氨态氮含量均逐步升高,说明芽孢杆菌分泌的蛋白酶在较高盐质量浓度的酱醪发酵体系中能保持良好的酶活性,继续分解蛋白质获得氨基酸;发酵第28天,添加CS1.13发酵酱油中氨态氮质量浓度最高,为5.12 g/L,较对照菌CS1.03的发酵酱油提升了27.60%,在无米曲霉的酱醪发酵体系中,3 株实验菌与对照菌发酵的酱油氨态氮含量均达到三级酱油标准(氨态氮≥4 g/L)。可以说,所筛选的芽孢杆菌因其较好的蛋白降解能力而有利于提高酱醪中氨态氮的含量。还原糖对酱油的色、香、味、体均起着重要作用,不仅能为酱油提供甜味,还是美拉德反应的主要反应物。酱油发酵过程中还原糖含量的变化是原料中淀粉降解和还原糖消耗平衡的结果[25]。发酵第7天,3 株菌中CS1.11还原糖质量浓度最高,为27.20 g/L,略高于CS1.03;在发酵初期,CS1.11和CS1.03发酵酱油中还原糖质量浓度呈上升趋势,说明还原糖的生成速率大于消耗速率;而淀粉酶活性较弱的CS1.13和CS1.17对还原糖含量影响不大,其发酵过程中还原糖质量浓度变化也不明显,分析原因应为制曲结束后加入的盐水使较弱的淀粉酶活性进一步受到了抑制。微生物通过代谢糖类生成有机酸,能给酱油带来爽口的感觉,但总酸含量过高的酱油很有可能已经变质[15]。对比产酸能力强的乳酸菌[26],芽孢杆菌对酱油中总酸影响很小。3 株实验菌发酵第28天总酸最高,为8.55 g/L,比对照菌CS1.03高出3.66 g/L,但均未超过国标限定值(总酸≤25 g/L),不会影响酱油质量。结合嗅闻测试,发酵样品均未出现变质气味,因此,3 种实验菌不是酱油酿造污染菌,且对酱油质量指标无不良影响。
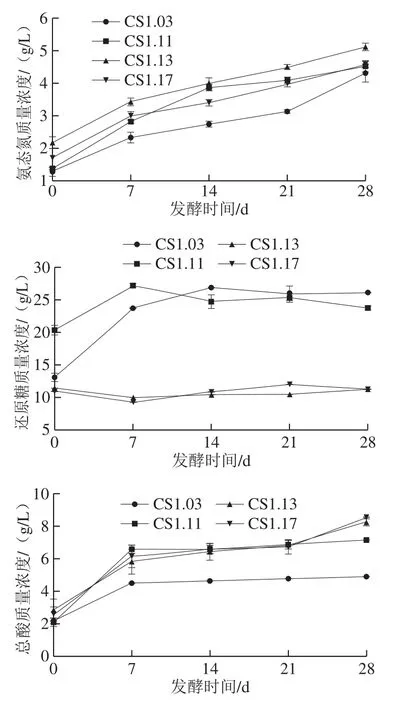
图 6 酱醪发酵过程中理化指标的变化Fig. 6 Changes in physicochemical indexes during moromi fermentation
2.4.2 添加芽孢杆菌促酱醪发酵过程中挥发性风味物质的变化
芽孢杆菌能水解豆类等原料中的蛋白质、淀粉并产生吡嗪类、醇类、酮类、酚类等风味物质,有助于酱香风味的形成[27]。分析3 株实验菌及对照菌CS1.03在上述发酵28 d所得酱油的挥发性风味物质分析发现,其挥发性风味物质主要包括吡嗪类、醇类、酮类、酸类,这些物质在市售酱油中均被检出。对3 株实验菌及对照菌CS1.03所发酵的酱油检出次数较多和含量较高的16 种挥发性风味物质进行分析,如图7所示,发现吡嗪类物质、乙偶姻和2,3-丁二醇是添加3 株实验菌及对照菌CS1.03发酵酱油的主体风味物质。吡嗪类物质是酱香型白酒典型的风味物质,具有烘烤香气,乙偶姻具有牛奶香,2,3-丁二醇具有水果香,这些物质能赋予酱油更加丰富的风味[28]。乙偶姻和2,3-丁二醇在2,3-丁二醇脱氢酶作用下可以相互转换,发酵体系中的乙偶姻和氨转化生成四甲基吡嗪,这3 类物质的含量在芽孢杆菌代谢过程中相互促进、彼此影响[29]。比较不同菌株间的产风味特性发现,在添加CS1.11发酵的酱油中检测到5 种吡嗪类物质(2,3,5,6-四甲基吡嗪、2,5-二甲基吡嗪、2,3,5-三甲基吡嗪、2-乙基-3,5,6-三甲基吡嗪、3-乙基-2,5-二甲基吡嗪),且含量高于其他菌株发酵的酱油,CS1.11发酵酱油中吡嗪类物质含量最高时达到5.47 mg/kg,而吡嗪类物质生物合成的前体乙偶姻含量低,说明CS1.11的代谢途径中能利用乙偶姻有效合成吡嗪类物质;在添加CS1.13发酵的酱油中检测出2,3-丁二醇含量最高,为5.33 mg/kg,说明CS1.13的优势是合成2,3-丁二醇;在添加CS1.17发酵的酱油中检测出乙偶姻含量最高,为5.72 mg/kg,说明CS1.13最具合成乙偶姻的优势;在添加对照菌CS1.03发酵的酱油中吡嗪类物质含量比3 株实验菌小,但也是其发酵优势风味物质,除此之外,其发酵酱油中4-乙烯基愈创木酚含量最高,为0.12 mg/kg,明显高于其他样品,说明对照菌CS1.03有别于3 株实验菌的优势是合成4-乙烯基愈创木酚。此外,在添加CS1.11、CS1.13、CS1.17发酵酱油中还检测出异戊酸、异丁酸和2-甲基丁酸,而添加CS1.03发酵的酱油中均未检测到,这与理化指标中总酸的测定结果相符,说明CS1.03产酸能力较弱。

图 7 酱醪发酵过程中主要挥发性风味物质分析Fig. 7 Analysis of main volatile flavor substances in moromi during its fermentation process
3 结 论
采用牛津杯法从高盐稀态发酵酱醪中筛选出3 株有促进酱醪发酵潜力的芽孢杆菌CS1.11、CS1.13、CS1.17,鉴定为贝莱斯芽孢杆菌(B. velezensis)、甲基营养型芽孢杆菌(B. methylotrophicus)、枯草芽孢杆菌(B.subtilis);以枯草芽孢杆菌CS1.03为参照,分别将3 株实验菌与对照菌CS1.03单独进行制曲后盐卤发酵,发现CS1.13发酵酱油氨态氮含量最高,为5.12 g/L,较CS1.03提升了27.60%,有促进酱醪中氨态氮形成的作用;CS1.11发酵酱油还原糖质量浓度最高,为27.20 g/L,略高于CS1.03;此外3 株所筛选的实验菌对酱油总酸含量影响不大,不是酱油酿造污染菌[15]。
对发酵过程中酱油的挥发性风味物质分析发现,检出物质主要包括吡嗪类、醇类、酮类、酸类,其中吡嗪类物质及其前体乙偶姻和2,3-丁二醇是添加3 株实验菌及对照菌CS1.03发酵的特征风味物质,与酱香型白酒大曲中芽孢杆菌发酵所产生的主要风味物质一致。四甲基吡嗪,又叫川芎嗪,具有烘烤、花生、榛子和可可香气,具有扩张血管,改善微循环及抑制血小板积聚作用,是白酒中的健康因子以及主要功能性成分之一,也是中药川芎治疗心脑血管疾病的有效成分之一,提升吡嗪类物质在酱油中的含量不仅能丰富酱油的风味,还能赋予酱油健康及保健功能[17,30]。此外,分析四甲基吡嗪的生物合成途径后发现,乙偶姻是糖代谢的产物,乙偶姻和2,3-丁二醇可以相互转换,乙偶姻和氨转化生成四甲基吡嗪,它们共同存在一条代谢途径中。SPME-GC-MS定性及定量分析结果显示3 株实验菌及对照菌由乙偶姻代谢合成吡嗪类物质的途径活跃,其发酵酱油均形成了典型的酱香风味,但其优势特征风味物质还存在一定的差异,这可能是与芽孢杆菌代谢过程中相关酶的活性及物质代谢方向有关,后期可对所筛选的3 株芽孢杆菌进行基因组学和代谢组学研究,探索风味物质形成关键基因及机制,为充分利用芽孢杆菌酿造相关基因及种质资源,提升酱油等发酵食品的风味及品质提供一条新思路。
