山羊乳-FOS/GOS库德毕赤酵母DS8-1微胶囊的制备及体外评价
2021-03-31高云云李王强李宝坤卢士玲蒋彩虹王庆玲李宇辉
刘 月,高云云,李 珊,李王强,李宝坤,*,卢士玲,蒋彩虹,王庆玲,董 娟,李宇辉
(1.石河子大学食品学院,新疆 石河子 832003;2.新疆农垦科学院农产品加工研究所,新疆 石河子 832000)
益生菌被定义为足量摄入时能够对宿主的健康带来益处的活的微生物,因此在食用时产品中的益生菌最低含量至少为106CFU/mL或106CFU/g[1]。益生菌主要包括乳酸杆菌和双歧杆菌,而某些酵母菌如酿酒酵母、布拉迪酵母、马克思克鲁维酵母和库德毕赤酵母也具有潜在的益生特性[2-3]。酵母菌对病原微生物具有较强的抵抗力,较强的抗氧化能力以及对抗生素的不敏感性,可用于治疗由抗生素引起的腹泻[4-5]。研究表明,使用布拉迪酵母可能影响肥胖和II型糖尿病小鼠的肠道菌群,并减轻体质量,以及治疗肝脂肪变性和全身性炎症的发生[6]。据报道,库德毕赤酵母可以提高大鼠模型的血浆抗氧化活性水平并降低血清脂质水平[7]。但在发酵、分离、贮藏和食用过程中,菌株活力的降低不可避免地会影响其对功能性食品的实际功效。当菌株处于胃肠道条件或其他不利环境中时,在胃液中低pH值诱导细胞壁的组成和结构发生变化(例如,酵母菌细胞壁在酸性条件下几丁质的含量降低),对细胞壁的破坏可能暴露出细胞膜,从而导致细胞膨压的降低,可能引起细胞裂解,降低细胞活力[8-9];在肠液中胆盐(特别是胆酸)使细胞产生形态变化,引起细胞肿胀和塌陷,影响菌株的生长[10]。因此,维持菌株的活力对于其对宿主发挥有益作用至关重要。
近年来,包埋法被认为是提高微生物对不利环境抵抗力的有效方法之一,使用藻酸盐包埋微生物的方法简单、经济且不需要加热,因此对微生物的损伤较小[11]。然而,通过离子凝胶法形成的藻酸盐颗粒表面有较多的孔隙,不能有效地保护微生物免受不利环境的影响[12]。使用不同的材料包埋益生菌,或者使用可食用基质对微胶囊进行包衣可以提高菌株的稳定性,从而在微胶囊解崩前保护菌株的活性[13]。因此,益生元[14]和乳制品[15]等多种材料可作为藻酸盐微胶囊的保护性包埋材料。研究表明,使用益生菌和益生元(称为“合生元”食品)的组合开发功能性食品可以有效地调节血压,降低血清胆固醇水平以及改善动物模型的消化能力[16]。益生元包括低聚果糖(fructooligosaccharides,FOS)、菊粉、低聚半乳糖(galactooligosaccharides,GOS)、异麦芽寡糖以及多糖类(例如抗性和改性淀粉)等,可以选择性地刺激益生菌在胃肠道中的生长和活性[17]。据报道,低聚糖与藻酸盐结合使用可以改善微胶囊的抗性[18-19]。低聚糖(不高于3%)与藻酸盐可能通过氢键在生物聚合体系中相互作用,低聚糖填充了微胶囊的凝胶网络的间隙空间,形成具有自由连接位点的键,减小凝胶的孔径,形成致密的相互连接结构,并通过增加微胶囊的强度和密度增强菌株对胃肠道的抵抗力[20]。Krasaekoopt等[18]报道在微胶囊中加入GOS为益生菌提供了更好的保护作用,不仅增强微生物在模拟消化系统中的活性,还在贮藏期间促进酸奶和果汁中微胶囊化益生菌的生长。研究表明,将FOS添加至微胶囊基质中,有助于在模拟胃肠道期间更好的保护并控制菌株的递送,并提高益生菌在酸奶中的生存能力[19]。
此外,微胶囊与具有乳化作用的其他材料的组合可进一步增强包埋微生物的稳定性。山羊乳由于其良好的特性(例如合适的pH值,良好的缓冲能力和高营养成分),被认为是开发多种新型产品(例如微胶囊)的绝佳基质。Ranadheera等[21]报道使用山羊乳制品作为益生菌的载体基质可能会影响菌株在胃肠道的功能特性,因为这种产品在消化过程中可作为微生物的保护性基质。羊乳中的蛋白质由70%酪蛋白、25%乳清蛋白和5%脂肪球膜蛋白组成,这3 种蛋白质已被用作微胶囊的载体[22-23]。乳蛋白(尤其是酪蛋白和乳清蛋白)具有双亲结构和良好的表面特性,可促进界面处的吸附并有助于稳定乳剂。这些蛋白质与其他聚合物结合使用时,由于其结构、柔韧性和聚集状态,可增加微胶囊表面的稳定性[24]。酪蛋白与乳清蛋白可能具有协同作用,Burgain等[25]报道结合使用酪蛋白和乳清蛋白包埋鼠李糖乳杆菌比单独使用其中一种蛋白对菌株的保护性和稳定性更高。此外,Clark等[26]指出,山羊乳脂肪球的最大比例直径小于4 μm,而牛乳的脂肪球直径大于4 μm。山羊乳中由于缺乏凝集素使乳中的脂肪不会形成聚集体,而牛乳中的凝集素导致脂肪小球的聚集。据报道,山羊乳中含有酪蛋白的胶体颗粒比牛乳小[27]。因此,当使用山羊乳对藻酸盐微胶囊进行包衣时,其通过对藻酸盐的改性使微胶囊具有更均匀和致密的表面形态,防止干燥后微胶囊表面乳粉的聚结,且乳蛋白与藻酸盐相互作用使微胶囊表面的孔隙率减少,降低了有害的环境因素对微生物的影响,增加了微胶囊的保护作用。Prasanna 等[15]报道使用山羊乳与藻酸盐进行包埋可以提高双歧杆菌在不利环境下的存活率。研究表明,使用藻酸盐-山羊乳-菊粉包埋双歧杆菌可在模拟胃肠道条件(simulated gastro intestinal digestion,SGID)下和发酵山羊乳酸奶过程中提高菌株的活性[28]。
库德毕赤酵母(Pichia kudriavzevii)又称东方伊萨酵母(Issatchenkia orientalis)和克柔念珠菌(Candida krusei),在自然界广泛分布(例如土壤、水果和各种食物),并且能够从自然发酵的食品中分离得到菌株[29]。实验室前期从新疆塔城地区传统乳制品酸驼乳中分离得到一株具有潜在益生特性的库德毕赤酵母DS8-1[30],菌株表现出对于模拟肠液(simulated intestinal fluid,SIF )较好的耐受性、自聚能力和疏水性,并且对α-淀粉酶和α-葡萄糖苷酶具有一定的抑制能力。但库德毕赤酵母DS8-1在模拟胃液(simulated gastric fluid,SGF)中不具有良好的稳定性,Greppi等[31]从发酵谷物中分离得到54 株库德毕赤酵母,其中69%的菌株活力在pH 2的条件下能够被不同程度的抑制。因此需要对菌株进行保护以提高酵母菌对胃肠道环境的抗性。据报道,使用壳聚糖外包衣的藻酸盐微胶囊包埋具有潜在益生特性的酵母菌(巴氏毕赤酵母、解脂耶氏酵母、异常威克汉姆酵母)和酿酒酵母,能够提高酵母菌在模拟消化液中的活性[32]。Kim等[33]通过藻酸盐包埋并使用保护剂(10%的脱脂乳和10%不同糖溶液)浸泡有助于保护库德毕赤酵母免受环境影响。研究表明,加入益生元能够提高布拉迪酵母菌微胶囊在贮藏过程中细胞的活力[34]。
为了探究山羊乳-FOS/GOS-藻酸盐微胶囊对库德毕赤酵母的保护作用,以及在实际应用中的价值,制备了使用羊乳外包衣并添加FOS/GOS和藻酸盐复合凝胶包埋酵母菌,并研究冻干微胶囊暴露于模拟胃肠液以及在不同温度贮藏过程中对酵母菌的保护作用,为新型具有潜在益生特性微胶囊的研发和体外评估提供参考与指导。
1 材料与方法
1.1 材料与试剂
具有潜在益生特性的库德毕赤酵母DS8-1(GenBank登录号为MT157508)为实验室前期从新疆塔城地区传统乳制品酸驼乳中分离得到,菌株的代谢产物具有α-淀粉酶和α-葡萄糖苷酶抑制活性,被用作本实验的目标菌株。实验开始前将酵母菌活化3 次,后按4%(V/V)接种量接入YPD肉汤中,于28 ℃恒温培养24 h,用于后续实验。
液体酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD)和YPD琼脂培养基青岛海博生物技术有限公司;海藻酸钠 天津市福晨化学试剂厂;山羊乳 山东阳春羊奶乳业有限公司;FOS、GOS、菊糖、乳果糖、α-淀粉酶(3 700 U/g)、α-葡萄糖苷酶(360 000 U/g)和阿卡波糖 北京索莱宝科技有限公司;低聚异麦芽糖 上海麦克林生化科技有限公司;对硝基苯基-β-D-吡喃半乳糖苷(p-nitrophenylα-D-glucopyranoside,PNPG) 上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
DNP-9272电热恒温培养箱 上海精宏实验设备公司;5417R高速冷冻离心机 德国Eppendorf公司;立式自动电热压力蒸汽灭菌锅 上海申安医疗器械厂;EON多功能酶标仪 美国BIOTEK仪器有限公司;S-4800扫描电子显微镜(scanning electron microscope,SEM) 日本日立株式会社; VERTEX 70傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪德国Bruker公司。
1.3 方法
1.3.1 益生元存在下酵母菌生长分析
基于Kuerman等[35]方法并稍作修改。将培养24 h后的酵母菌以1%接入补充FOS、GOS、菊粉、乳果糖、低聚异麦芽糖和葡萄糖的无碳源YPD肉汤中,其中补充碳源的终质量浓度为10 g/L。无补充碳源添加的YPD肉汤用作菌株生长的阴性对照。将含有1%酵母菌的培养物在37 ℃孵育48 h,每4 h取出菌悬液置于600 nm波长处测其吸光度。
1.3.2 酵母菌微胶囊的制备
基于Wang Lijun等[13]的方法制备微胶囊。将培养24 h后的酵母菌重悬于20 g/L海藻酸钠溶液中,并在其中分别加入10 g/L FOS和GOS。将混合物使用磁力搅拌器充分混合后,通过针头规格为0.45 mm的无菌注射器滴加到0.1 mol/L无菌CaCl2溶液中以制备酵母菌胶囊。固定30 min后,通过使用无菌滤纸(孔径80~120 μm)和三角漏斗过滤收集微胶囊,使用1 g/L无菌蛋白胨溶液洗涤2 次,浸入山羊乳中并轻轻摇动。使用无菌生理盐水将羊乳涂层的酵母菌胶囊洗涤3 次。于-80 ℃预冻12 h,并真空冷冻干燥12 h得到游离库德毕赤酵母(FC)、干燥的藻酸盐(SA)包埋库德毕赤酵母、干燥的藻酸盐-羊乳(SAM)包埋库德毕赤酵母、干燥的FOS-藻酸盐-羊乳(SAMF)包埋库德毕赤酵酵母和干燥的GOS-藻酸盐-羊乳(SAMG)包埋库德毕赤酵母。
1.3.3 微胶囊的表征
1.3.3.1 包埋率
参考Wang Lijun等[13]的方法,并稍作修改。分别取4 种微胶囊各1 g加入至9 mL 0.1 mol/L无菌磷酸盐缓冲液(pH 7.0)中,使用摇床在200 r/min下振摇150 min。取菌悬液用8.5 g/L无菌生理盐水梯度稀释后涂布于YPD琼脂上,28 ℃培养24 h后进行菌落计数。
微胶囊的包埋率按照式(1)计算[36]。

式中:N为包埋于微胶囊中的活菌总数;N0为制备微胶囊时浓缩菌液中的活菌总数。
1.3.3.2 SEM分析
分别取4 种酵母菌微胶囊置于玻璃皿内,用1%的四氧化锇气体固定,使用双面胶将其粘在样品台上,在真空镀膜机中喷金,然后用扫描电镜观察微胶囊的表观形貌(加速电压15 kV)。
1.3.3.3 FTIR分析
分别取4 种微胶囊以及各种包埋组分分别与干燥的KBr进行混合,研磨、压片。使用FTIR仪以2 cm-1的分辨率在4 000~400 cm-1的范围内扫描样品。
1.3.4 酵母菌微胶囊在SGF中的存活情况
SGF:参考Rodriguez等[37]的方法,在9 g/L NaCl溶液中加入3 g/L(3 000~3 500 NFU/g)胃蛋白酶,12 mol/L HCl溶液调节pH值至2.0。取4 种包埋酵母菌样品各0.1 g或0.01 g游离酵母菌,分别置于10 mL SGF中,37 ℃培养3 h。在0、1、2、3 h时,收集微胶囊或菌液和胃液的混合物1 mL,加入至9 mL 0.1 mol/L无菌磷酸盐缓冲液(pH 7.0)中,200 r/min摇动150 min。取菌悬液用8.5 g/L无菌生理盐水梯度稀释后涂布于YPD琼脂上,28 ℃培养24 h后进行菌落计数。以第0小时的活菌数为对照,根据式(2)计算菌株存活率:

1.3.5 酵母菌微胶囊在SGID下连续培养后的存活及体外释放
SIF(pH 8.0)[37]:使用3.0 g/L牛胆盐,6.5 g/L NaCl,0.835 g/L KCl,0.22 g/L CaCl2,1.386 g/L NaHCO3和1 g/L(250 NFU/g)胰蛋白酶制成。取4 种包埋酵母菌样品各0.1 g,分别置于10 mL SGF中充分混合,37 ℃培养2 h。在第0、1、2小时,收集微胶囊或菌液和胃液的混合物,按照1.3.4节的方法进行计数。取2 h后SGF中的样品,使用8.5 g/L无菌生理盐水洗涤2 次,置于10 mL SIF中充分混合,37 ℃培养4 h。在第1、2、3、4小时取1 mL释放介质,使用8.5 g/L无菌生理盐水梯度稀释后涂布于YPD琼脂上,28 ℃培养24 h后进行菌落计数。
1.3.6 酵母菌微胶囊在SGID条件下的生物活性
参考文献[38]方法稍作修改。取4 种包埋酵母菌样品各0.1 g或0.01 g游离酵母菌,分别悬浮在10 mL SGF中,37 ℃孵育2 h。收集样品,置于10 mL SIF中,37 ℃孵育2 h,4 ℃、5 000×g离心10 min,使用无菌生理盐冲洗3 次,并重悬于10 g/L无菌蛋白水溶液中。将细胞悬浮液在37 ℃进一步孵育6 h以产生代谢产物,冰浴中进行超声破碎30 min,10 000×g离心15 min除去细胞碎片,收集上清液保存在-20 ℃以进行生物活性的测定。
1.3.6.1α-淀粉酶活性抑制活性的测定
参考Xiao Xiang等[39]的方法,取500 μLα-淀粉酶(5 U/mL)与100 μL样品上清液混合,在37 ℃孵育10 min。加入500 μL 1 g/100 mL可溶性淀粉引发反应, 37 ℃孵育10 min后加入500 μL二硝基水杨酸显色剂终止反应,沸水浴5 min并冷却至室温。将反应物混合物用磷酸盐缓冲液稀释至5 mL并在540 nm波长测定其吸光度,3 次平行实验。没有样品的反应混合物用作对照,阿卡波糖用作阳性对照。计算公式如下:
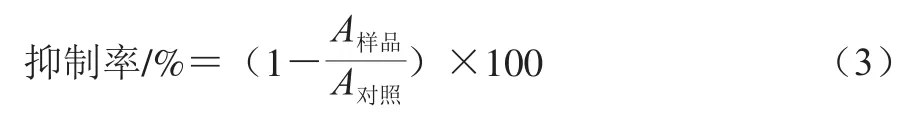
1.3.6.2α-葡萄糖苷酶抑制活性的测定
参考Xiao Xiang等[39]的方法,取100 μL样品上清液与10 μLα-葡萄糖苷酶(5.7 U/mL)混合,在37 ℃孵育10 min。加入100 μL 6 mmol/L PNPG引发反应,37 ℃孵育20 min后加入1 mL 1 mol/L Na2CO3溶液终止反应。并在400 nm波长测定其吸光度,3 次平行实验。没有样品的反应混合物用作对照,阿卡波糖用作阳性对照。计算公式如下:

1.3.7 酵母菌微胶囊在不同温度下的贮藏稳定性
该方法基于Song Huiyi等[40],并稍作修改。将冷冻干燥后的样品于-20 、4 、25 ℃贮藏30 d。分别于第0、5、10、15、20、25、30天取出样品,按1.3.3.1节方法进行计数。
1.4 数据统计分析
实验数据处理采用SPSS 25.0软件进行显著性分析,所有实验一式三份进行,结果以表示。显著性(P<0.05)分析采用Duncan检验;采用Origin 8.5软件进行绘图。
2 结果与分析
2.1 益生元对库德毕赤酵母菌生物量的影响
益生元能够在生产和贮藏过程中提高益生菌的生存能力[41]。为了测定库德毕赤酵母对益生元的利用能力,使用益生元(菊糖、GOS、低聚异麦芽糖、FOS和乳果糖)和非益生元(葡萄糖)进行了体外发酵实验。如图1所示,在培养48 h后菌株的生物量表现出不同程度的增加。与阴性对照相比,添加GOS、FOS和葡萄糖均能够显著促进库德毕赤酵母的生长(P<0.05)。库德毕赤酵母在FOS和GOS的作用下生长动力学曲线相似,发酵48 h后OD600nm的吸光度比0 h分别增加了28.86 倍和28.91 倍,显著高于葡萄糖(P<0.05)。图1表示菊粉、低聚异麦芽糖和乳果糖不能促进酵母菌的生长,说明库德毕赤酵母对不同益生元表现出选择性代谢,可能与菌株的代谢特性和菌株种类有关[42]。因此,选择添加FOS和GOS进行酵母菌微胶囊的制备。
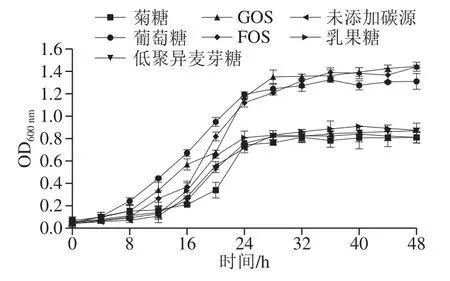
图 1 库德毕赤酵母DS8-1在补充益生元的YPD肉汤中生长Fig. 1 Pichia kudriavzevii DS8-1 growth curves in YPD broth supplemented with prebiotics
2.2 酵母菌微胶囊包埋的活菌数及包埋率
如表1所示,4 种微胶囊的包埋率为(86.11±0.24)%~(89.27±0.71)%,包埋的活菌数为7.77~8.07(lg(CFU/g))。其中,SA微胶囊和SAM微胶囊的包埋率分别为(86.11±0.24)%和(86.24±0.59)%,说明使用羊乳包衣对微胶囊的包埋率影响较小,可能在包衣的过程中使用温和的条件降低了细胞活力的损失。在添加FOS和GOS后,酵母菌微胶囊包埋的活菌数达到了8(lg(CFU/g))以上,显著高于其他微胶囊(P<0.05)。该结果与Liao Ning等[43]添加寡糖的微胶囊结果相似,可能是由于添加了FOS和GOS增加了微胶囊的黏度以及藻酸盐网络结构的稳定性,从而减少了细胞的损失。

表 1 微胶囊中包埋的活菌数Table 1 Numbers of viable yeast cells in suspensions and microcapsules lg(CFU/g)
2.3 酵母菌微胶囊SEM
SEM分析可以很好的了解微胶囊的均匀性和微观结构。如图2所示,4 种微胶囊的直径相似,平均大小为1.0~1.5 mm,说明添加益生元和使用羊乳包衣对微胶囊的尺寸影响较小。实验制备的酵母菌微胶囊的大小在5 μm~4 mm的可接受范围内,可添加至食品中使用[44]。
如图2所示,低质量分数藻酸盐(低于5%)经过制备产生球形微胶囊,在冷冻干燥后收缩,由于其在胶囊表面产生低浓度的羧基,在干燥过程中会导致结构的部分坍塌[45]。4 种酵母菌微胶囊在冷冻干燥后均具有不规则的形状,包括一些凸起和沟壑,内部结构粗糙且带有褶皱和空洞[46]。SA微胶囊表面较为粗糙,存在明显的裂缝(图2A3),而使用羊乳包衣的微胶囊表面较为连续和均匀(图2B3、C3、D3),说明藻酸盐、羊乳和FOS/GOS具有一定的相容性。羊乳包衣覆盖了残留在微胶囊表面的菌株,因此当暴露于不利环境时包衣可以提高酵母菌的生存能力[11,47]。

图 2 4 种不同微胶囊的SEM图Fig. 2 SEM images of four different microcapsules
2.4 酵母菌微胶囊FTIR结果分析
FTIR用于鉴定官能团并表征胶囊中各种成分之间的关 系[48]。如图3所示,由于—OH伸缩振动的存在,藻酸盐的FTIR光谱包括在3 419 cm-1处有显著吸收带,在1 033 cm-1处存在C—O—C伸缩振动,以及在1 612 cm-1和1 427 cm-1处为COO—的不对称和对称伸缩振动,这与之前研究结果相似[49]。羊乳中主要包括蛋白质、碳水化合物、脂质以及这些成分的混合物,其中在1 654 cm-1和1 544 cm-1左右的吸收峰分别为酰胺I带(C=O伸缩振动)和酰胺II带(—NH弯曲振动)与乳蛋白有关,乳糖和乳脂中由于—OH和甘油三酯的酯基—C=O的存在,分别在1 074 cm-1和1 745 cm-1处有显著吸收带,在形成SAM微胶囊后,SA微胶囊中对应的COO—的不对称伸缩振动移至较高波数,而羊乳中酰胺I带和—OH的吸收峰峰移至较低波数,表明藻酸盐的羧基可能通过分子间氢键与羊乳中蛋白质的酰胺I带和乳糖的羟基相互作用,这与之前的研究结果相似[50-51]。

图 3 4 种不同微胶囊的FTIR谱图Fig. 3 FTIR spectra of four different microcapsules
FOS和GOS的FTIR光谱在1 200~900、3 000~2 700 cm-1和900~600 cm-1区域有显著吸收带,在1 200~900 cm-1之间为C—C和C—O的伸缩振动以及C—O—H和C—O—C弯曲振动吸收峰[52]。在形成SAMF和SAMG微胶囊后,FOS和GOS在1 200~900 cm-1之间的吸收峰逐渐减少,移位或丢失。FOS和GOS是多羟基化合物,在1 641 cm-1和1 419 cm-1处COO—的不对称和对称伸缩振动分别向较低波数移动,表明在制备微胶囊的过程中FOS-藻酸盐-羊乳和GOS-藻酸盐-羊乳之间可能通过氢键相互作用而形成聚合物链[53]。由于酵母细胞壁的甲壳质中酰胺基R—NH—C—O—CH3的存在,在1 647 cm-1和1 548 cm-1处有显著吸收带。4 种酵母菌微胶囊的FTIR光谱在1 548 cm-1左右存在—NH弯曲振动吸收峰,这表示微胶囊中存在酵母细胞壁的酰胺基[54]。以上均可说明SA、SAM、SAMF和SAMG对酵母菌进行了有效的包埋。
2.5 酵母菌微胶囊在冷冻干燥后的存活能力
研究表明,在冷冻干燥过程中菌株的生理状态发生改变,导致活力降低[55]。如表1所示,使用羊乳包衣后的酵母菌均具有较高的存活能力,存活率均高于(92.15±0.90)%,显著高于未包衣酵母菌(存活率为(84.76±1.03)%)(P<0.05)。其中,SAMG微胶囊和SAMF微胶囊的菌株存活率分别为(95.16±0.82)%和(94.30±0.37)%,显著高于SAM微胶囊(92.15±0.90)%(P<0.05)。表明在微胶囊中添加FOS和GOS以及使用羊乳包衣能够提高冷冻干燥过程中微生物的活力。可能是碳水化合物(FOS/GOS)内含多个羟基,在冻干的过程中可替代部分水分子通过氢键与菌体细胞膜磷脂中的磷酸基团或菌体蛋白质的极性基团结合,降低了对细胞膜和蛋白质结构与功能的完整性的破坏[56],而FOS和GOS表现出不同的保护能力可能与它们与水结合的能力以及防止细胞内外冰晶形成的能力有关[57]。
2.6 SGF对库德毕赤酵母菌的影响
在胃液中较低的pH值环境下,胃蛋白酶可以分解微生物细胞膜中的蛋白质而降低益生菌的生存能力[58]。如图4所示,游离酵母菌的活力在孵育3 h后降低了45.69%,而SA和SAM微胶囊的活细胞数量分别降低了15.2%和11.88%,说明游离的酵母菌对低pH值环境较为敏感,而羊乳蛋白较高缓的冲能力以及胶囊表面低孔隙率能够减少外界环境对细胞的影响[13]。SAMF和SAMG微胶囊中的酵母菌在低pH环境下得到更好的保护作用,在孵育3 h后活细胞数分别降低了5.2%和10.48%,具有良好的耐胃酸效果。因此,添加FOS和GOS可以在酸性条件下增强微胶囊对库德毕赤酵母菌的保护作用,这可能是由于低聚糖FOS/GOS填充了藻酸盐微胶囊凝胶网络间隙,减小凝胶的孔径,增加了微胶囊的密度,导致胃液在胶囊内的渗透受到了限制,从而有效的降低了高酸度对酵母菌活力的影响[20]。
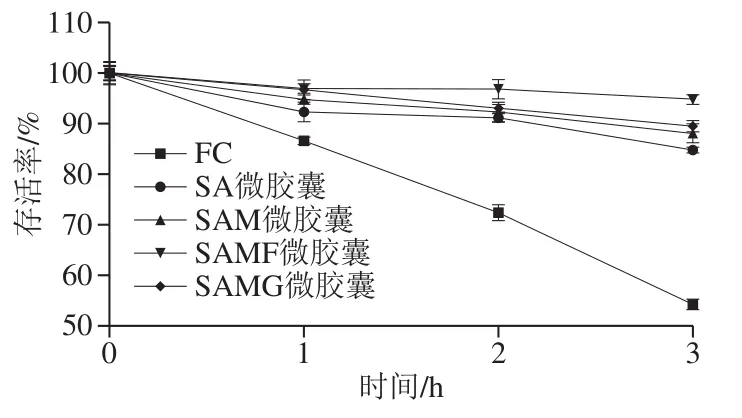
图 4 酵母菌微胶囊在SGF中菌株活力的变化Fig. 4 Changes in microencapsulated yeast viability in simulated gastric juice
2.7 酵母菌微胶囊在模拟胃肠液中连续培养后的活力与释放
如图5所示,在SGF中培养120 min后,4 种微胶囊中酵母菌扩散释放少于3(lg(CFU/g)),随后转移至SIF 30 min后,酵母菌的活力达到5(lg(CFU/g))以上。说明微胶囊壁材在酸性环境中较为稳定,而转移至弱碱环境时能够被解崩后导致菌株的释放,这是由于在pH值为8.0的SIF中,藻酸盐微胶囊中Ca2+与胆盐中的Na+之间发生离子交换,在较高pH值下会增加藻酸盐中羧基的离子化,且羧基之间的静电排斥作用会导致微胶囊解崩并加快细胞的释放速度[59]。如图6所示,在转移至肠液30 min后胰蛋白酶和胆盐能够不同程度的破坏4 种微胶囊的结构,SA微胶囊的结构严重坍塌,而其余3 种微胶囊的表面覆盖了羊乳包衣,由于羊乳对藻酸盐的改性使微胶囊的表面均匀致密,改性的壁材表面可以一定程度上减少胆盐对微胶囊的扩散,降低微胶囊解崩的速度,增加酵母菌的活力[15]。此外,库德毕赤酵母可以在转移至SIF 60 min内从微胶囊中完全释放出来,这与Wang Lijun等[13]的研究结果类似。4 种微胶囊中的菌株在模拟胃肠道的过程中均具有快速释放的特性,说明在摄入体内过程中菌株可能持续存在。可以看出,添加FOS和GOS共包埋的酵母菌微胶囊的活力均高于SAM微胶囊。其中,SAMF在4 h后的活力最高(活菌数为8.14(lg(CFU/g))),说明SAMF微胶囊在模拟消化道体系中对库德毕赤酵母菌酵母具有最佳保护作用。

图 5 酵母菌微胶囊在模拟胃肠液中的释放Fig. 5 Release of yeast microcapsules in simulated gastrointestinal fluid

图 6 从SGF转移至SIF 30 min时4 种酵母菌微胶囊的SEM图Fig. 6 SEM images of four yeast microcapsules pretreated with simulated gastric fluid after 30 min exposure to simulated intestinal fluid
2.8 酵母菌微胶囊在模拟消化培养后对α-淀粉酶和α-葡萄糖苷酶抑制活性的影响
α-淀粉酶和α-葡萄糖苷酶抑制实验是评估生物活性物质在体外降血糖活性的有效手段[60]。通常对这2 种酶的抑制活性可归因为生物活性肽(蛋白水解酶产生的小肽)和胞外多糖的生物活性(由微生物产生)[61]。如表2所示,与未经过SGID相比,游离酵母菌经过SGID后对α-淀粉酶和α-葡萄糖苷酶的抑制活性显著降低,抑制率分别降低了11.11%和17.09%(P<0.05)。这可能是由于胃肠道条件恶劣,导致细胞死亡并降低了菌株在宿主体内产生代谢物质的能力[62]。而包埋酵母菌经过SGID处理后对α-淀粉酶和α-葡萄糖苷酶的抑制活性分别为17.42%~22.51%和31.30%~40.13%,表明包埋对酵母菌在模拟胃肠道环境中具有保护作用,因此与游离酵母菌经过SGID后相比,对这2 种酶的抑制活性保持在较高的水平(P<0.05)。与SA微胶囊相比,SAM、SAMF和SAMG微胶囊中酵母菌对α-淀粉酶和α-葡萄糖苷酶的抑制活性显著升高(P<0.05),低于阳性对照阿卡波糖(75.63%和98.24%)这可能是由于在模拟消化培养的过程中,不同的蛋白酶(胃蛋白酶和胰蛋白酶)水解微胶囊表面的羊乳蛋白产生较短链长的生物活性肽,肽抑制酶可能的作用机制是它们能够通过酶活性位点上的疏水键相互作用[63]。Ahmad等[64]使用骆驼乳清蛋白和牛乳清蛋白包埋乳酸片球菌能够提高菌株对α-葡萄糖苷酶抑制活性,与本实验结果一致。并且益生元(FOS和GOS)和羊乳包衣中的乳糖可作为底物为酵母菌的生长和生物活性物质的产生提供碳源,羊乳蛋白在消化液中被消化,释放出有利于酵母菌生长的肽和氨基酸[64]。因此,对微胶囊使用羊乳包衣和添加FOS/GOS能够在模拟胃肠道中为酵母菌的活性以及菌株对代谢物的分解提供保护作用。
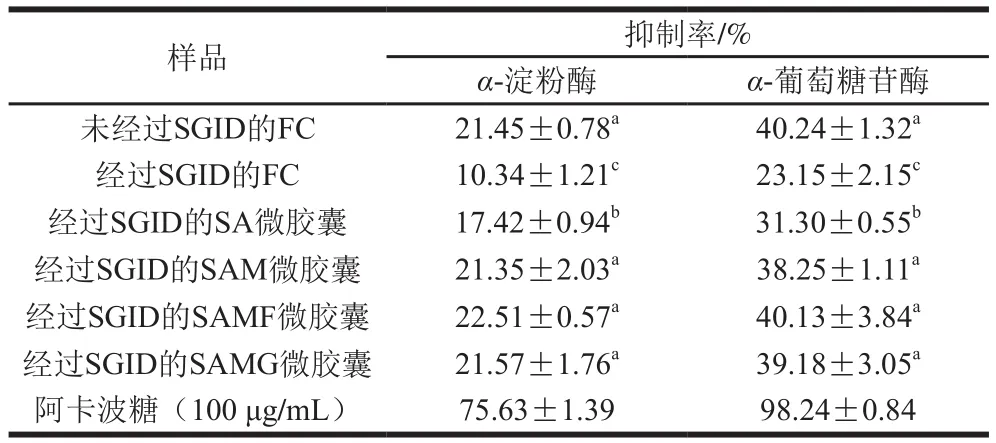
表 2 包埋对库德毕赤酵母菌生物活性的影响Table 2 Effect of microencapsulation on digestive enzyme inhibitory activity of P. kudriavzevii
2.9 酵母菌微胶囊的贮藏稳定性分析
冷冻干燥是保存益生菌产品为干燥粉末中的常用方法之一,其易于处理,贮藏和运输。但是,在贮藏过程中会有水蒸气、空气和有机小分子物质渗透进入这些产品中,从而影响细胞活力。如图7所示,包埋和游离酵母菌在3 种不同的温度(-20、4 ℃和25 ℃)的细胞活力随着贮藏时间的升高而呈现出不同程度的下降。在贮藏30 d后,游离酵母菌在-20、4 ℃和25 ℃的活菌数迅速减少,分别降低了2.86、2.92(lg(CFU/g))和3.64(lg(CFU/g)),而SA微胶囊中酵母菌分别降低了0.90、1.99(lg(CFU/g))和2.53(lg(CFU/g))。说明在酵母菌周围形成藻酸盐多糖对菌株提供了保护作用,因此不利的外界环境因素(例如氧气)需要穿过藻酸盐层才能影响菌株的活性。并且贮存温度能够影响酵母菌的稳定性,低温可以降低脂肪氧化等反应的速率,减少自由基的形成,而有利于维持细胞的活力[65]。因为当自由基扩散到细胞中时,可能会诱导细胞DNA受损,从而导致细胞死亡[66]。在-20 ℃贮藏30 d后,SA微胶囊中菌株活力为6.11(lg(CFU/g)),显著低于其他酵母菌微胶囊(P<0.05)。说明羊乳包衣在微胶囊的最外层,由于乳蛋白与藻酸盐相互作用致使微胶囊的外表面连续且均匀,可能减少冻干微胶囊的水分活度的增加,有助于维持酵母菌的活性[11]。而水分活度可能会影响微生物的生存能力,因为高水分活度时菌株保持代谢活性,低水分活度时菌株保持休眠状态[67]。这与Hugues-Ayala等[11]使用酪乳蛋白包衣的鼠李糖乳杆菌微胶囊贮藏的结果相似。可以看出,SAMG微胶囊和SAMG微胶囊在-20、4 ℃和25 ℃贮藏30 d后酵母菌的活力缓慢降低,菌株活力均在6(lg(CFU/g))以上,显著高于其他包埋酵母菌(P<0.05)。说明4 种酵母菌微胶囊的细胞活性之间的差异可能也与壁材的氧气渗透性有关,观察到SA微胶囊表面存在裂缝(图2A3),这可能有助于氧气通过胶囊扩散,导致细胞死亡。而SAMF微胶囊和SAMG微胶囊中FOS和GOS与藻酸盐之间的相互作用可以增加微胶囊的密度和结构稳定性,使用羊乳外包衣微胶囊获得了较为致密和连续的表面形态,在贮藏的过程中为酵母菌提供了保护性屏障,降低氧气向酵母菌细胞膜的扩散。因此,在包埋过程中添加GOS和FOS在3 种不同温度的贮藏期内均能良好的维持酵母菌的稳定性。
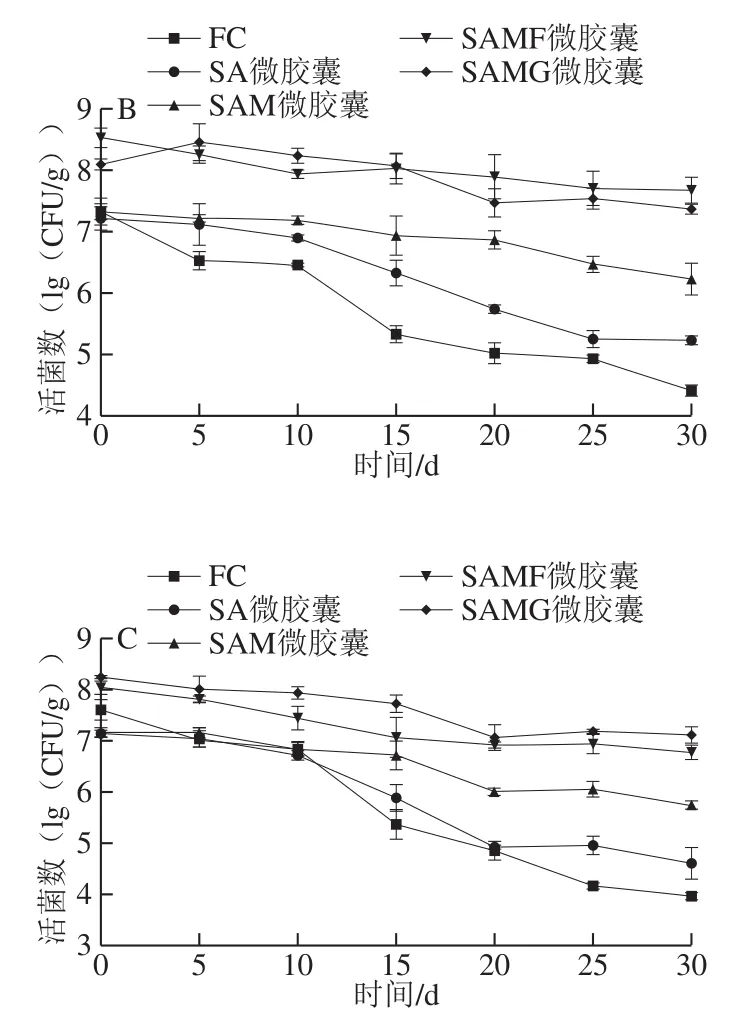
图 7 酵母菌微胶囊的在-20(A)、4 ℃(B)和25 ℃(C)条件下的贮藏稳定性Fig. 7 Storage stability of yeast microcapsules at −20 (A),4 (B) and 25 ℃ (C)
3 结 论
本实验以库德毕赤酵母DS8-1为研究对象,成功制备了具有潜在益生作用的羊乳-FOS/GOS-藻酸盐微胶囊,利用FTIR和SEM表征手段证明微胶囊的形成。当暴露于不利环境时,使用羊乳包衣和添加FOS/GOS可提高库德毕赤酵母的活力。微胶囊在SGF中较为稳定,在SIF中可以缓慢释放活细胞,且SAMF微胶囊比SAMG微胶囊的菌株具有更好的生存能力。而SAMG微胶囊比SAMF微胶囊对菌株提供了更好的贮藏稳定性。在SGID后微胶囊化可增强酵母菌对α-淀粉酶和α-葡萄糖苷酶的抑制作用。羊乳-FOS/GOS-藻酸盐微胶囊可以作为库德毕赤酵母的保护和递送载体,以期发挥其潜在的益生作用。
