重组Taxus chinensis苯丙氨酸变位酶性质表征及R-β-芳香丙氨酸合成
2021-03-31丰国强徐文亮李婉珍陶玉贵朱龙宝
丰国强,徐文亮,宋 平,李婉珍,陶玉贵,葛 飞,朱龙宝
(安徽工程大学生物与化学工程学院,安徽 芜湖 241000)
植物紫衫(Taxus chinensis)中苯丙氨酸变位酶(phenylalanine aminomutase fromTc,TcPAM)参与抗肿瘤药物紫杉醇的生物合成[1-2],TcPAM催化合成紫衫醇中重要的结构单元β-苯丙氨酸。β-苯丙氨酸是一些天然活性产物的重要结构单元[3-4],广泛应用于食品和医药等工业领域[5]。TcPAM能够催化α-芳香丙氨酸的异构化,使α-氨基变位至β位形成β-芳香丙氨酸[6-8],其化学反应式如图1所示。

图 1 TcPAM催化的异构反应Fig. 1 Isomerization catalyzed by phenylalanine aminomutase
目前制备β-苯丙氨酸主要依靠的是不对称化学合成方法[9],但是存在成本比较高、工艺相对复杂、原子利用率低、副产物多等不足,需要开发经济节约、绿色可持续的合成方法[10]。与化学方法相比利用酶转化法[11]生成β-苯丙氨酸,工艺相对简单,生产方法稳定,生产过程安全绿色,这种方法应用越来越广泛[12]。目前主要利用转氨酶催化合成[13],但是转氨酶要添加NADH、FADH2等外源辅助因子[14-15],导致生产工艺操作繁琐,很难实现大规模工业化生产[16]。为此,寻找不需要添加任何外源性辅因子的酶转化方法更具发展前景。PAM由于能以α-芳香丙氨酸为底物,一步催化合成β-苯丙氨酸[17-18],同时无需添加辅因子,操作简单,适合大规模的工业生产。
目前,已经成功克隆来源于原核生物Streptomyces maritimus[16]、Pantoea agglomerans[19]的pam基因,并成功实现异源高效表达,制备了工业应用的PAM。由于微生物来源的PAM催化α-苯丙氨酸生成的产物β-苯丙氨酸是S构型[20-21],而作为活性成分的前体物[22],往往需要R构型的β-苯丙氨酸,为此需要对PAM的基因进一步进行挖掘,表达出能够一步催化合成R构型β-苯丙氨酸的TcPAM。Chirpch[23]和Morley[24]等首先发现自然界中的氨基变位酶,Walker[6]和Steele[7]等克隆表达了来自真核生物T. chinensis的氨基变位酶。为了获得制备大量的工业用TcPAM,对其进行异源表达是一种常见的策略,其中由于大肠杆菌生长速度快,表达量高,遗传背景清楚,是生产工业用酶的首选宿主菌,但是TcPAM在大肠杆菌中进行异源表达时,容易形成无活性的包涵体,导致目前未实现利用基因工程技术手段生产重组的TcPAM。本研究首先化学合成TcPAM的基因(Tcpam),筛选合适的大肠杆菌表达载体,实现可溶具有活性的酶的高效表达,克服形成包涵体的缺陷,用于催化合成R-β-苯丙氨酸,并进行重组酶活力分析,旨在为后续工业上利用TcPAM催化合成R-β-芳香丙氨酸提供理论支持。
1 材料与方法
1.1 材料与试剂
大肠杆菌BL21(DE3)、大肠杆菌JM109为本实验室保存;克隆载体pMD18-T和表达载体pET28a(+)、pET32b(+)、pET22b(+) 美国Invitrogen公司;pET-sumo 艾礼生物科技(上海)有限公司;DNA聚合酶、DNA连接酶、限制性内切酶NotI和BamHI TaKaRa(宝)生物股份有限公司;引物、异丙基-β-D-硫代半乳糖苷(isopropy-β-D-thiogalactoside,IPTG)、氨苄霉素、卡那霉素、质粒抽提试剂盒、DNA胶回收试剂盒 生工生物工程(上海)股份有限公司;酶活力催化反应底物L-α-芳香丙氨酸、标准品β-芳香丙氨酸美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
聚合酶链式反应(polymerase chain reaction,PCR)基因扩增仪、GelDoc2000型凝胶成像系统美国Bio-Rad公司;VCX2500型超声波细胞破碎仪美国Sonics公司;AKTAprime蛋白纯化仪 美国GE Healthcare公司;高效液相色谱(high performance liquid chromatography,HPLC)仪、QP2010型气相色谱-质谱联用仪 日本岛津公司;Z326K型高速冷冻离心机德国Hermle公司。
1.3 方法
1.3.1 基因克隆与表达
根据NCBI提供的基因序列(AY724735.1),送生工生物工程(上海)股份有限公司合成Tcpam,在基因两端分别插入BamHI和NotI的酶切位点,将Tcpam插入克隆载体pMD18-T中,构建成pMD18-Tcpam。利用BamHI和NotI分别双酶切pMD18-Tcpam和表达载体pET28a(+)、pET32b(+)、pET-sumo以及pET22b(+),切胶回收目的基因Tcpam和载体pET28a(+)、pET32b(+)、pET-sumo以及pET22b(+),用T4 DNA连接酶将目的基因与载体pET28a(+)、pET32b(+)、pET-sumo以及pET22b(+)在16 ℃连接12 h,将连接产物转入感受态大肠杆菌JM109中,带有pET32b(+)和pET22b(+)的感受态细胞涂布到含有20 mg/L氨苄霉素的LB平板上,带有pET-sumo和pET28a(+)的感受态细胞涂布到含有卡50 mg/L卡那霉素的LB平板上,于37 ℃培养12~14 h,分别随机选取3 个阳性重组菌落,接种于含对应抗生素的LB液体培养基中培养10~12 h,提取质粒做双酶切验证,然后送生工生物工程(上海)股份有限公司测序确认基因序列,构建重组表达质粒分别命名为pET32b(+)-Tcpam、pET-sumo-Tcpam以及pET22b-Tcpam和pET28a-Tcpam。
1.3.2 重组菌的表达与分离纯化
将已经构建的pET32b(+)-Tcpam、pET-sumo-Tcpam、pET22b-Tcpam和pET28a-Tcpam分别转入到感受态大肠杆菌BL21中,涂布到LB平板上培养12 h,分别挑取单菌落接到5 mL的LB培养基中,37 ℃培养12 h,取2 mL培养液至200 mL的LB培养基中,于37 ℃培养至OD600nm为0.6,加入终浓度为0.4 mmol/L的IPTG,于16 ℃、200 r/min条件下诱导表达20 h,离心收集菌体,超声破碎(功率300 W,工作1 s,间隔2 s,共12 min),4 ℃、8 000 r/min离心5 min,收集上层清液,十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electroporesis,SDS-PAGE)检测酶蛋白表达情况,采用His-TrapTM/FF亲和层析柱进行分离纯化,制备电泳纯的重组酶。
1.3.3 酶活力检测
将适量的重组酶加入至800 μL缓冲液(25 mmol/L Tris-HCl,pH 9)中,然后加入200 µL 25 mmol/L底物L-α-苯丙氨酸混合,反应体积为1 mL。于30 ℃反应1 h后100 ℃加热5 min终止反应。用C18反相色谱柱(150 mm×4.6 mm,5 μm)检测产物,流动相为甲醇(0~15 min,甲醇体积分数由10%升高到40%),进样20 μL,柱温30 ℃,流速1 mL/min,检测波长260 nm。酶活力单位的定义:30 ℃条件下每分钟生成1 μgβ-苯丙氨酸需要的酶量为1 个酶活力单位(U)。
1.3.4 重组酶的酶学性质表征
1.3.4.1 温度对酶活力的影响
在pH 9、10~45 ℃测定酶活力,确定重组酶的最佳反应温度。分别将酶在40、45、50 ℃热处理0.5~3 h后在30 ℃测定酶的剩余活力,未热处理酶活力为100%,研究酶的热稳定性。
1.3.4.2 pH值对酶活力的影响
在30 ℃条件下,分别在不同pH值缓冲体系(pH 5~7,25 mmol/L磷酸缓冲液(phosphate buffered solution,PBS);pH 7~9,25 mmol/L Tris-HCl缓冲液;pH 9~10,25 mmol/L碳酸钠缓冲液(sodium carbonate buffer,SCB)中测定酶活力,确定重组酶的最佳反应pH值。将酶分别溶解于不同pH值的缓冲体系(pH 8、9、10)中并处理6~36 h,每隔6 h取样测定酶剩余活力,以未处理的酶活力为100%,研究酶的pH值稳定性。
1.3.4.3 金属离子及表面活性剂对酶活力的影响
在30 ℃、pH 9条件下,将不同的金属离子(10 mmol/L,K+、Mg2+、Fe2+、Ca2+、Cu2+、Zn2+、Mn2+、Co3+)和表面活性剂(1 mmol/L,Triton X-100、Tween 80、SDS、十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB))分别加入反应体系中,检测重组酶活力,以不加金属离子和表面活性剂反应体系的酶活力为100%,研究其对酶活力的影响。
1.3.5 酶法合成β-芳香丙氨酸
分别用苯环上携带不同基团的α-芳香丙氨酸(25 mmol/L,底物苯环上分别携带的基团R为2-NO2、3-NO2、4-NO2、2-Me、3-Me、4-Me、2-MeO、3-MeO、4-MeO)为底物合成β-芳香丙氨酸,在30 ℃、pH 9的条件下反应8 h,采用HPLC检测分析β-芳香丙氨酸的产率或各种α-芳香丙氨酸的转化率。
1.4 数据处理
2 结果与分析
2.1 表达载体构建
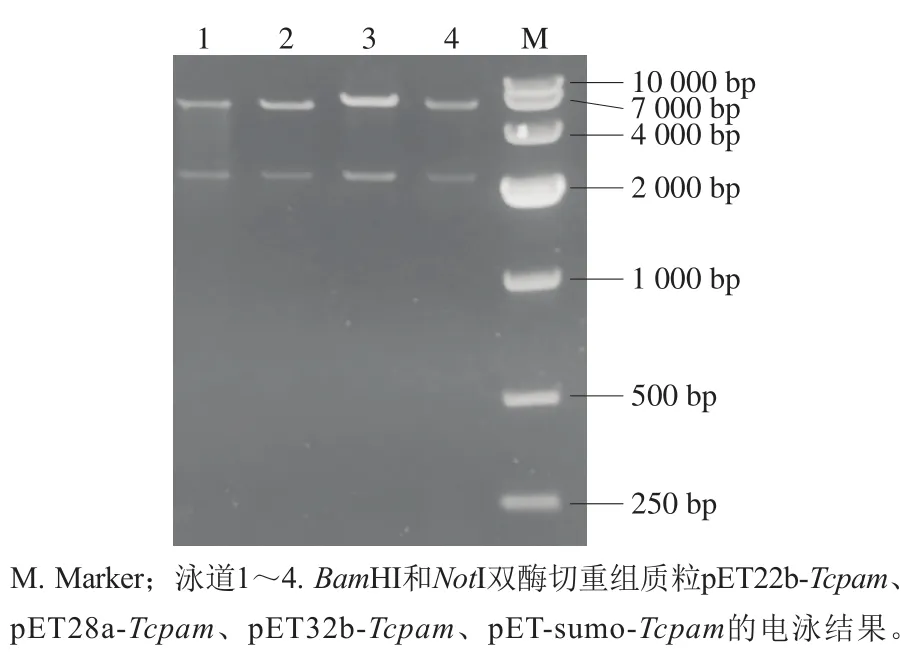
图 2 表达载体NotI和BamHI双酶切验证Fig. 2 Confirmation of expression vector by double enzymatic digestion with NotI and BamHI
对构建的表达载体pET32b-Tcpam、pET-sumo-Tcpam、pET22b-Tcpam以及pET28a-Tcpam进行BamHI和NotI双酶切验证,琼脂糖凝胶电泳结果如图2所示。在2 100 bp左右出现目的基因条带,与理论值一致,表明成功构建表达载体pET32b-Tcpam、pE-Tsumo-Tcpam、pET22b-Tcpam以及pET28a-Tcpam,将其送往生工生物工程(上海)股份有限公司测序,测序结果与NCBI中Tcpam基因序列(AY724735.1)一致。
2.2 重组菌的可溶表达与纯化

图 3 重组酶表达及利用HisTrapTM/FF纯化酶的SDS-PAGE图Fig. 3 SDS-PAGE patterns of recombinant enzyme before and after purification using HisTrapTM/FF
由图3可知,带有pET32b-Tcpam、pET22b-Tcpam重组子经诱导后不表达,而带有pET28a-Tcpam的重组子经诱导后为包涵体,不能获得可溶性的重组酶,仅有pET-sumo-Tcpam的重组子经过IPTG诱导表达可以得到可溶性重组酶,在70 kDa出现可溶性的目的蛋白条带,条带大小与理论值相同。由于pET-sumo-Tcpam载体带有SUMO融合蛋白表达标签,SUMO融合蛋白有促进重组蛋白的正确折叠和提高重组蛋白可溶性的功能[25-27],而其他pET载体没有相关的融合蛋白,导致重组子经诱导后为包涵体或者不表达。将重组酶利用HisTrapTM/FF亲和层析柱分离纯化,SDS-PGAE分析纯化产物,获得电泳纯的重组酶,其质量浓度达到0.256 mg/mL。
2.3 重组酶的性质表征
2.3.1 重组酶催化产物分析
标准品(α-苯丙氨酸)的出峰时间为15.1 min(图4a),检测TcPAM催化底物α-苯丙氨酸之后,在13.2 min出现一个吸收峰(图4b),收集并做质谱检测,图4c、d结果显示,酶催化产物与底物的相对分子质量均为166.2,表明TcPAM能催化α-苯丙氨酸生成β-苯丙氨酸。收集出峰时间为13.2 min的产物进行圆二色谱分析,如图5所示,酶催化产物与标准品R-β-苯丙氨酸具有相似的圆二色谱,与标准品S-α-苯丙氨酸的圆二色谱成Cotton效应[28],表明产物是R构型,与报道来源于微生物的PAM催化产物的构型相反。

图 4 重组酶催化底物和产物的HPLC以及质谱图Fig. 4 HPLC and MS profiles of recombinant phenylalanine aminomutase-catalyzed products

图 5 标准物与酶催化产物圆二色谱Fig. 5 CD spectra of reference standard and recombinant phenylalanine aminomutase-catalyzed product
2.3.2 温度对重组酶活力的影响

图 6 温度对酶活力(a)以及酶活力稳定性(b)的影响Fig. 6 Effects of temperature on the activity (a) and stability (b) of recombinant enzyme
从图6a可知,重组酶的最适温度为30 ℃,酶活力达到4.11 U/mg。如图6b所示,重组TcPAM在40~45 ℃处理3 h时酶活力保持80%以上,在50 ℃处理3 h后仍具有60%的酶活力,表明重组酶的热稳定性较好。
2.3.3 pH值对重组酶活力的影响
从图7a可知,重组酶的最适pH值为9,与目前已知的其他来源的PAM一致[29]。由图7b可知,该重组酶在具有较高的稳定性,在pH 8、9、10的缓冲液处理后,酶活力仍保持在95%以上。
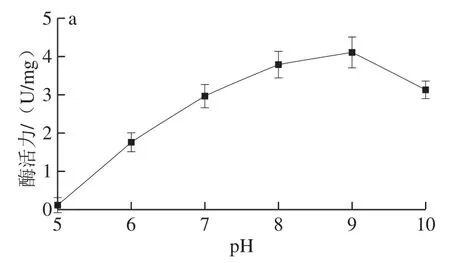

图 7 pH值对酶活力(a)以及酶活力稳定性(b)的影响Fig. 7 Effects of pH on the activity (a) and stability (b) of recombinant enzyme
2.3.4 金属离子和表面活性剂对重组酶活力的影响
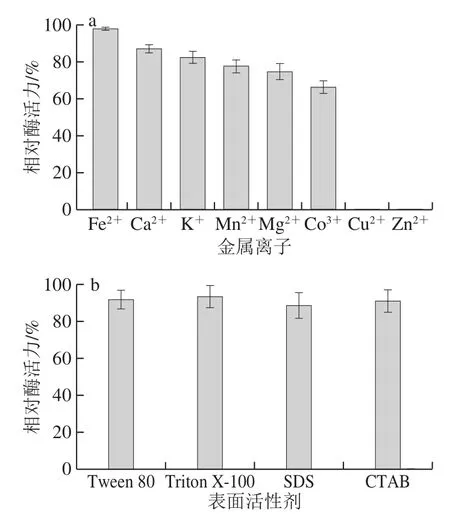
图 8 金属离子(a)以及表面活性剂(b)对酶活力的影响Fig. 8 Effects of metal ions (a) and surfactants (b) on the activity of recombinant enzyme
由图8a可知,K+、Fe2+和Ca2+对TcPAM活力影响较小,相对酶活力保持在80%以上;Mn2+、Mg2+和Co3+对酶活力具有一定的影响,相对酶活力保持在60%~80%之间;而Cu2+和Zn2+强烈抑制酶活力,导致酶活力丧失。由图8b可见,4 种表面活性剂CTAB、SDS、Triton X-100和Tween 80对重组酶的活性影响较小,相对酶活力保持在90%以上。
2.3.5 重组酶异构化α-芳香丙氨酸合成β-芳香丙氨酸
TcPAM可以异构化α-芳香丙氨酸合成β-芳香丙氨酸,如图9所示。结果表明,TcPAM催化的区域选择性受苯环上取代基的基团的性质以及位置影响。TcPAM催化α-芳香丙氨酸出现如下的规律,当苯环上携带的R基团是供电子基团时,促进氨基从底物的α位转移至β位,有利于β-芳香丙氨酸的生成,如R基团是4-MeO或4-Me时,其中β-4-MeO-苯丙氨酸的转化率最高达到45%,但当R基团是2-MeO或3-MeO时,产率低于10%,这可能由于MeO基团较大,而酶活力中心的芳香基结合口袋较窄,导致2、3位置有较大的基团时影响其产率;当苯环上携带的R基团是吸电子基团时,氨基不易转移到芳香丙氨酸的β位,难以生成相应的β-芳香丙氨酸,如R基团为4-NO2时,产物仅有少量的β-4-NO2-苯丙氨酸,转化率低于5%。

图 9 重组酶催化不同取代基的α-芳香丙氨酸的转化率Fig. 9 Conversion of α-aromatic alanine with different substituents catalyzed by recombinant phenylalanine aminomutase
3 结 论
经过筛选不同的大肠杆菌表达载体,构建的pET-sumo-Tcpam在大肠杆菌BL21(DE3)中实现高效表达,并获得了可溶性的重组酶TcPAM,采用HisTrapTM/FF亲和层析的方法制备出电泳纯的TcPAM,具有较好的热稳定性和pH值稳定性,能够催化α-苯丙氨酸异构化生成R-β-苯丙氨酸,但其催化效率及形成的产物β-芳香丙氨酸的产率与底物苯环上携带的基团性质及位置相关,其中4-MeO-β-苯丙氨酸的产率达到45%,本研究为开发生物催化合成β-苯丙氨酸点奠定了基础。
