牛肉低温贮藏环境中沙门氏菌诱导耐酸响应的存在程度及其产生机制
2021-03-31郎晨晓张一敏朱立贤梁荣蓉毛衍伟杨啸吟韩广星董鹏程
郎晨晓,张一敏,朱立贤,梁荣蓉,毛衍伟,杨啸吟,韩广星,罗 欣,*,董鹏程,*
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.国家肉牛牦牛产业技术体系临沂站,山东 临沂 276000)
沙门氏菌(Salmonella)能够引起腹痛、腹泻、肠胃炎和发烧等疾病,是世界范围内造成人类感染和经济损失的重要食源性致病菌[1]。据欧盟食品安全局统计,沙门氏菌在2017年引发93 583 例人类感染,并在2013—2017年间始终是引发欧盟食源性疾病的第二大食源性致病菌[2]。在我国,动物性食品的消费是引发沙门氏菌病的首要原因[3]。诱导耐酸响应(acid tolerance response,ATR)是指细菌在微酸条件下生存一段时间后(即诱导过程),对普遍致死的强酸性环境(即酸激介质)的抵抗能力增强的现象,又称作酸耐受应答反应[4]。ATR一旦形成,不仅能提高细菌对酸的抵抗,还能增强菌株毒力基因的表达,增强细菌耐热、耐盐、耐氧化等能力,使细菌轻易越过食品加工过程中的各类栅栏因子,危害终端食品的安全[4-5]。针对肉类生产,冷鲜牛肉的生产及成熟过程具有诱发沙门氏菌ATR的可能,这些诱导因素包括酸性消毒减菌剂的广泛应用在工厂内部形成的弱酸环境、宰后胴体pH值的降低、高蛋白的营养成分等[6-8]。然而目前沙门氏菌ATR被引发后,其在肉牛的屠宰过程及牛肉贮藏过程中的消长规律仍不明确,并且,外界的弱酸性环境诱发细菌的ATR相关反应机理仍需进一步探索。
细菌诱导耐酸现象的产生是多重生理生化作用的共同结果,如双组分调控系统(two-component regulatory system,TCS)、酸休克蛋白(acid shock proteins,ASPs)、细胞膜脂肪酸组成的调节、膜系统对质子的阻挡及外排以及基于氨基酸代谢的细胞内pH值平衡的维持等过程[9]。其中,TCS对于酸性信号的感知至关重要[10],它由一个跨膜的组氨酸蛋白激酶和一个位于胞质内的调控蛋白组成,是细菌感知外界环境信号,并将信号分子传导至菌体内部,从而激发相应调控机制的重要结构[11]。多个研究表明,作为TCS体系中的一种,PhoP/PhoQ可以响应酸性信号,激活下游的ATR,产生小分子ASPs增强细菌的酸耐受能力[12-14]。然而,除ASPs外,PhoP/PhoQ与氨基酸代谢等机制的相互作用仍鲜见报道。氨基酸代谢能够通过脱羧作用消耗质子并产生碱性物质,是细菌维持胞内pH值稳定的重要生化过程,沙门氏菌的精氨酸脱羧和赖氨酸脱羧系统也被广泛报道[15-16]。Tran等[10]通过定量蛋白质组对沙门氏菌PhoP/PhoQ正常及缺失菌株进行对比,发现缺失组中与精氨酸代谢相关的约10 种蛋白质表达出现差异,说明沙门氏菌的精氨酸代谢与PhoP/PhoQ调控有关。鉴于精氨酸代谢是细菌ATR的重要机制[15],推测除了ASPs途径,氨基酸代谢可能也是PhoP/PhoQ调控的重要靶过程。与此同时,除PhoP/PhoQ外,双组分系统有着多元化的信号感应体系,如PmrA/PmrB、EvgS/EvgA也能对H+作出响应[17-18],有可能在调节氨基酸代谢方面存在协同或拮抗作用。
因此,本研究模拟沙门氏菌在牛肉生产、贮藏过程中经历的弱酸、低温、高蛋白的环境,辅以λRed基因敲除技术,探究微酸诱导、低温长期贮藏、双组分调控对沙门氏菌ATR的影响,以明确ATR在牛肉加工与贮藏过程中的存在程度与消长规律。并通过实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)、氨基酸添加实验等技术建立双组分系统与氨基酸代谢的联系,提出并验证沙门氏菌的双组分系统PhoP/PhoQ和PmrA/PmrB能够感应细胞外H+浓度,并调控氨基酸代谢系统以获得更高的耐酸性这一理论假设,旨在进一步解释细菌诱导ATR产生的内在机理。
1 材料与方法
1.1 菌株与试剂
鼠伤寒沙门氏菌标准菌株(S. typhimuriumATCC 14028)由山东农业大学食品科学与工程学院肉品实验室保存。
脑心浸液(brain heart infusion,BHI)培养基、脑心浸液琼脂(brain heart infusion agar,BHIA) 北京陆桥技术股份有限公司;MiniBEST Universal RNA提取试剂盒、PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real time) 宝生物工程(大连)有限公司;L-精氨酸、L-赖氨酸 北京博奥拓达科技有限公司。
1.2 仪器与设备
5804R离心机、移液枪 德国Eppendorf公司;G154DWS灭菌锅 致微(厦门)仪器有限公司;T100 PCR仪、CFX96实时PCR检测系统 美国Bio-Rad公司。
1.3 方法
1.3.1 TCS缺陷菌株的构建
参照姜娜等[19]的方法,利用λRed重组系统,分别构建TCS PhoP/PhoQ缺失菌株ΔphoP和TCS PmrA/PmrB缺失菌株ΔpmrA。首先,利用PCR技术构建phoP和pmrA基因的同源打靶片段,片段的上下游为目的基因的同源臂,中间为卡那霉素抗性基因。同时,为制作感受态细胞,将质粒pKD46转化至鼠伤寒沙门氏菌14028,并用L-阿拉伯糖诱导Red重组蛋白的表达。而后将PCR扩增的同源片段电转化至宿主细胞,使打靶片段与菌体基因组发生同源重组,并同时获得氨苄抗性,立刻孵育重组细胞,复苏后用卡那霉素和氨苄青霉素抗性平板筛选突变子。最后将质粒pCP20转化入鉴定成功的突变子,利用其表达的FLP翻转酶去除重组菌的抗性,获得ΔphoP和ΔpmrA菌株。
1.3.2 肉质培养基(meat medium,ME)的制备
参照Álvarez-Ordóñez等[20]的方法,将牛肉去除脂肪和筋腱后切碎,375 g牛肉与750 mL去离子水在烧杯中混匀后灭菌(121 ℃、15 min),然后用无菌纱布过滤出肉汤,分装于100 mL离心管并置于-20 ℃备用。
1.3.3 低温贮藏过程中沙门氏菌耐酸能力的测定
参照Buchanan等[21]的方法,利用添加葡萄糖的方式激发出细菌的ATR。TSBG培养基(添加10 g/100 mL葡萄糖的TSB培养基)的pH值在培养过程中缓慢下降,能够为细菌提供温和的酸性适应环境,达到酸诱导的目的。
将-20 ℃保存的正常沙门氏菌14028和ΔphoP(20 μL)接种于10 mL NTSB培养基(TSB去除葡萄糖)中37 ℃过夜活化,然后取100 μL培养物分别接种于50 mL NTSB(对照组)和50 mL TSBG(微酸诱导组),37 ℃过夜培养。将培养物10 000×g、4 ℃离心5 min得到的菌体转移至(4±2)℃的100 mL ME中低温贮藏7 d。贮藏过程中菌株耐酸能力的测定参照Liu Jiamei等[22]的方法,在第1天和第7天从ME中取出适量菌液,根据提前测定的培养基中的活菌浓度,通过蛋白胨缓冲液稀释后接种于9 mL pH 3的BHI(用HCl溶液调节)中,统一细胞浓度为5(lg(CFU/mL)),37 ℃酸激2 h。在酸激前和酸激后,梯度稀释并涂布于BHIA平板,37 ℃过夜培养后进行菌落计数。进行3 次独立重复实验。
参照Skandamis等[23]方法,用菌落下降数表示耐酸能力。菌落下降数是指菌株在酸激前与酸激后的菌落对数值的差(lg(CFU/mL))。菌落下降数值越大,代表菌株的耐酸能力越弱。
1.3.4 氨基酸代谢相关基因表达量的测定
将沙门氏菌14028、ΔphoP和ΔpmrA(20 μL)接种于10 mL NTSB中活化后,取20 μL培养物接种于10 mL的pH值为5.4的NTSB(牛肉的极限pH值为5.4[24])中,37 ℃过夜诱导。
按照RNA提取试剂盒说明提取3 种菌的RNA,将符合浓度和纯度的RNA反转录成cDNA,置于-20 ℃保存。按照PrimeScriptTMRT reagent Kit with gDNA Eraser的说明进行real-time PCR,PCR体系包括2 μL cDNA、12.5 μL 2×SYBR PremixExTaq(Tli RNaseH Plus)、9.5 μL RNase Free Water和0.5 μL浓度为10 μmol/L的上下游引物。PCR程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火延伸30 s,40 个循环;熔解曲线按仪器默认程序。
本实验所用的基因为精氨酸代谢中编码精氨酸脱羧酶的adiA、赖氨酸代谢中编码赖氨酸脱羧酶的cadA以及内参基因rrsA,引物的碱基序列[25]见表1。

表 1 real-time PCR的引物序列Table 1 Primer sequences used for real-time PCR
参照Livak等[26]的2-∆∆Ct方法进行基因相对表达分析,将组分系统正常的沙门氏菌的基因表达量作为对照,最终结果用2-∆∆Ct表示。实验进行3 次独立重复。
1.3.5 添加氨基酸实验的菌株ATR分析
参照Jonge等[27]的方法,取1 mL 1.3.4节过夜诱导后的3 种菌液(细胞浓度约为7.5(lg(CFU/mL))),分别接种于9 mL pH 2.5(用HCl调节)的纯矿物质培养基(MM)、添加0.01 g/100 mLL-精氨酸的矿物质培养基(MM+Arg)、添加0.01 g/100 mLL-赖氨酸的矿物质培养基(MM+Lys)中,置于37 ℃酸激2 h。在酸激前和酸激后分别进行菌落计数,最终用菌落下降数表示菌株的耐酸能力。实验进行3 次独立重复。
1.4 数据分析
real-time PCR数据用Bio-Rad CFX Manager 3.1软件处理。用SAS 9.0软件的混合模型(MIXED Procedure)进行耐酸性分析,在低温贮藏的耐酸性测定实验中,双组分系统、微酸诱导处理、贮藏时间及其交互作用作为影响耐酸性的固定因素,实验重复作为随机因素,在酸激介质中添加氨基酸的耐酸性测定实验中,酸激介质、双组分系统及其交互作用作为影响耐酸性的固定因素,实验重复作为随机因素,数据用平均值±标准误表示,P<0.05,差异显著。用Sigmaplot 10.0软件作图。
2 结果与分析
2.1 微酸诱导、双组分基因敲除及长时间低温贮藏对沙门氏菌耐酸性的影响
表2显示经过不同诱导处理的PhoP/PhoQ正常菌(14028)和缺失菌(ΔphoP)在不同贮藏时间点的耐酸情况,菌落下降数越大细菌的耐酸能力越弱。双组分系统、微酸诱导处理、低温贮藏时间三因素的交互作用对耐酸能力影响不显著(P>0.05)。双组分系统和微酸诱导处理、微酸诱导处理和低温贮藏时间的交互作用对耐酸能力有显著影响(P<0.05)。

表 2 低温贮藏((4±2)℃)过程中不同诱导处理的菌株耐酸能力Table 2 Acid tolerance of strains with different induction treatments during storage at (4± 2) ℃

图 1 低温贮藏((4±2) ℃)过程中沙门氏菌的耐酸能力Fig. 1 Acid tolerance of Salmonella during storage at (4 ± 2) ℃
图1为沙门氏菌ATR的产生以及在低温贮藏过程中的消长变化,及贮藏前微酸诱导处理和低温贮藏时间的交互作用对沙门氏菌耐酸性的影响。经过TSBG微酸诱导菌株的耐酸能力显著高于对照组(P<0.05),说明沙门氏菌分解其中葡萄糖形成的微酸环境能够激发细菌的ATR,与Malheiros[28]和Samelis[29]等的研究结果一致。诱导菌株在第7天的耐酸性仍显著高于未诱导组(P<0.05),这说明,沙门氏菌的ATR一旦产生,在低温环境中至少可以维持7 d,该结果表明,致病菌的ATR可能会贯穿牛肉的整个分割、运输和贮藏过程,并且其产生的耐酸、耐渗透压、耐盐等交叉保护作用可能随原料一直进入下游产品(如发酵肉制品),突破栅栏因子,对食品安全造成极大的危害,但目前这种现象在牛肉产业的存在却很少受到重视。
相对于微酸诱导组,对照组菌株在7 d低温贮藏过程中的耐酸能力无显著变化(P>0.05),说明虽然在长期贮藏过程中沙门氏菌一直处于微酸的肉汤培养基中(pH值为5.2~5.7),但该低温环境并未引发对照组菌株耐酸性的增强,其原因可能是沙门氏菌的诱导耐酸应激状态的产生需要蛋白质从头合成以及能量大量消耗[30],而低温的贮藏环境可能抑制了相关酶的活性,进而抑制了贮藏过程中ATR的产生。与之形成对比的是,诱导菌株在第7天的耐酸能力显著高于第1天(P<0.05),这可能是因为贮藏期之前的微酸诱导处理已经激发了细菌包含诱导耐酸在内的某些应激机制,产生酸休克蛋白,在贮藏过程中持续调节沙门氏菌生理过程,进而表现出逐步增强的耐酸性现象。类似地,Tiwari等[30]的研究表明贮藏前诱导的沙门氏菌从外界酸性信号感知到ATR相关蛋白的合成仅需要1 h,在1 h后添加四环素和氯霉素等抑制蛋白产生的抗生素对于诱导耐酸的抑制已经失去效果,同时,温度因素对于ATR的影响极大,并且显著高于培养基中营养成分对耐酸性的影响。

图 2 不同菌株的耐酸能力Fig. 2 Acid tolerance of different strains
为研究双组分系统PhoP/PhoQ对菌株诱导耐酸能力的贡献,分析微酸诱导处理和敲除双组分基因的交互作用对耐酸性的影响,如图2所示。结果显示,PhoP/PhoQ对耐酸性的提升与细菌贮藏前微酸诱导处理有显著交互影响(P<0.05)。phoP基因的敲除能够显著降低微酸诱导处理组沙门氏菌的耐酸能力(P<0.05),但对对照组的影响并不显著(P>0.05)。该结果表明微酸诱导处理和双组分系统能够协同提升沙门氏菌的耐酸能力,是沙门氏菌ATR系统的两个重要组成成分,并证实了微酸环境中的H+通过PhoP/PhoQ启动沙门氏菌内部的耐酸机制Soncini等[17]研究结果表明PhoP/PhoQ能够感应环境中的H+,当环境中的Mg2+浓度较高时,被PhoP/PhoQ激活的下游基因的表达反而出现下调,出现拮抗效应,但本实验中PhoP/PhoQ调控ATR的过程是否受金属离子影响仍待研究。
当phoP缺失后,经过诱导的沙门氏菌的耐酸能力虽然降低,但仍显著高于未经诱导的菌株(P<0.05),这说明在诱导菌株抵抗酸性胁迫的过程中,除PhoP/PhoQ,还有其他耐酸机制的保护作用,如其他双组分信号感应体系、细胞膜系统和质子外排系统等。已有研究表明,细菌的PmrA/PmrB、OmpR/EnvZ等双组分系统也能够对外界的酸性信号作出响应[17,31]。
2.2 TCS缺失对精氨酸和赖氨酸代谢相关酶基因表达量的影响
氨基酸脱羧反应能够消耗细胞内部的质子,配合细胞膜上的氨基酸转运体系,维持细胞内部的pH值,减少外界酸性环境对细胞的损伤,提高细菌在酸性胁迫下的残存率,其中,精氨酸脱羧系统和赖氨酸脱羧系统是重要的组成部分[15-16]。为研究PmrA/PmrB是否与PhoP/PhoQ相同,也能调控沙门氏菌ATR,并且该过程是否是通过精氨酸和赖氨酸两种脱羧代谢途径实现,本研究对比了PmrA/PmrB和PhoP/PhoQ缺失前后,沙门氏菌的两种脱羧酶编码基因(adiA和cadA)的表达水平。

图 3 组分系统基因缺失后精氨酸脱羧酶编码基因adiA相对表达量变化Fig. 3 Change in adiA (encoding arginine decarboxylase) expression under the deficiency of TCS-related genes
图3结果显示,沙门氏菌的phoP和pmrA缺失后,精氨酸脱羧酶编码基因adiA相对表达量显著降低(P<0.05)。该结果表明,除PhoP/PhoQ,PmrA/PmrB也能被环境中的H+信号激活,进而对ATR产生调控,精氨酸脱羧系统是它们的正向调控靶系统。Brenneman等[32]发现当菌株的adiA和adiC(编码逆向转运蛋白)被诱导表达时,PhoP/PhoQ缺失沙门氏菌在pH 3.0的环境中存活能力显著提升,间接证实了双组分系统对氨基酸代谢的调控。Tran等[10]发现沙门氏菌的PhoP/PhoQ缺失后,与精氨酸代谢相关的10 种蛋白质表达出现差异,说明精氨酸代谢与PhoP/PhoQ有关,与本实验的结果一致。
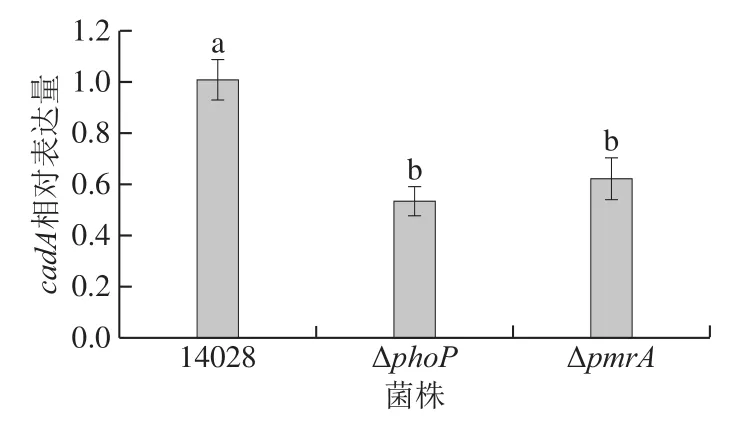
图 4 组分系统基因缺失后赖氨酸脱羧酶编码基因cadA相对表达量变化Fig. 4 Change in cadA (encoding lysine decarboxylase) expression under the deficiency of TCS-related genes
图4结果显示,与adiA结果类似,ΔphoP和ΔpmrA的赖氨酸脱羧酶编码基因cadA相对表达量也显著低于正常菌(P<0.05)。说明除精氨酸脱羧通路外,赖氨酸脱羧系统也能够受到PhoP/PhoQ和PmrA/PmrB的正向调控。值得注意的是,沙门氏菌的PhoP/PhoQ和PmrA/PmrB在应激调控过程中可能存在协同作用,如Kato[33]和Spector[5]等研究表明,当菌株的PhoP/PhoQ被环境中Mg2+信号激活后,能够促进下游PmrD蛋白的表达,而PmrD又能够进一步激活PmrA/PmrB,两种TCS进而共同调控下游机制,如对脂多糖上脂质A进行修饰等。但本实验中的两种氨基酸代谢的调控过程中,PmrA/PmrB与PhoP/PhoQ是否存在联系,仍需进一步研究与验证。
2.3 酸激介质中添加精氨酸和氨基酸对菌株ATR的影响
为从表观现象验证PhoP/PhoQ和PmrA/PmrB能够通过精氨酸代谢和赖氨酸代谢进一步调控沙门氏菌的诱导耐酸现象,通过在酸激介质中添加精氨酸和赖氨酸,对比PhoP/PhoQ和PmrA/PmrB正常与缺陷菌株的耐酸能力(表3),结果显示双组分系统、氨基酸添加的交互作用能显著影响沙门氏菌的耐酸性(P<0.05)。

表 3 不同酸激条件下菌株的耐酸能力Table 3 Acid tolerance of different strains under different acid challenge conditions
对于同一菌株,在作为酸激介质的纯矿物质培养基MM中添加精氨酸和赖氨酸后,3 种双组分系统处理(正常菌、ΔphoP、ΔpmrA)的耐酸性均显著升高(P<0.05),该结果说明精氨酸和赖氨酸代谢都是沙门氏菌提高自身耐酸性的重要途径,同时,在MM中双组分系统突变菌的耐酸性显著低于正常菌(P<0.05),说明除氨基酸代谢外,PhoP/PhoQ和PmrA/PmrB可能还调动了其他的耐酸机制帮助细菌应对酸性胁迫。Álvarez-Ordóñez等[25]发现向MM中添加精氨酸和赖氨酸能显著提高正常沙门氏菌的耐酸能力,Park等[34]也发现赖氨酸的存在能使正常沙门氏菌在pH 3的环境中残存率显著上升,与本实验结论一致。此外,MM+Arg组和MM+Lys组的耐酸能力差异不显著(P>0.05),即不同的氨基酸种类对耐酸性的提高并无显著影响。但Liu Jiamei等[22]发现在酸激培养基中添加赖氨酸后沙门氏菌的存活能力高于添加精氨酸的实验组,这种差异可能是不同血清型菌株(S. typhimurium与S. heidelberg)对氨基酸代谢能力的不同所致。
虽然MM+Arg和MM+Lys组中添加了精氨酸和赖氨酸,但phoP或pmrA基因敲除后菌株的耐酸性仍显著低于正常组(P<0.05),说明氨基酸虽然有助于细菌提高酸耐受能力,但并不能改变TCS缺失导致的耐酸缺陷,该结果从表观水平上验证了前述real-time PCR的结论,即PhoP/PhoQ和PmrA/PmrB能够通过控制氨基酸代谢增强沙门氏菌的耐酸能力。该发现进一步解释了前期学者们在富含营养的食物中的耐酸实验结果:如Álvarez-Ordóñez等[20]将微酸诱导后的沙门氏菌接种在肉汤中,发现肉汤培养基能够显著延长沙门氏菌在pH 3盐酸中的存活时间;Waterman等[8]将沙门氏菌涂抹于富含蛋白质的蛋清上也发现了类似的现象。此外,有学者将沙门氏菌中PhoP/PhoQ的反应调控蛋白PhoP结合磷酸基团的天冬氨酸位点作为药物作用的目标,验证了药物控制细菌毒力的可行性[35],这提示可以通过破坏PhoP/PhoQ和PmrA/PmrB的结构或阻断其作用途径减弱沙门氏菌的ATR,增强杀菌剂效果,减少其对食品安全的危害。
3 结 论
本研究表明微酸诱导过程能显著增强沙门氏菌的耐酸能力(P<0.05),并且菌株的ATR一旦形成,在牛肉低温贮藏(4 ℃)过程中可以维持至少7 d,其产生的交叉保护作用可能会严重威胁以牛肉为原料的下游产品的安全性。随着贮藏保鲜技术的发展,冷鲜牛肉的货架期也逐步延长,沙门氏菌耐酸性的存续时间与不同包装、贮藏方式下货架期的关系仍待进一步确定。微酸性肉质介质(pH 5.2~5.7)的低温贮藏环境不能引发沙门氏菌的耐酸反应,说明低温处理可以作为抑制沙门氏菌诱导ATR的方法。基因敲除和氨基酸添加实验揭示了沙门氏菌的双组分系统PhoP/PhoQ和PmrA/PmrB均参与了外界酸性环境的感知,并可以通过调节精氨酸和赖氨酸的代谢水平提高细菌的耐酸性,因食品中丰富的氨基酸含量,该推论进一步解释了食品基质在强酸环境下能为沙门氏菌提供保护的内在机理。除PhoP/PhoQ和PmrA/PmrB外,是否有其他组分系统参与沙门氏菌ATR的调控,以及这些系统能否通过酸休克蛋白和氨基酸代谢外的其他机制影响ATR仍待研究。
