麦麸阿拉伯木聚糖的羧甲基化改性及理化性质表征
2021-03-31鲁振杰陈正行李亚男
鲁振杰,李 娟,陈正行,李 诚,李亚男
(江南大学食品学院,粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
麦麸是小麦精细面粉加工的副产物,其含有丰富的碳水化合物、蛋白质、矿物质和维生素等营养素,具有重要的利用价值,我国麦麸年产量可达3 000万 t以上[1-2]。目前,麦麸主要被用作饲料,而关于麦麸的高产值利用则成为谷物精深加工领域的研究热点。
麦麸中含有约46%的非淀粉多糖,其中约70%是阿拉伯木聚糖(arabinoxylan,AX)[3-4]。AX是存在于包括小麦在内的谷物细胞壁中的半纤维素,它们是以β-(1,4)-糖苷键连接D-吡喃木糖(xylose,Xyl)残基为主链,α-L-阿拉伯呋喃糖(arabinose,Ara)残基为侧链所形成的聚合物[5-6]。研究表明,从谷物中提取的AX具有良好的生理功能特性,如促进排便、降低血糖水平和抑制胆固醇升高等[7-9]。此外,谷物AX还是一种性质优良的功能性聚合物,被认为是制备用于药物递送载体、组织工程和食品包装的水凝胶、纳米颗粒和可食用膜的合适材料[10-11]。然而,天然提取的AX由于溶解度低、功能基团含量少,从而限制了其作为功能聚合物的实际应用[12]。因此,为了更好的利用AX作为新型功能性材料,可对其进行化学修饰,以增加其功能基团。羧甲基化是最常用的修饰手段之一,它可增加材料中的羧基基团,提高其溶解性,改善材料的成膜、凝胶、乳化、持水和吸附等有价值的功能[13]。
目前,羧甲基化改性在淀粉、纤维素等聚合物中已有较多的报道,其改性过程通常是在碱性介质中,聚合物中的羟基和氯乙酸发生双分子亲核取代反应,产物以钠盐的形式存在[13]。通过类似的反应机理,Petzold等[13]研究了不同工艺和不同浆料介质对桦木木聚糖羧甲基化的影响,结果表明将木聚糖先溶解在NaOH溶液中,再加入浆料介质的一步反应可获得取代度(degree of substitution,DS)最高为1.22的羧甲基化木聚糖。Peng Xinwen等[14]利用微波诱导增强化学反应的方式在较短的反应时间内获得了最高DS为1.02的羧甲基化小麦秸秆半纤维素,但其分子质量减小较大。Konduri等[15]制备了最高DS为0.21的羧甲基化山毛榉木聚糖,并表明其作为分散剂对黏土悬浮液具有良好的分散性能。Bhatia等[16]获得了DS为0.74的车前草羧甲基化阿拉伯木聚糖(carboxymethylated arabinoxylan,CMAX),并表明CMAX和壳聚糖的复合纳米颗粒作为递送载体对布洛芬具有良好控释效果。Alekhina等[17]研究了碱法提取的桦木木聚糖的羧甲基化修饰,并探究了DS为0.36、0.58和1.13样品的成膜性能,结果表明这些膜具有适当的阻隔性能,可用于水果和蔬菜的包装或涂层。然而,有关麦麸AX的羧甲基化改性还鲜有报道,因此有必要对麦麸AX的羧甲基化改性进行探究。
本研究以碱提取法制备麦麸AX,并对其进行羧甲基化改性,通过单因素试验探究了不同反应条件对麦麸CMAX取代度的影响,并考察不同取代度CMAX的理化性质差异,为麦麸AX的羧甲基化改性提供了基础理论。
1 材料与方法
1.1 材料与试剂
小麦麸皮 中粮集团有限公司;A7595高温淀粉酶(酶活≥250 U/g,最适催化温度约为90 ℃)和P4860碱性蛋白酶(酶活≥2.4 U/g,最适催化温度约为60 ℃)美国Sigma公司;葡萄糖(glucose,Glu)、木聚糖、阿拉伯糖、葡聚糖标准品 中国药品生物制品检定所;无水乙醇、硫酸、盐酸、氢氧化钠、氯乙酸钠(sodium chloroacetate,SMCA)、碳酸钙、硫酸铜、硫酸钾、硝酸钠(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
超级恒温循环酶解罐 上海一恒科学仪器有限公司;磁力搅拌器 德国IKA仪器有限公司;Beta2-8 LD plus冷冻干燥机 德国Marin Christ公司;Avanti J26XP高速冷冻离心机 美国Beckman Coulter公司;1200高效液相色谱仪 安捷伦科技(中国)有限公司;1525高效液相色谱仪(配2410示差折光检测器和Empower工作站)、DHR-3流变仪 美国Waters公司;IS10傅里叶红外光谱仪 美国Nicolet公司;TGA-2热分析系统 梅特勒-托利多仪器有限公司。
1.3 方法
1.3.1 AX的提取
麦麸前处理:取粉碎后过80 目筛的麦麸,以料液比1∶10(g/mL)与去离子水混合,在酶解罐中93 ℃条件下,按每100 g麦麸加入0.6 mL高温淀粉酶,搅拌反应3 h,然后降温至63 ℃,按每100 g麦麸加入0.8 mL碱性蛋白酶,搅拌反应3 h,酶解过程结束后升温至100 ℃,保温10 min使酶灭活,最后酶解液以4 000 r/min离心10 min,用去离子水将所得沉淀洗涤3 次,冻干得脱淀粉、蛋白的麦麸[18]。
AX的碱提取:取上述处理后麦麸,以料液比1∶20(g/mL)与浓度为0.5 mol/L的NaOH溶液混合,于85 ℃酶解罐中搅拌条件120 min。反应结束后,待冷却至室温以4 000 r/min离心10 min,沉淀用少量去离子水洗涤3 次,收集所有上清液,以6 mol/L的盐酸溶液将上清液pH值调至4.3,再以13 000 r/min离心15 min,取上清液加入3 倍体积的无水乙醇以沉淀AX,并于4 ℃静置过夜。醇沉后倒去上清液,以75%乙醇溶液洗涤沉淀3 次,所得沉淀挥发除去乙醇,冷冻干燥得AX样品[8]。根据前期研究结果,本实验由前处理麦麸提取AX的得率为(32.80±1.30)%,AX含量为(88.72±0.17)%[19]。
1.3.2 CMAX的制备
取1 g(7.5 mmol,以糖单元摩尔质量为132 g/mol计算)AX悬浮在72 mL的无水乙醇中,磁力搅拌5 min(800 r/min),加入100 mg/mL的NaOH溶液6.0 mL后,室温下强烈搅拌1 h(1 000 r/min)。再加入1.76 g的SMCA(15 mmol),使AX-SMCA-NaOH的物质的量比为1∶2∶2,继续搅拌5 min。置于65 ℃的磁力搅拌水浴中,在搅拌条件下(600 r/min)醚化反应4 h。反应结束后,产物以2 000 r/min离心5 min,弃去上清液,将沉淀悬浮在80%体积分数的甲醇溶液中,用稀醋酸溶液调至中性,然后以1 600 r/min离心5 min,并用无水乙醇洗涤沉淀5 次,将沉淀冻干得CMAX样品[20]。
1.3.3 CMAX制备的单因素试验
本实验分别以NaOH质量分数、AX-SMCA物质的量比、AX-NaOH物质的量比、反应温度和反应时间为因素自变量,通过单因素试验考察不同条件对CMAX取代度的影响。
1.3.4 取代度测定
CMAX纯化[12]:将0.5 g CMAX溶于10 mL水中,再加入10 mL 1 mol/L盐酸溶液,搅拌至完全溶解,加入5 滴酚酞指示剂,再滴加1 mol/L氢氧化钠溶液,搅拌至溶液的红色消失。用搅拌法将50 mL 95%乙醇溶液慢慢加入混合物中,再加入100 mL 95%乙醇溶液,静置15 min后离心(2 000 r/min,5 min),用80%乙醇溶液洗涤4 次,再用50 mL 95%乙醇溶液洗涤,将沉淀冻干备用。
DS测定[14]:将0.05 g上述样品溶于50 mL蒸馏水中,并搅拌至完全溶解,酸碱调节溶液pH值至8.0,然后用0.05 mol/L H2SO4溶液滴定至pH值为3.74。DS值根据以下方程计算:


式中:a为产品的纯度;m和m’分别为纯化前后样品的质量;0.132为AX糖单元的毫摩尔质量(g/mmol);0.08为每个被取代糖单元毫摩尔质量的净增加(g/mmol);M和V分别为滴定所用硫酸的浓度和体积;B为每克样品所消耗H+的物质的量。该方法假设未经处理的半纤维素不含任何羧基,所有滴定一式三份,标准偏差小于4.0%。
1.3.5 红外光谱分析
将干燥的样品和溴化钾以质量比1∶100进行混合,在红外灯下于玛瑙研钵中磨细,用压片机在30 MPa的压力下压制5 min,通过傅里叶红外光谱仪将所得样品压片进行红外光谱扫描,扫描次数为32 次,分辨率为4 cm-1,扫描波数范围为4 000~500 cm-1。
1.3.6 单糖组成测定
采用高效液相色谱法[21-22]测定AX和CMAX的单糖组成。样品制备:称取10 mg样品于15 mL样品瓶中,加入0.3 mL 13.2 mol/L H2SO4溶液,在30 ℃水浴中水解1 h,期间搅拌数次。加入8.4 mL去离子水,在121 ℃高温锅中水解1 h,取出冷却至室温。取上述冷却液3 mL于10 mL离心管中,再称取130 mg碳酸钙分数次加入,以中和酸,离心(4 000 r/min,10 min)取上清液,经0.22 μm滤膜过滤后进行测定。标准曲线:配制Glu、Xyl、Ara质量浓度分别为1.5、1、0.5 mg/mL的标准溶液,以0.5、5、10、15、20 μL的梯度进样,绘出3 种单糖的标准曲线。色谱条件:1200高效液相色谱仪,Hi-Plex H(300 mm×7.7 mm)柱,柱温55 ℃,示差折光检测器,检测温度30 ℃,流动相为超纯水,流速0.6 mL/min,分析时间20 min。
1.3.7 分子质量测定
采用高效凝胶过滤色谱法[23]测定AX和CMAX的分子质量。样品制备:用流动相溶解待测样品,配制成质量浓度为10 mg/mL的溶液,离心(4 000 r/min,10 min)取上清液,经0.22 μm滤膜过滤后,进行测定。标准曲线:取已知相对分子质量的葡聚糖标准品(Glu180、MW2700、MW9750、MW135030、MW300600、MW2000000),经与上述相同处理后,测定并绘制标准曲线。色谱条件:Waters 1525高效液相色谱仪(配2410示差折光检测器和Empower工作站),UltrahydrogelTMLinear色谱柱(300 mm×7.8 mm),柱温、检测器温度均为35 ℃,流动相为0.10 mol/L硝酸钠溶液,流速为0.8 mL/min。
1.3.8 黏度分析
采取AX和CMAX样品制成质量浓度为20 mg/mL的溶液,在25 ℃条件下测定样品的剪切黏度,流变仪模具为40 mm平板,测定间隙为800 μm,在剪切速率1~1 000 s-1范围内进行剪切黏度的测定[24]。
1.3.9 热重分析
通过热重分析仪测定AX和CMAX的热稳定性。在进行热分析之前,将样品在80 ℃的真空烘箱中干燥24 h,准确称取3~5 mg的样品,在30 mL/min的氮气流速下,以10 ℃/min的升温速率测定25~650 ℃范围内的热力学性质[25]。
1.4 数据处理
采用Origin软件进行数据作图处理,采用SPSS软件对数据进行ANOVA方差分析、Duncan多重比较,显著性差异选用P<0.05。每组实验重复3 次,结果采用表示。
2 结果与分析
2.1 不同反应条件对CMAX取代度的影响
麦麸AX的羧甲基化采用了纤维素、淀粉等多糖羧甲基化的常用方法[16]。羧甲基化反应在乙醇为反应介质的非均质体系中进行,乙醇为反应介质具有价格低廉、无毒的优势[12]。通过改变反应参数对羧甲基化反应的参数进行优化,以DS为指标,以NaOH质量浓度、物质的量比(AX∶SMCA、AX∶NaOH)、反应温度和反应时间为因素变量进行单因素试验,结果如表1所示。
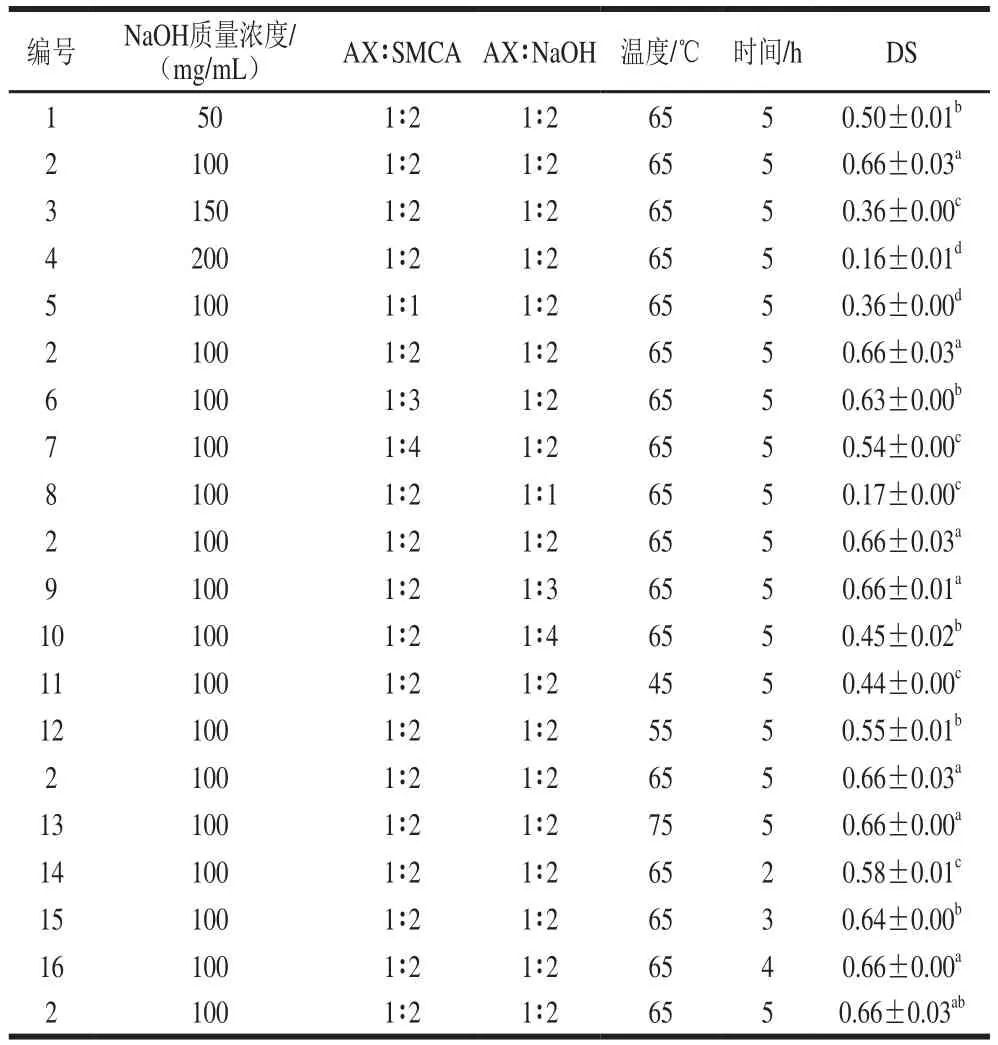
表 1 不同反应条件下CMAX的取代度Table 1 DS of CMAX under different reaction conditions
随NaOH质量浓度的增加,DS呈现出先增加后减小的趋势。当NaOH质量浓度由50 mg/mL增加到100 mg/mL时,所得CMAX的取代度由0.50增加至0.66。随后NaOH质量浓度的增加导致DS的显著降低,当NaOH质量浓度为200 mg/mL时,CMAX的DS仅为0.16。DS随NaOH质量浓度的增加而升高是由于NaOH质量浓度的增加,减少了反应体系中的水分,从而增加了AX和反应试剂的浓度,提高了分子碰撞的机会,有利于反应的进行[26]。当NaOH质量浓度继续增加时,反应体系中的水分含量降低,不利于醚化试剂和AX分子的扩散,也影响了AX分子的活化,阻碍了反应的进行[12]。
DS随SMCA含量的增加而呈现出先增大后减小的趋势,当AX∶SMCA的物质的量比由1∶1增加到1∶2时,DS由0.36增加到0.66,而随SMCA含量的继续增加,DS值逐渐减小,DS在AX-SMCA为1∶4时减小至0.54。可能是由于SMCA含量的增加使其与AX分子的接触增加,有利于反应的进行。反之,当SMCA含量过高时,有利于SMCA和NaOH生成乙醇酸钠的副反应发生,从而导致DS值的降低[27]。
NaOH含量的增加对DS具有较显著的影响,当AX-NaOH物质的量比由1∶1增加至1∶2时,DS由0.17增加至0.66。此后,DS随NaOH含量的增加降低至0.45。由于NaOH含量的增加有利于AX的活化,使AX的分子链充分展开,提高了AX分子的亲核反应活性[14],从而获得了较高的DS。当NaOH含量继续增加时,过量的NaOH和SMCA发生副反应,产生乙醇酸钠,影响羧甲基化反应的进行[28]。
反应温度的升高有利于羧甲基化反应的进行,当温度由45 ℃升高至65 ℃时,DS由0.44增加到0.66,此后,DS值随温度的升高而趋于稳定。由于反应温度的升高有利于AX的活化、反应组分的扩散和流动性,所以DS值随温度的升高而增加。然而,当温度超过65 ℃时,AX在碱性反应介质中易发生分解,且副反应的反应程度也随之增加,使DS趋于稳定[29]。
DS随反应时间的延长呈现出先增加后趋于平衡的趋势,当反应时间由2 h增加至4 h时,DS由0.46增加至0.66,此后,DS不再随反应时间的延长而增加。延长反应时间有利于反应组分的扩散,使醚化试剂和AX分子之间接触的更充分,从而有利于反应的进行。反之,过长的反应时间也加剧了AX分子的降解和副反应的发生,所以DS不再随反应时间的延长而增加[12]。
综上所述,麦麸AX的羧甲基化取代度随NaOH质量浓度及SMCA和NaOH物质的量比的增加均呈现出先增加后减小的趋势,随反应温度和反应时间的增加呈现出先增加后趋于平衡的趋势。当NaOH质量浓度100 mg/mL、物质的量比(AX-SMCA-NaOH=1∶2∶2)、反应温度65 ℃、反应时间4 h时可认为是较优的参数组合,在此条件下获得DS为0.66的CMAX样品。
2.2 红外光谱分析
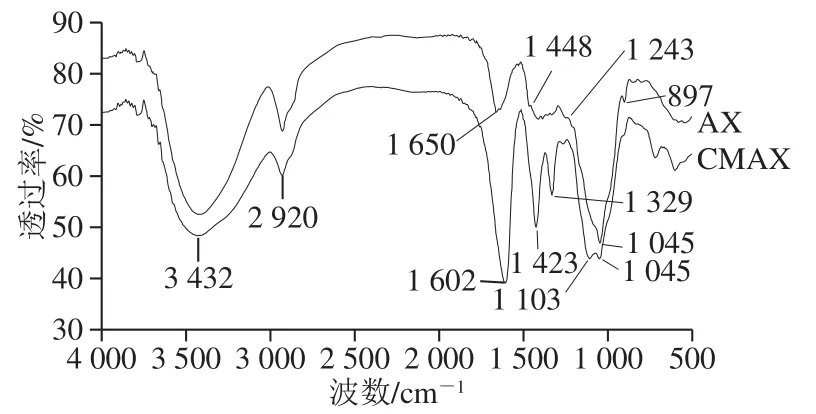
图 1 AX和CMAX(DS 0.66)红外图谱Fig. 1 Infrared spectra of AX and CMAX (with DS of 0.66)
如图1所示,在3 432、2 920、1 650、1 448、1 243、1 045、897 cm-1处具有明显的吸收峰[30]。897 cm-1处出现的吸收峰,是由于糖基之间的β-糖苷键所致,表明构成麦麸AX骨架的木糖残基由β-糖苷键连接[31]。在1 045 cm-1处的强吸收峰由C—O—C和C—O拉伸振动产生,1 045~1 448 cm-1之间的峰与C—H和C—O键伸缩频率有关;1 650 cm-1处的一个强吸收峰与样品中的水分有关;2 920 cm-1处的峰由亚甲基的C—H弯曲和C—H拉伸振动引起,3 432 cm-1附近的峰由氢键羟基振动产生[32]。由CMAX图谱可知,图谱中出现了1 602、1 423、1 329 cm-1三个新典型峰。1 602 cm-1处的强吸收峰表明COO-基团的存在,1 423 cm-1和1 329 cm-1处的吸收峰分别由—CH2剪式弯曲振动和—OH的弯曲振动产生[33]。综上可知,CMAX图谱中新吸收峰出现证明了羧甲基化的发生。
2.3 不同取代度CMAX的单糖组成分析

表 2 AX和不同取代度CMAX单糖组成Table 2 Monosaccharide compositions of AX and CMAX with different degrees of substitution %
由于麦麸AX样品中阿拉伯半乳糖、鼠李糖等单糖含量较少[19],因此本实验主要对Glu、Xyl、Ara 3 种主要单糖进行测定。由表2可知,AX样品的各种单糖含量均为最高,且具有较高的Ara/Xyl值,表明其具有较高的支链程度[34]。随改性样品DS的增加,Glu、Xyl和Ara的含量均随之减少,由于该单糖测定方法仅针对这3 种单糖进行检测,而不能检测其衍生物的含量,因此单糖含量的减少可能是生成了其衍生物。此外,Ara/Xyl值随DS的增加而减小,说明麦麸AX在羧甲基化过程中支链Ara上的接枝反应比主链Xyl更易发生,所以高支链度AX的羧甲基化反应会优先发生在支链糖单元上,可能是由于侧链Ara的存在使主链Xyl的亲核反应位阻增大,所以支链单元上的反应更易发生[15]。当DS为0.66时,Xyl的含量仍有11.79%,可能是由于AX中部分主链Xyl的O2和O3位—OH均被Ara所取代,导致这部分Xyl难以发生反应,这一推测和Beaugrand等[35]所揭示麦麸AX具有较高的支链度相符合。
2.4 不同取代度CMAX的分子质量分布分析

表 3 AX和不同取代度CMAX分子质量分布Table 3 Molecular mass distribution of AX and CMAX with different degrees of substitution
通过测定不同取代度CMAX的分子质量,探究麦麸AX在羧甲基化反应中分子质量的降解情况。如表3所示,聚合物分散系数表示聚合物分子质量的分布宽度,其值越大,分子质量分布越宽,表明分子链分布的不均匀程度越高[36]。本实验所测定的分子质量均有2 个峰,峰1为大分子质量分子的出峰,峰2为小分子质量分子的出峰,所有样品的峰1面积比例均在86%以上,表明所测样品的分子质量分布具有较好的均一性。随改性样品DS的增加,CMAX的数均分子质量和重均分子质量均随之减小,可能是由于在碱性活化和醚化反应过程中样品分子发生了降解[12]。此外,所有CMAX样品峰1的聚合物分散系数值均高于AX样品,而峰2的聚合物分散系数值均低于AX样品,表明经改性后样品分子质量大的分布变宽,而分子质量小的分布变窄。同时,所有CMAX样品的大分子质量峰面积均大于AX样品,表明改性反应对小分子质量分子的降解程度较大。综上可知,在改性过程中样品分子会发生一定的降解,导致改性后样品的分子质量有所减小。
2.5 不同取代度CMAX的黏度分析
通过AX和CMAX溶液的剪切黏度测定,分析羧甲基化对麦麸AX溶液流变性质的影响。如图2所示,AX样品随剪切速率的增加具有轻微程度的剪切变稀,而DS为0.36的CMAX样品,其剪切黏度在剪切速率由1 s-1增加到7 s-1时迅速减小,呈现出显著的剪切变稀现象,此后随剪切速率的增加其剪切黏度趋于平衡;当DS为0.66时,也具有与DS 0.36样品类似的趋势。改性样品溶液的黏度性质变化可能是由于改性样品中的羟基被羧甲基所取代,导致样品溶液的氢键结合减少,在低剪切速率时网络结构便被破坏,因此呈现出显著的剪切变稀现象[37]。此外,CMAX溶液的剪切黏度随取代度的增加而减小,与AX样品相比,当DS为0.36时,CMAX样品的剪切黏度显著减小;而DS由0.36增加至0.66时,其剪切黏度的变化较小。与AX相比,羧甲基化改性降低了样品的分子质量,且CMAX样品中羟基的减少和羧基的增加使样品溶液分子链的缠结减少,降低了分子间的相互作用,从而导致CMAX溶液的黏度较低[14]。
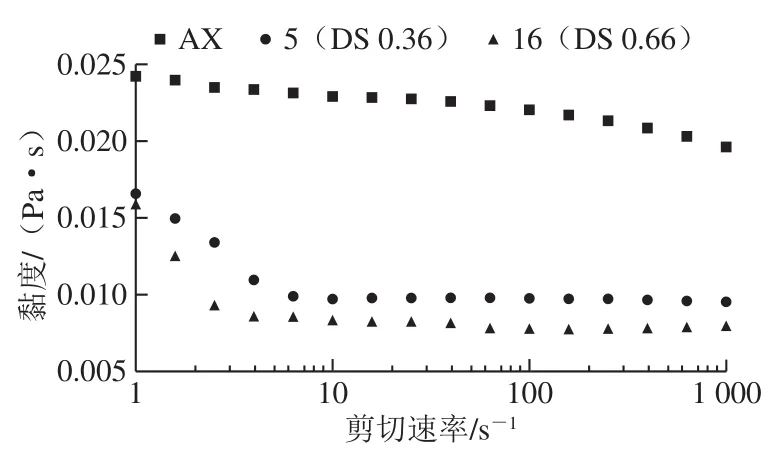
图 2 AX和不同取代度CMAX溶液的剪切黏度Fig. 2 Shear viscosities of AX and CMAX
2.6 不同取代度CMAX的热重分析
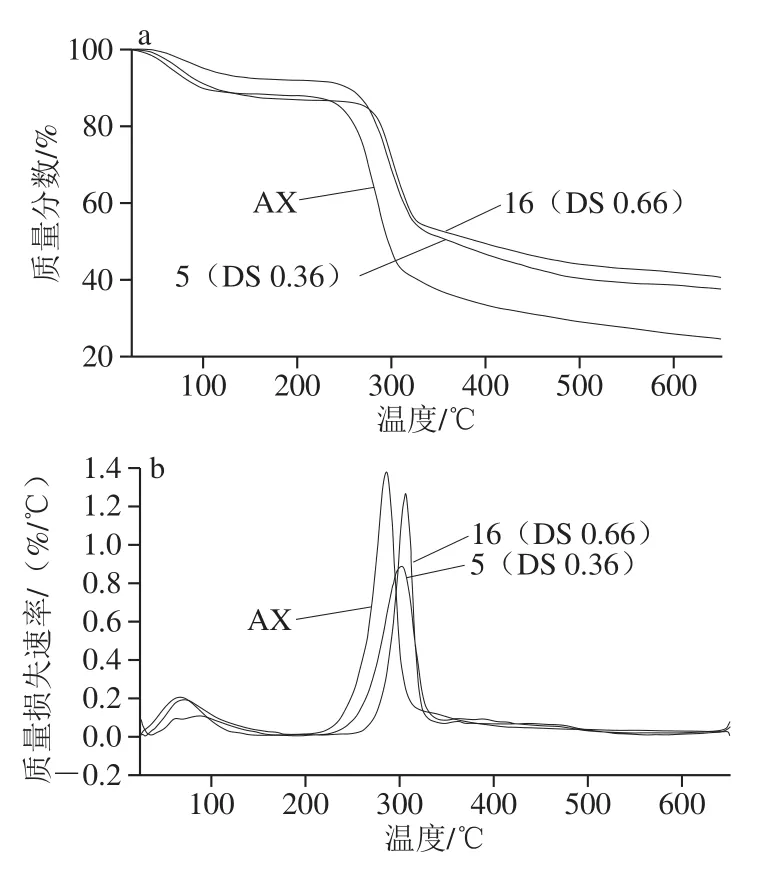
图 3 AX和不同取代度CMAX的热重质量损失(a)和质量损失速率(b)曲线Fig. 3 Thermogravimetric mass loss (a) and mass loss rate (b)curves of AX and CMAX
通过热重分析法对AX和CMAX的热稳定性进行分析,结果表明在25~650 ℃的范围内,样品的热稳定曲线呈现出失水和热分解2 个步骤。由图3a可知,在250 ℃之前3 个样品均表现出轻微的质量损失,是由于样品中水分的损失产生的。此后,所有样品均发生急剧的质量损失,此阶段是由于样品分子间和分子内的氢键断裂以及分子侧链的断裂所致[17]。在质量损失为50%时,AX、DS 0.36和DS 0.66样品所对应温度分别为296、364、393 ℃,表明随DS的增加,CMAX的热稳定性随之增加。由图3b可知,AX、DS 0.36和DS 0.66样品在最大热分解速率时所对应的热分解温度分别为285、300、306 ℃,也说明了改性后样品具有较高的热稳定性,可能是由于羧甲基的引入提高了样品的热稳定性,同时样品中羟基的减少和羧甲基的增加,使改性样品中的氢键结合减少,从而使改性样品具有较好的热稳定性[12,38]。
3 结 论
通过优化实验所得麦麸CMAX的最大DS为0.66,经红外光谱分析表明羧甲基化反应的成功。单糖组成分析表明麦麸AX的羧甲基化优先发生在支链上,且侧链Ara的存在会影响主链Xyl的羧甲基化。随DS的增加,CMAX的分子质量由6.07×105Da降低至4.18×105Da,且改性反应对小分子质量分子的降解程度较大。与AX相比,CMAX溶液的剪切黏度显著降低,而其热稳定性则显著增加,最大热分解速率所对应的温度由285 ℃增加至306 ℃。
本实验通过对麦麸AX进行羧甲基化改性获得了黏度低、流动性好的聚阴离子性麦麸CMAX,为麦麸AX的羧甲基化改性提供了基础理论。麦麸CMAX可认为是一种可降解和高生物相容性的功能性材料,其含有丰富的功能性基团,具有制备可食用膜、水凝胶等生物材料的应用潜能,也为麦麸AX的应用提供了新的思路。
