投加Na2S对化学强化除磷污泥厌氧发酵释磷的影响
2021-03-30李咏梅同济大学环境科学与工程学院污染控制与资源化研究国家重点实验室上海200092
张 强,李咏梅(同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,上海 200092)
磷是生命体重要组成元素[1].从城市污水中回收磷,不但可以缓解磷资源短缺,同时还能减少对水体的污染.目前,城镇污水中的磷主要通过化学沉淀法和生物法去除,两种方法都使污水中的磷转移到了污泥中[2].然而污泥中的磷无法直接循环利用[3].为了能安全有效地利用污泥中的磷,需要先将其转化为其他形式,如经济性和安全可靠性均较高的鸟粪石[4-5].
对污水厂剩余污泥进行厌氧发酵是常用的一种污泥处理方式[6],而其中化学除磷的污泥在厌氧发酵后只能释放出小于 10%的总磷[7].这是因为污水厂在化学除磷时,往往投加了过量的混凝剂,当磷释放出来后,其会再次和污泥中过量的 Al3+、Fe等金属离子形成沉淀或被吸附在污泥中[8-9],从而影响了磷释放.因此如何提高化学除磷污泥的磷释放率是从污泥中回收磷需解决的一个重要问题.研究发现湿式化学提取可以有效释放化学磷[10],但是在酸溶或碱溶过程中,污泥中的其他有毒有害物质,尤其是其中对后续鸟粪石回收影响较大的某些金属离子,比如 Fe、Al3+和 Ca2+也会一起溶解到液相中,使得杂质物质的分离是后续磷回收的重要步骤[11].此外,本课题组前期研究发现络合剂虽然也可以释放化学除磷污泥中的磷[12],但是药剂费用较高.因此,寻求一种经济有效释放化学污泥中磷的方法仍然是磷回收中需要解决的瓶颈问题.我们前期研究发现投加Na2S有利于FePO4的释磷,且有利于污泥有机物的溶出以及产酸[13].Mejia等[14]则通过研究含磷酸铁沉淀污泥释磷过程中 FeSx胶体的变化和性质,进而优化硫化物厌氧释磷过程,此外,Hu等[15]发现通过厌氧还原硫酸盐生成硫化物也可以实现磷的释放.整体而言,针对实际化学除磷污泥的研究还比较少.
本文将研究Na2S投加量对污水厂化学除磷污泥厌氧发酵释磷的影响,研究了不同S/Fe物质的量比对污泥厌氧释磷与发酵过程的影响,以及对污泥微生物多样性的影响,最后结合鸟粪石回收的需求评估最佳反应条件,以提供安全、经济的途径回收化学除磷污泥中的磷资源.相较于已有研究,本文的研究对象为污水厂实际化学除磷污泥,同时分析了微生物多样性以及对后续回收流程的影响,给出了更加全面和实际的结论,进而为实际生产应用提供指导.
1 材料与方法
试验所用两种污泥分别取自天津某污水处理厂污泥浓缩池(命名为S1)和上海某污水处理厂污泥浓缩池(命名为 S2).两者都采用了厌氧-缺氧-好氧工艺,为了提高磷的去除率,在处理过程中都投入了聚合氯化铝铁,因此S1和S2都含有大量的铁和铝.污泥的性质如表1所示.
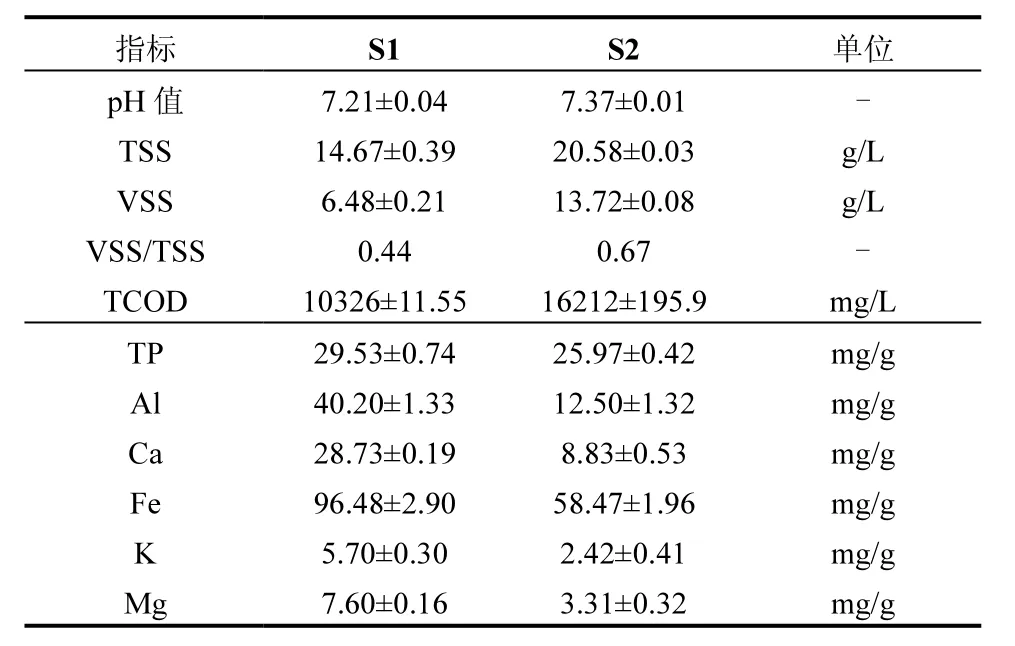
表1 试验用浓缩污泥的初始性质(n=3)Table 1 The initial characteristics of the concentrated sludge samples
1.1 不同S/Fe物质的量比对污泥厌氧释磷的影响
投加 Na2S后,主要释放 Fe-P结合的 P,因此以S/Fe物质的量比作为考察指标.由于污泥 S2的 Fe含量较低,为了达到较明显的释磷现象,因此Na2S按S/Fe物质的量比为0.5:1和 1:1投加,而污泥S1的Fe含量较高,因此Na2S按S/Fe物质的量比为0.3:1、0.5:1和1:1投加.取500mL的污泥,放入600mL的盐水瓶中,对不同的试验组,加入相应量的Na2S.每组试验设置 2个平行.厌氧发酵试验在(25±1)℃的恒温摇床中进行,转速控制在 120r/min.厌氧发酵共进行7d,每隔1d取样,测量pH值、正磷酸盐(PO43--P)、氨氮(NH4+-N)浓度以及金属离子浓度等,并对污泥S1实验组污泥进行了扫描电镜(SEM)分析,以及污泥S2实验组的溶解性有机碳(STOC)、挥发性脂肪酸(VFAs)和生物多样性变化的分析.由于污泥S1实验组在中试现场完成,不具备STOC和VFAs分析条件,故未进行测定.
1.2 Na2S对污泥厌氧释磷过程中微生物的影响
为了研究 Na2S对污泥厌氧释磷过程中微生物群落的影响,对1.1中的污泥S2试验组中进行了16S rDNA高通量测序分析,并主要对Alpha多样性以及群落组成与样本间差异进行了详细分析.
为了可以更加直观地对比Na2S释磷效果,利用式(1)可计算出不同试验组每g污泥的释磷量.

其中:Pe为厌氧发酵过程中各试验组不同时刻上清液中磷酸盐的浓度,mg/L;Pi为各试验组初始上清液中磷酸盐的浓度,mg/L;TSS为总悬浮颗粒物,g/L.
游离氨计算公式[16]:

式中:NH3为游离氨浓度,mg/L;TAN为总氨氮浓度,mg/L;T 为反应温度,°C.
1.3 测定方法
总悬浮固体(TSS)、挥发性悬浮固体(VSS)、TP、PO43--P、NH4+-N根据标准方法测定[17],pH值采用JENCO MODEL 6010型测定,金属离子采用电感耦合等离子发射光谱仪 ICP-Agilent720ES测定,TOC的测定采用 TOC仪(TOC-VCPH,日本岛津),16S rDNA高通量测序分析主要委托上海美吉生物公司完成.
VFAs的测定采用气相色谱仪(GC6890N,Agilent,USA),载气为氮气,检测器为 FID,色谱柱为30m×0.32mm×0.25mm DBWAX125-7332,进样器和检测器的温度分别设为200℃和220℃,炉温在55℃运行1min,然后以30℃/min的速度升温到110℃,保持1min,再以10℃/min的速度升温到200℃,再以30℃/min的速度升温到220℃,保持 1min,一个样品整个运行时间为14.3min,每次进样0.5μL.
2 结果与讨论
2.1 不同S/Fe物质的量比对污泥厌氧发酵与释磷的影响
2.1.1 上清液中PO43--P的变化 由图1可见,污泥S1和S2的空白组在厌氧发酵7d过程中几乎无磷释出.其他投加Na2S的试验组在第2d之后释磷量基本稳定,除了 S1-1:1试验组在第 2d达到最大释磷量237.15mg/L后,随即又在第3d下降到了168.55mg/L,之后释磷量便一直稳定在 170mg/L左右,推测是投加硫化钠后,由于硫化钠的水解作用,pH 值升高(图3),Al-P沉淀中的P由于Al3+在高pH值条件下会变成可溶性的偏铝酸根,进而释放出磷,而释出的磷会重新与污泥中过量 Fe结合形成 Fe-P沉淀,也会被Fe的其他形式沉淀物吸附进而重新转移到固相中[18].图2为污泥厌氧发酵7d后每g污泥释磷量的情况.总体而言,污泥S1每g污泥释磷量要高于污泥S2,这是由于污泥 S1的总磷含量高于污泥 S2.随着S/Fe物质的量的增加,污泥S2和污泥S1每g污泥释磷量都有所增加,S2-1:1相较于 S2-0.5:1提高了3.3倍,而污泥S1每g污泥释磷量随着S/Fe的增加而增加的幅度则没有污泥S2明显,这可能是由于污泥S1的磷含量虽然相较于污泥S2高了0.14倍,但是Fe的含量却高了0.65倍,同时Al3+的含量也高了2.22倍,释放出的磷会与污泥中过量的金属离子结合而重新转移到固相[18].

图1 投加Na2S强化污泥厌氧释磷上清液中磷酸盐浓度随时间的变化Fig.1 Concentrations of phosphate in the supernatant of sludge samples with Na2S enhanced P release during anaerobic fermentation of sludge

图2 投加Na2S强化污泥厌氧释磷7d后每g污泥释磷量情况Fig.2 Phosphorus release per gram of sludge after 7days of anaerobic fermentation with Na2S addition
Kato等[19]则研究了NaHS对化学除磷污泥的释磷效果,结果发现,当S/Fe物质的量比为1.0~2.0时,可以释放污泥中 43.2%的磷酸盐.也有研究在 S/Fe为1.5的条件下回收了70%的磷,当S/Fe物质的量达到了 2.5后,甚至可以回收超过 90%的磷[14].本研究以较低的 S/Fe物质的量比释放了污泥中的磷(S1-0.3:1(9.87%)、S1-0.5:1(15.22%)、S1-1:1(22.20%)、S2-0.5:1(8.93%)、S2-1:1(27.23%)),表明投加 Na2S可以有效地释放污泥中的磷,是一种有潜力的强化磷回收方法.
2.1.2 上清液中pH值和NH4+-N的变化情况 由图3可见,污泥S1和S2的初始pH值和NH4+-N浓度没有明显差别,投加Na2S后,污泥S1的试验组pH值比污泥S2高,即使是S1-0.3:1试验组,其pH值上升程度也要比 S2-1:1试验组高,这可能是由两个原因造成,其一是污泥S1含Fe量高于污泥S2,同样为500mL的污泥,S2-1:1投加了8.82mmol的Na2S,而S1-1:1则投加了12.7mmol的Na2S,因此S1-1:1的pH值要高于S2-1:1.此外,S1-0.3:1投加了3.8mmol的Na2S,但是其pH值依旧高于S2-1:1,这可能是由第二个原因所造成的:污泥S2的VSS/TSS含量要远高于污泥S1,VSS中含有大量可以对pH值进行缓冲的有机物,尤其是其在产酸阶段产生的有机酸可以中和由于投加Na2S产生的碱度,因此污泥S2的试验组 pH值整体要低于污泥 S1.同时,大部分试验组的pH值在第1d之后也都逐渐下降,除了S1-1:1,其一直维持在10左右,这可能是由于Na2S投加过多引起的,类似的现象也出现在卢霄等[13]的研究中.
现在有很多这样的图书,让孩子从两幅图片中“找相同”,比如老奶奶都戴着眼镜,或者小女孩都穿着红颜色的裙子。这个过程,需要孩子仔细地观察、专心地思考。相反的就是“找不同”,例如一幅图片上有太阳、小树、花朵、小鸟、小白兔,另一幅图片乍看起来类似,但是树上多了一个猴子,让孩子仔细看完前一幅,再看后一幅,问他两幅图片有哪些不同,但不准翻书。按照难易程度,可以循序渐进。同样,这个游戏对孩子的注意力和记忆力都是不错的训练哦。

图3 投加Na2S强化污泥厌氧释磷上清液pH值随时间的变化Fig.3 pH值 in the supernatant of sludge samples with Na2S enhanced P release during anaerobic fermentation of sludge
从图4可知,投加了Na2S的试验组整体NH4+-N浓度都要高于空白组,且与 pH值(图 3)变化趋势相同.这是因为碱性可以促进污泥水解[20],可以看出虽然污泥S2的TSS和VSS/TSS都要高于污泥S1,但是污泥S1试验组的NH4+-N浓度整体要高于污泥S2试验组,这说明 pH 值的促进作用占主导.其中,S1-1:1试验组在第 1d NH4+-N浓度达到最高值861.4mg/L,之后下降到了500mg/L左右并保持稳定.根据式(2)计算可得,该试验组反应第1d游离氨的理论浓度为 957.5mg/L,第 3d为 608.1mg/L,可以看出,理论游离氨浓度高于测定的总氨氮浓度,这是因为体系还未达到平衡,并表明高pH值条件下总氨氮向游离氨转化的驱动力较大,NH4+-N不断生成,并在高 pH值条件下不断生成游离氨.体系中较高的NH4+-N后续有利于鸟粪石的生成,促进磷回收.

图4 投加Na2S强化污泥厌氧释磷上清液中NH4+-N浓度随时间变化情况Fig.4 Concentrations of NH4+-N in the supernatant of sludge samples with Na2S enhanced P release during anaerobic fermentation of sludge
2.1.3 上清液中STOC和VFAs的变化情况 按不同S/Fe物质的量比投加Na2S后,污泥S2厌氧释磷上清液中STOC和VFAs浓度的变化情况见图5所示.结果表明在厌氧发酵过程中,STOC的变化趋势与 VFAs类似,投加 Na2S的试验组 STOC和VFAs浓度整体要高于空白组,其原因是碱性条件下可以促进污泥的水解以及 EPS的释放[20],且可以发现增长主要发生在第1d,这与pH值变化(图3)相对应,pH值越高,碱性促进作用越强.卢霄等[13]也发现了类似的规律,投加Na2S后可以有效促进STOC和VFAs的产生.


图5 投加Na2S强化污泥厌氧释磷上清液中STOC(a)与VFAs(b)浓度随时间的变化Fig.5 Concentrations of STOC(a)and VFAs(b)in the supernatant of sludge samples with Na2S enhanced Prelease during anaerobic fermentation of sludge
2.1.4 上清液中金属离子的变化情况 由图 6可见,厌氧发酵7d过程中,Fe和Al3+的浓度变化与pH值的变化呈现明显相关性.pH值越高的试验组,Fe和Al3+的浓度越高.投加Na2S的试验组两种金属离子浓度在第 1d均达到最大值,之后缓慢下降,其中Fe最高达到了 363mg/L,Al3+达到了 191mg/L.投加Na2S后,FePO4沉淀会转化为FeSx沉淀,形成的FeSx颗粒在高 pH值条件下由于具有较低的 Zeta电位[14],互相排斥不易沉淀,且反应初期 FeSx颗粒粒径最小可以到±50nm[21],因此对于含 Fe量更高,以及总体pH值更高的S1试验组,上清液Fe浓度高于S2试验组;且Na2S投加量越多,上清液中Fe浓度越高.随着反应的进行,FeSx颗粒粒径会伴随着搅拌絮凝逐渐增大,并且随着体系 pH值的不断下降,FeSx颗粒的沉降性能也会变好[14,21],因此上清液中Fe浓度逐渐下降.

图6 投加Na2S强化污泥厌氧释磷上清液中金属离子浓度随时间的变化Fig.6 Concentrations of metals in the supernatant of sludge samples with Na2S enhanced P release during anaerobic fermentation of sludge
Ca2+和 Mg2+浓度的变化趋势类似,空白组两种离子的浓度虽有波动,但无明显变化.投加 Na2S后,pH值上升,进而导致Ca2+和Mg2+形成沉淀转移到固相中,并且投加Na2S越多的试验组,pH值上升越高,其上清液中Ca2+和Mg2+的浓度越低.
本研究中,在保证上清液磷浓度高于50mg/L的前提下,选择最少的Na2S投加量,从而获得更好的污泥沉降性能,同时也可以降低上清液中Fe和Al3+的浓度,进而减少对后续鸟粪石生成的抑制作用[22-23],因此建议对于污泥 S1和 S2,分别按照 S/Fe比为0.3:1和0.5:1的比例投加Na2S.
2.2 Na2S对强化化学除磷污泥厌氧释磷过程生物多样性的影响
2.2.1 Alpha多样性分析结果 污泥S2投加Na2S后不同时间段不同试验组OUT水平的Shannon指数见图7.由图可见,空白组厌氧发酵7d之后,生物多样性没有明显变化,S2-0.5:1试验组也和空白组没有明显差别,但是S2-1:1试验组则有明显下降,说明当S/Fe物质的量比大于等于1:1后,就会对污泥中的生物多样性产生影响.这可能是由于两种原因造成:(1)过量投加Na2S会导致硫化氢(H2S)的产生,H2S会对污泥中的某些微生物产生抑制作用,从而抑制其生命活动[24](2)在硫存在的条件下,会有利于一些嗜硫生物的生长,在竞争中占据优势,从而造成其他微生物的减少[25];碱性条件下(图 3)也会导致微生物多样性下降[26].
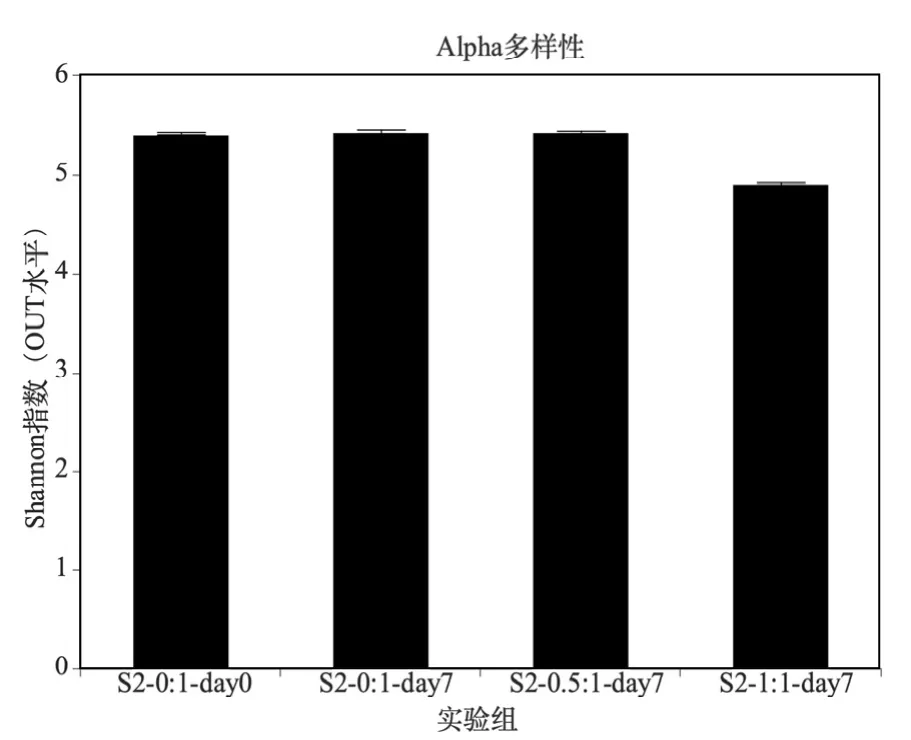
图7 投加Na2S强化污泥厌氧释磷后污泥OUT水平的Shannon指数Fig.7 Shannon index of OUT level after the anaerobic fermentation of sludge with Na2S enhanced P release
2.2.2 群落组成与样本间差异性分析结果 污泥S2投加Na2S释磷前后不同试验组群落主要组成百分比变化见图8(图中主要展示了含量比例排在前5名的菌属).对于门水平[图 8(a)],不同的样本,厌氧释磷过程中,主导菌群均为 Proteobacteria、Actinobacteria、Bacteroidetes、Chloroflexi 和Firmicutes,其他碱性厌氧发酵研究中也基本呈现相同的情况[26-28].从图中可以发现,随着Na2S投加量的增加,Proteobacteria和 Bacteroidetes的占比在减少,Actinobacteria、Chloroflexi和Firmicutes的占比则增加.

图8 投加Na2S强化污泥厌氧释磷前后污泥主要群落组成Fig.8 Main community composition of sludge before and after the anaerobic fermentation with Na2S enhanced Prelease
Firmicutes、Bacteroidetes、Bacteroidetes 和Chloroflexi广泛分布于厌氧发酵过程中,可以降解复杂的有机大分子化合物,从而有利于污泥减量化[29].此外,Firmicutes菌门也被认为是厌氧发酵过程中的主导菌种,该菌门下微生物被认为是产酸作用的主要来源[30-31],而 Bacteroidetes菌门的微生物可以在厌氧发酵条件下将蛋白质和碳水化合物转化为丙酸和乙酸[27].Chloroflexi则被发现其对严苛条件的抗性,比如高温和强碱性[32].
从纲水平[图 8(b)]上可以看出,空白组厌氧发酵7d后,污泥中群落占比组成没有明显变化,而投加了 Na2S的试验组群落占比组成相较于空白组有明显差异,其中占比较大的几个菌落主要有Actinobacteria、Betaproteobacteria和 Clostridia等,其中 Actinobacteria(纲)属于 Actinobacteria(门)、Betaproteobacteria(纲)属于Proteobacteria(门)、Clostridia(纲)属于 Firmicutes(门).Actinobacteria 和Clostridia的占比随S/Fe物质的量比的增加呈增长趋势,而 Betaproteobacteria则逐渐减少.研究发现Clostridia可以利用纤维素酶分解可溶性有机物,然后产生有机酸[32].
从属水平[图 8(c)]上,投加 Na2S厌氧发酵 7d后,Iamia、Proteocatella、Proteiniclasticum和Acetoanaerobium都随着S/Fe物质的量比增加而增长,而Dechloromonas则出现了明显的下降.Iamia属于Actinobacteria(门),Actinobacteria广泛存在于厌氧发酵过程中,其可以产生水解酶或者利用可溶性有机物产生有机酸[32];Proteocatella可以降解蛋白质进而产生乙酸,且 Yekta[24]也发现此菌在 Na2S处理后的污泥厌氧发酵中呈增长趋势.Proteiniclasticum和Acetoanaerobium都属于 Clostridia(纲)、Firmicutes(门),该门和纲下的微生物多为产酸微生物,且其变化趋势与对应纲和门变化趋势一致.Dechloromonas则是一种聚磷菌,其可以在EBPR工艺中去除污水中的磷,与其他研究中碱性条件可以促进该菌的生长不同[31],其在投加Na2S造成的碱性条件下反而下降,说明相较于碱性的促进作用,Na2S水解生成的 H2S(liquid)对其的抑制作用可能更加占据优势.
总体而言,投加硫化钠可以促进水解产酸微生物的生长,这与已有研究使用碱性发酵对污泥群落的影响类似,且和2.1.3中VFAs的增长相对应.同时,由于 H2S(liquid)的抑制作用,会导致微生物多样性的降低.
2.3 不同S/Fe物质的量比对污泥表面结构的影响
污泥S1按不同S/Fe物质的量比投加Na2S后厌氧发酵过程中污泥 SEM 图见图 9.可以看出,在1μm 水平下,起始污泥表面块状沉淀颗粒占多数,反应1d后,污泥表面出现了较多的杆菌,但是沉淀颗粒依旧占多数.7d后,球菌和杆菌覆盖了污泥表面,只有少数沉淀颗粒,说明随着厌氧发酵的进行,微生物开始降解污泥中的有机物并进行生命活动.而对于投加了Na2S的试验组,反应1d后,污泥表面几乎被微生物覆盖,尤其是S1-1:1表面还有大量丝状菌.但是在厌氧发酵7d后,原本布满细菌的污泥表面会出现小块状沉淀,同时,随着 S/Fe物质的量比的降低,7d后,污泥表面的块状颗粒越多,裂缝也越多,根据上文分析得出,水解产酸菌在投加硫化后占据主导,并且产酸菌多为丝状菌和杆菌,如产酸菌 Actinobacteria为丝状菌,Acetoanaerobium为杆菌,Clostridia为杆菌,Firmicutes则多为球状、杆状和丝状,而多数的嗜硫菌为杆菌[33],因此污泥表面覆盖的细菌应该多为水解产酸菌.并且随着反应的进行,体系的 pH 值不断下降,对水解产酸微生物的促进作用减弱.而 S/Fe物质的量比较高的试验组,厌氧发酵7d后,其表面依旧比较光滑,这可能是微生物的代谢产物以及 FeSx胶体覆盖所致.

图9 不同S/Fe物质的量比强化化学除磷污泥厌氧释磷的污泥SEMFig.9 SEM results of sludge samples before and after the anaerobic fermentation of sludge with Na2S enhanced Prelease at different ratio of S/Fe
投加Na2S后,污泥颜色由灰变黑,且污泥沉降性能变差(图10),S/Fe物质的量比越高的试验组,沉降性能越差,这是因为污泥中黑色且粘稠的沉淀为FeS和FeS2的混合物.在强碱性条件下,FeSx的Zeta电位较低,因此颗粒间排斥力较强,悬浮体系比较稳定,污泥不容易沉降,但是随着反应的进行,pH值不断下降,Zeta电位也逐渐趋近于 0,沉降性能逐渐变好,其中S/Fe物质的量比为0.3:1的实验组沉降性能最好.有研究表明当pH=4时,该体系可以获得最佳沉降性能[14].

图10 不同S/Fe物质的量比对污泥沉降性能的影响(反应7d后静置30min)Fig.10 Effect of S/Fe ratio on settleability of sludge after anaerobic fermentation for 7days(stand for 30min)
3 结论
3.1 投加Na2S可以有效释放化学除磷污泥中的磷,当S/Fe物质的量比为1:1时,污泥S1和S2分别释放了22.20%和27.23%的磷.
3.2 投加Na2S会导致体系pH值上升,进而促进污泥水解与NH4+-N的释放,同时也会促进水解产酸微生物的生长,强化STOC和VFAs的产生,污泥S2厌氧发酵过程中NH4+-N和STOC最高浓度分别可以达到900mg/L和650mg/L左右.此外,上清液中的Fe和Al3+浓度会升高,Ca2+和Mg2+浓度会下降.
3.3 投加Na2S后,随着S/Fe物质的量比的增加,污泥表面覆盖的细菌数量增加,污泥沉降性能变差.随着厌氧发酵的进行,pH值逐渐下降,污泥表面的细菌数量降低,裸露在外的固体沉淀小颗粒数量增加,污泥沉降性能逐渐变好.
3.4 总体而言,在保证释磷量大于 50mg/L的前提下,推荐污泥按S/Fe物质的量比为0.3:1~0.5:1投加Na2S,即可以保证释磷量,同时上清液中Fe和Al3+等杂质金属离子的浓度也控制在一个较低的范围,且可以节省用药量.
