2-羟基-1,4-萘醌介导Fe2+-STPP厌氧还原对硝基酚
2021-03-30宣丽爽秦传玉张成武张婧懿吉林大学新能源与环境学院吉林长春130021
宣丽爽,秦传玉,张成武,张婧懿,袁 芳(吉林大学新能源与环境学院,吉林 长春 130021)
对硝基酚(PNP)是苯酚最重要的衍生物之一,经常被用作农药、合成染料和有机化学生产中的原料[1],具有致畸、致癌、致突变等危害.环境水体中PNP的广泛存在已经严重威胁了环境安全和人体健康[2-4].PNP具有很强的抗氧化能力,在厌氧的水体环境中硝基的还原是主要的转化途径.
亚铁离子(Fe2+)是一种十分常见的还原剂,在缺氧或厌氧的条件下能还原多种污染物[5-7].研究发现,乙二胺四乙酸盐(EDTA)、次氮基三乙酸盐(NTA)、草酸盐、多聚磷酸盐等配体的加入可以显著降低Fe3+/Fe2+的氧化还原电位,提高Fe2+的还原能力[8-10].同时,铁离子与配体形成的络合物也能防止生成沉淀,提高 Fe2+的利用率.Buerge等[11]研究发现有机配体(柠檬酸盐、草酸盐、水杨酸盐、酒石酸盐、次氮基三乙酸盐)与 Fe2+络合后能促进 Fe2+还原 Cr6+.但是,对于难降解的硝基芳香化合物(对硝基甲苯、对硝基酚、氯代硝基苯等),Fe2+和配体络合后也难以将其还原.近年来,人们发现天然水体环境中存在的溶解性有机质(DOM)可以作为电子穿梭体加快电子向还原性物质的转移,常用于还原硝基芳香化合物[12-14].Hofstetter等[15]发现 DOM 介导针铁矿悬浮液中表面结合的Fe(II)还原五氯硝基苯(PCNB)的还原率是没有DOM体系的8倍.Scott等[16]通过电子自旋共振测量的结果证明了腐殖质中的醌基团是介导硝基芳香化合物还原的重要官能团,醌基团从电子供体处得到电子生成半醌自由基,由半醌自由基还原硝基芳香化合物.
综上,配体和DOM均在一定程度上提高了Fe2+的还原能力,但是配体和DOM同时存在时对Fe2+还原转化污染物的作用规律目前尚不明确.三聚磷酸钠(STPP)作为一种代表性配体,在工业生产中作为食品添加剂被广泛使用[17],在水体环境中也检测到其存在,并且其对于 Fe2+还原促进效果明显优于其他配体.2-羟基-1,4-萘醌(LQ,C10H6O3)作为代表性DOM,是一种具有共轭醌式结构的溶解性有机质,广泛存在于自然界中[18].LQ被还原得到中间体半醌自由基,中间体可进一步还原其他氧化态化合物[19].本文模拟厌氧水体环境,考察Fe2+、配体、DOM三者存在的情况下对污染物还原转化的影响.选取FeSO4作为 Fe2+源,探讨不同影响因素(组分、初始pH值、LQ浓度、STPP浓度、Fe2+浓度)下,PNP还原转化效果及规律,确定实验体系的最佳反应条件,并研究了不同组分对电子传递机制的影响,为理解天然的厌氧水体环境中DOM强化电子传递还原转化污染物提供一定的理论依据.
1 材料与方法
1.1 实验试剂
2-羟基-1,4-萘醌(分析纯,阿拉丁试剂有限公司);对硝基酚(分析纯,天津光复精细化工研究所);三聚磷酸钠(分析纯,天津光复精细化工研究所);七水合硫酸亚铁(分析纯,天津光复精细化工研究所);乙二胺四乙酸二钠(分析纯,天津光复精细化工研究所);腐殖酸(分析纯,麦克林生化科技有限公司);黄腐酸(分析纯,麦克林生化科技有限公司);抗坏血酸(分析纯,国药集团化学试剂有限公司);乙酸(分析纯,天津光复精细化工研究所),乙酸铵(分析纯,天津光复精细化工研究所);1,10-菲咯啉(分析纯,天津光复精细化工研究所);氮气(长春巨洋气体有限责任公司)
1.2 实验仪器
分析天平(PL203,梅特勒-托利多仪器公司);pH计(PHB-4,上海雷磁);ORP计(PHB-4,上海雷磁);磁力搅拌器(HJ-6A,金坛市医疗仪器厂);紫外-可见分光光度仪(EVOLUTION 201,赛默飞世尔科技公司);高效液相色谱仪(Agilent1100,美国 Agilent);气相色谱-质谱联用仪(Agilent 6890/5973,美国Agilent)
1.3 实验方法
实验在250mL密封瓶中进行,取200mL浓度为10mg/L的PNP溶液,持续通入30min以上的氮气用于驱替溶液的溶解氧.随后依次投入一定量的LQ和STPP,搅拌使其完全溶解.用1mol/L的HCl和NaOH将溶液的 pH值调到 5.0,最后向其中加入一定量的FeSO4,实验计时开始.反应过程中,在既定时间用注射器扎针取样取出 0.5mL样品,然后迅速加入足量的 1,10-菲咯啉溶液终止反应.如无特殊说明,体系Fe2+浓度为25mmol/L,STPP浓度为6.25mmol/L,LQ浓度为50mg/L.每组设3个平行样取平均值,实验数据的标准误差不超过5%.
1.4 测试方法
1.4.1 高效液相色谱法 运用高效液相色谱法测定 PNP的含量.色谱柱型号为 SB-C18(4.6mm×250mm,5μm),采用等度洗脱,流动相比例为乙腈:0.1%甲酸=50:50.进样量为20μL,流速为1mL/min,柱温为 30°C,VWD 波长为 317nm,出峰时间为 2.2min左右.LQ的测试方法:色谱柱型号和洗脱方式同上,流动相比例为甲醇:水=60:40.进样量为20μL,流速为 1mL/min,柱温为 30°C,VWD 波长为269nm,出峰时间为1.4min左右.
1.4.2 气相色谱-质谱(GC-MS)联用法 GC-MS样品前处理过程如下:在不同的反应时间(0,10,45,120,240min)收集200mL样品,加入乙酸乙酯进行萃取,将上层清液取出加入适量无水硫酸钠干燥脱水,将脱水后的溶液迅速倒入 65℃的旋转蒸发仪中,蒸发浓缩后用 0.22μm滤膜过滤得到 GC-MS所需的样品.测试条件如下:以不分流模式注入1μL样品,色谱柱温度以20℃/min的速度从40℃升到200℃保持4min,以 10℃/min的速度从 200℃升到 250℃保持5min.在EI模式下获得质谱,电子能量为70eV.
1.4.3 不同价态铁离子的测试方法 可溶性铁的浓度采用 1,10-菲咯啉显色法测定[20].Fe2+在pH=3~9时与1,10-菲咯啉反应生成稳定的橙红色络合物,橙红色络合物的吸光度与浓度的关系符合朗伯-比尔定律,可通过测定橙红色络合物在510nm波长处的吸光度换算出溶液中Fe2+的浓度.加入抗坏血酸将Fe3+还原为Fe2+,由此可以得到总铁的浓度.溶液中的浓度可通过式(1)和式(2)计算得到.应用Excel2010、OriginPro8.5进行数据分析处理与作图.

式中:A为吸光度;CtotalFe为溶液中总铁浓度,CFe2+为溶液中Fe2+浓度,CFe3+为溶液中Fe3+浓度.
2 结果与讨论
2.1 体系组分对PNP还原的影响
对比不同体系组分时PNP的还原效果,如图1所示,单独 Fe2+、单独 LQ、Fe2+/STPP 体系、Fe2+/LQ体系对 PNP几乎均无还原效果.在 Fe2+/STPP/LQ体系中,前10min内PNP迅速还原,之后几乎不再变化,在240min时PNP的还原率达31.2%,证明只有在 Fe2+、STPP、LQ三者均在的情况下才可以还原PNP.

图1 不同组分体系中PNP的还原效果Fig.1 Reduction effect of PNP in different Component systems
2.2 初始pH值对PNP还原的影响
由图2(a)可知,在反应240min内,初始pH值为3,5,7,9时体系对PNP均有一定的还原效果.体系最佳反应在pH=5.在pH=3条件下PNP还原效果略有下降,这是因为水中过多的 H+会使 STPP发生质子化,丧失 STPP的配位络合作用.pH=9时,铁离子与OH-易形成沉淀抑制Fe2+提供电子的能力.因此实验选取pH=5进行后续的研究.
2.3 不同DOM对PNP还原的影响
如图2(b)所示,与LQ作为电子穿梭体的体系相比,腐殖酸和黄腐酸作为电子穿梭体的体系对 PNP的还原效果均没有LQ作为电子穿梭体还原PNP的效果好,这是因为腐殖酸和黄腐酸等腐殖质的氧化还原电位都偏高[21],与 Fe3+/Fe2+的氧化还原电位相近.相较于腐殖酸和黄腐酸而言,LQ更易被Fe2+还原,因此选用LQ作为代表性有机质.
2.4 不同配体对PNP还原的影响
如图2(c)所示,与PNP在Fe2+/STPP/LQ体系中的还原相比,Fe2+/EDTA/LQ体系对PNP几乎无还原效果.根据 Wang等[10]的研究可知,加入 EDTA 后Fe3+/Fe2+的氧化还原电位仅降至150mV,而加入TPP后,Fe3+/Fe2+的氧化还原电位降至-230mV.LQ的氧化还原电位为-137mV,只有当 Fe3+/Fe2+的氧化还原电位低于 LQ的氧化还原电位时,Fe2+才可以向 LQ传递电子,因此EDTA作为配体时体系无法还原PNP,而STPP作为配体时体系才可以还原PNP.
2.5 LQ、STPP浓度对PNP还原的影响
如图2(d)和图2(e)所示,在实验范围内,随着LQ浓度的增加,PNP的去除率逐渐提高,但 LQ浓度达到50mg/L后PNP的去除率不再升高,不同STPP浓度的条件下对 PNP的还原效果没有明显差别.Hakala等[22]利用 Fe(II)和 DOM 还原五氯硝基苯的研究结果表明,体系的反应性不受DOM 的浓度和种类的显著影响,这是因为电子穿梭体介导的还原反应的动力学主要受热力学参数的控制,即电子穿梭体的氧化还原电位,因此STPP对于 LQ介导 Fe2+还原 PNP的过程仅起到降低Fe3+/Fe2+氧化还原电位的作用,STPP浓度对PNP还原的影响较小.分别选用LQ浓度为50mg/L、STPP浓度为6.25mmol/L进行后续的实验.
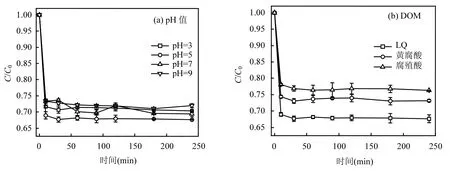

图2 不同条件因素对PNP还原的影响Fig.2 Effect of different conditions on reduction of PNP
2.6 Fe2+浓度对PNP还原的影响
如图2(f)所示,当Fe2+浓度从6.25mmol/L增加到25mmol/L时,PNP还原率逐渐增加,这表明污染物的还原率主要与 Fe2+浓度有关,即电子供体的可转移电子量,但Fe2+浓度为25和75mmol/L的还原曲线几乎重合,这是由于PNP还原受LQ的电子转移能力限制.选用Fe2+浓度为25mmol/L进行后续的实验.
2.7 LQ介导Fe2+-STPP还原PNP机理研究
2.7.1 反应过程中铁离子浓度以及 ORP的变化图 3(a)为用 1,10-菲咯啉水合物分光光度法测定的体系中溶解的 Fe2+、Fe3+、总铁(TFe)的含量变化.在反应前10min内,Fe2+含量迅速下降至0,Fe3+含量不断升高,TFe含量几乎无变化,10min后Fe2+、Fe3+、TFe含量不再变化.说明在前10min内Fe2+向LQ传递电子,Fe2+失去电子变成Fe3+,使得Fe3+浓度不断升高,因此PNP只有在前10min有还原效果,10min后体系中没有Fe2+,PNP不再还原.如图3(b)所示,ORP在 10min时迅速下降到最低值-129mV,且反应过程中ORP始终处于负值,说明体系处于还原环境.
2.7.2 LQ的定性定量分析 LQ含量的变化如图3(c)所示,LQ在前10min内迅速减少,随后LQ含量几乎不再变化.Scott等[16]采用电子自旋共振(ESR)技术测定了腐殖质中有机自由基的含量,ESR谱图的结果表明,醌能参与可逆的电子转移反应依赖于半醌自由基(图 4),半醌自由基含量与电子接受能力有直接关系,证明半醌自由基是醌类化合物作为电子穿梭体的关键因素.从热力学的角度讲,只有当醌类化合物的氧化还原电位介于电子供体和电子受体之间时才能起到电子穿梭体的作用[23],这解释了只有 Fe2+、STPP、LQ三者均在时才能还原PNP:在无配体存在时,E(Fe3+/Fe2+)=0.77V,E(LQ)=-0.137V,Fe3+/Fe2+的氧化还原电位远高于 LQ的氧化还原电位,所以单独Fe2+不能将电子传递给 LQ生成半醌自由基.Zhang等[24]研究发现加入STPP后,E(Fe3+/Fe2+)降至-0.23V,Fe3+/Fe2+的氧化还原电位低于 LQ的氧化还原电位,Fe2+可以向 LQ 传递电子生成半醌自由基,进而由半醌自由基还原PNP,LQ在Fe2+-STPP和PNP之间起到电子穿梭体的作用.GC-MS测定的LQ中间产物结果如表1所示,检测结果显示部分LQ生成了非醌类副产物.Uchimiya等[19]的研究表明,当醌基团接受电子发生副反应时,生成物不是半醌自由基中间体,而是非醌类的副产物,生成副产物后醌基团的电子转移反应可能是不可逆的,无法起到强化电子转移的作用.用紫外-可见分光光度计(UV-vis)对反应前后的LQ进行了全波长扫描,结果如图5所示,可以看出,LQ特征吸收峰的波长向长波方向移动,且吸收强度增加,发生了红移效应和增色效应,这说明了LQ在反应过程中引入了含有未共享电子对的基团,结合 GC-MS的检测结果分析,LQ引入的基团为羟基基团.反应结束后,LQ的特征吸收峰并未回到初始波长,说明LQ在接受电子后一部分发生的反应不可逆,这证明了LQ在充当氧化还原介体时一部分被还原为非醌副产物.这解释了 LQ浓度对 PNP还原的影响:一部分LQ 转化为副产物,并未起到电子穿梭体的作用,因此随着LQ浓度增加PNP的还原效果越好,当LQ浓度达到饱和,过量的LQ并未溶解,未溶解的LQ不能介导Fe2+还原PNP,因此PNP的去除率不再提高.由LQ含量的测定可计算出,58.4%的LQ接受Fe2+传递的电子后转换成非醌类化合物,此过程的电子转移是不可逆的,LQ的含量逐渐减少;其余部分LQ接受电子变成半醌自由基中间体,再将电子传递给 PNP,因此Fe2+-STPP传递给LQ的电子利用率较低.

图3 反应过程中铁离子浓度、ORP、LQ浓度的变化Fig.3 Changes of iron ion concentration,ORP,and LQ concentration during the reaction

图4 LQ及LQ转化的半醌自由基Fig.4 LQ and semiquinone radical converted from LQ

图5 反应过程中的UV-vis扫描图谱Fig.5 UV-vis during the reaction

表1 中间产物测定结果Table 1 Intermediate product measurement result
2.7.3 体系中剩余 LQ 的作用 在反应结束后,继续向体系中投加一定量的FeSO4和STPP,检测PNP的浓度变化.结果如图 6所示,反应结束后继续投加FeSO4和STPP使体系对PNP有了进一步的还原效果,这一结果有力地证明了剩余部分的LQ还能起到电子穿梭体的作用.


图6 反应240min时投加药品对还原PNP的影响Fig.6 Effect of Adding Drugs on Reduction of PNP at 240min
2.7.4 PNP还原产物的测定 通过GC-MS对Fe2+/STPP/LQ体系中PNP的还原产物进行测定,结果如图7所示,可以明显地看到LQ和非醌产物的色谱峰,但是未发现PNP及其产物的色谱峰,这是由于PNP及其产物的出峰时间与LQ及非醌产物的出峰时间相近,PNP及其产物的色谱峰被LQ及非醌产物的色谱峰覆盖,因此无法使用GC-MS法对PNP及其还原产物进行定性和定量分析.随后通过 HPLC法对推测的 PNP产物(对氨基酚)进行定量分析,同样因为被LQ及非醌产物的色谱峰覆盖而无法检测.受现有的实验仪器限制,本文无法直接验证 PNP的还原产物.根据反应过程中体系始终处于还原环境及Hakala等[22]使用Fe(II)和DOM将五氯硝基苯还原为五氯苯胺的研究成果,可推测 PNP的还原产物为对氨基酚.
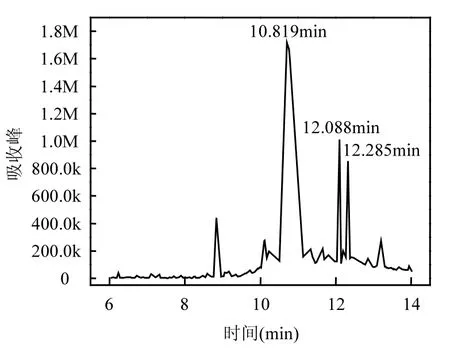
图7 GC-MS检测结果Fig.7 GC-MS measurement result
3 结论
3.1 在厌氧条件下 LQ介导 Fe2+-STPP还原PNP受初始 pH条件影响较小,pH=5时还原效果最佳;STPP浓度对还原PNP的影响不大,LQ和Fe2+浓度是影响PNP还原的主要因素.
3.2 在LQ介导Fe2+-STPP厌氧还原PNP过程中,前10min内Fe2+迅速将电子转移给LQ,Fe2+浓度降低,Fe3+浓度快速增加,10min后不同价态铁离子浓度几乎不再变化.
3.3 在LQ介导Fe2+-STPP厌氧还原PNP过程,LQ接受电子后主要生成非醌类副产物,形成副产物部分的电子反应不可逆,只有少部分LQ接受电子后变成半醌自由基还原PNP,因此Fe2+-STPP传递给LQ的电子利用率较低.
