拉曼光谱在妊娠糖尿病诊断中的应用价值
2021-03-30周丽芳唐振华
周丽芳,潘 顺,唐振华
[上海交通大学附属国际和平妇幼保健院检验科 上海胚胎源性疾病重点实验室上海市临床重点专科(建设项目)-强主体妇产科,上海 200030]
目前,妊娠糖尿病(gestational diabetes mellitus,GDM)的诊断多采用口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)[1],但OGTT需要多次采血,诊断敏感性为80%~85%,且影响因素较多,易导致漏诊或误诊[2]。拉曼光谱是分子或晶格振动能级光子产生的非弹性散射光谱。由于分子中不同化学键的振动模式会导致拉曼光谱特征峰的强度和线宽发生变化,因此从所获得的拉曼光谱可以推断物质中分子的结构和组成[3]。由于拉曼光谱适用于液体基质检测,因此已有将其用于2型糖尿病等疾病诊断的报道[4]。但目前尚未见拉曼光谱应用于GDM的报道。因此,本研究拟探讨拉曼光谱在GDM中的应用价值。
1 材料和方法
1.1 研究对象
选取2018年10月—2019年4月上海交通大学附属国际和平妇幼保健院GDM患者42例[年龄(29.84±6.53)岁,GDM组]、正常妊娠妇女29例[年龄(28.96±7.81)岁,正常妊娠组]、非孕体检健康者29名[年龄(30.86±6.85)岁,正常对照组],用于方法学建立。另选取同期上海交通大学附属国际和平妇幼保健院78例GDM患者[年龄(29.28±5.96)岁]和70名女性体检健康者[年龄(28.71±7.93)岁]用于方法学评价。所有的GDM患者均采用国际糖尿病与妊娠研究组(the International Association of the Diabetes and Pregnancy Study Groups,IADPSG)推荐方法[5]确诊。
1.2 方法
采集所有对象空腹静脉血,离心分离血清后采用XploRA PLUS全自动共聚焦拉曼光谱仪(日本HORIBA公司)进行检测。拉曼光谱仪的检测原理见图2。测定条件:激光波长785 nm,激光功率90 mW。操作步骤:取3 μL血清样本滴加在铝板上,自然干燥后,每个样本选择5个点,使用XploRA PLUS全自动共聚焦拉曼光谱仪测定。每个点的时间积分为15 s,每份样本采集3~5个光谱数据。
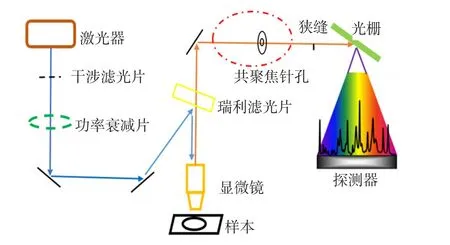
图1 拉曼光谱仪检测原理
1.3 拉曼光谱的处理
获得的拉曼光谱先去除背景荧光,然后使用Origin 8.0和Raman基线软件对光谱进行基线校正和平均化,分析800~1 800 cm-1范围内的拉曼波数(共计1 026个数据点)。根据文献[6]对拉曼峰进行归属指认。
1.4 统计学方法
在MATLAB R2015b软件平台上用采用正交偏最小二乘回归(orthogonal Partial least squares regression,OPLS)、主成分分析(principal component analysis,PCA)-支持向量机(support vector machine,SVM)及PCA-隐含狄利克雷分布(latent dirichlet allocation,LDA)3种分类模型对得到的拉曼光谱进行分类,筛选出拉曼光谱特征峰,采用受试者工作特征(receiver operating characteristic,ROC)曲线评价3种模型的分类能力,计算准确度、敏感性、特异性、阳性预测值、阴性预测值。
2 结果
2.1 GDM组、正常妊娠组及正常对照组的拉曼光谱分析
GDM组、正常对照组和正常妊娠组的拉曼光谱形状和趋势相似,但在强度上有一定差异。在856.61和1 034.47 cm-1处,GDM组的拉曼光谱峰强度低于正常妊娠组及正常对照组。在1 005.86、1 128.39和1 657.00 cm-1处,GDM组的拉曼光谱峰强度均高于正常对照组,但低于正常妊娠组。在1 159.66、1 442.32和1 523.06 cm-1处,GDM组拉曼光谱峰强度高于正常妊娠组和正常对照组。在1 343.69和1 523.06 cm-1处,GDM组有明显的小拉曼光谱峰,而正常妊娠组和正常对照组在此处无明显的拉曼光谱峰。
与正常对照组比较,GDM组有2个拉曼光谱峰出现左移(1 004.00 cm-1左移为1 005.86 cm-1,1 442.32 cm-1左移为1 445.00 cm-1),2个拉曼光谱峰右移(1 159.66 cm-1右移至1 157.00 cm-1,1 657.00 cm-1右移为1 655.00 cm-1)。见图2。拉曼光谱峰归属指认结果见表1。
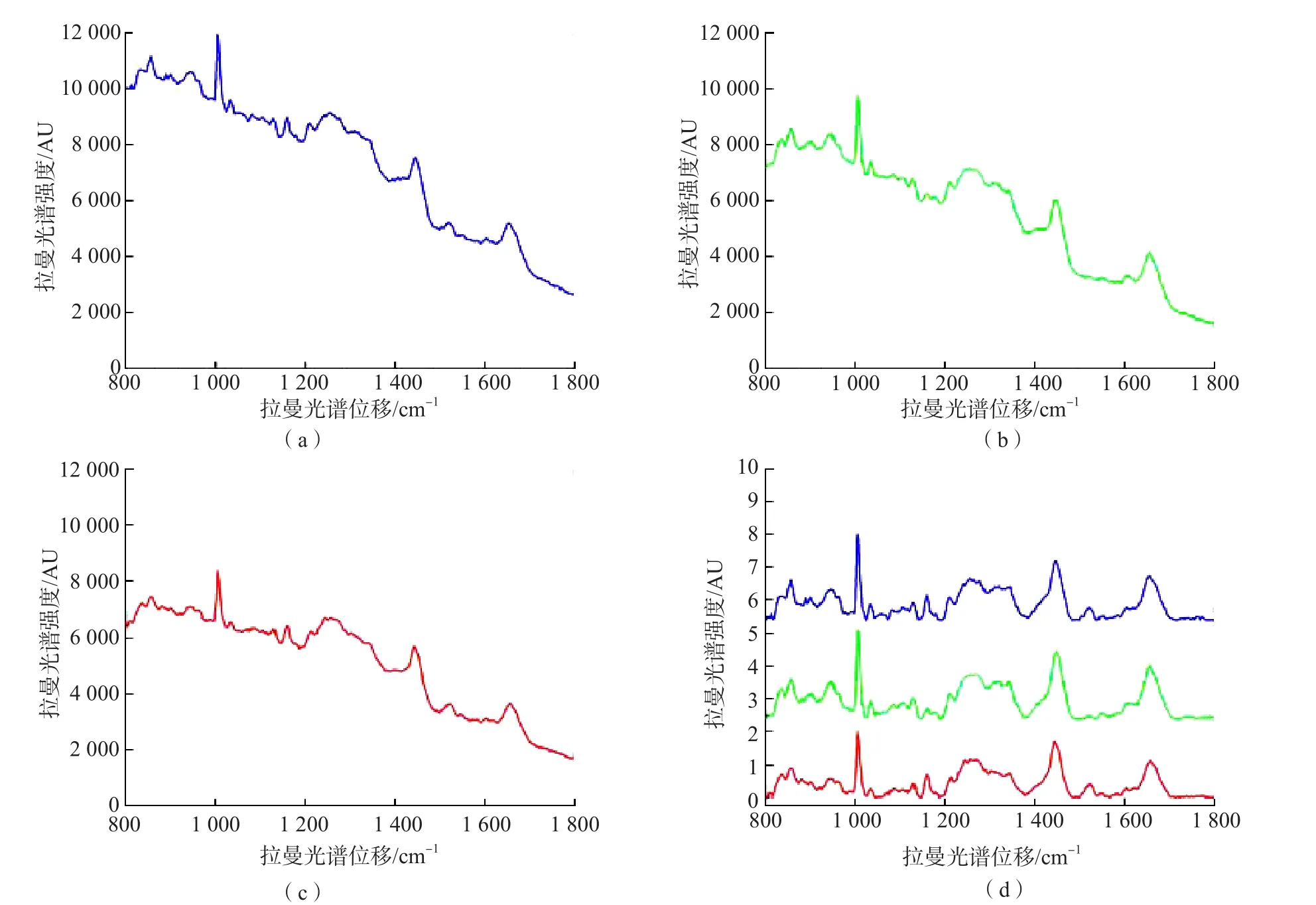
图2 GDM组、正常妊娠组及正常对照组的原始拉曼光谱图
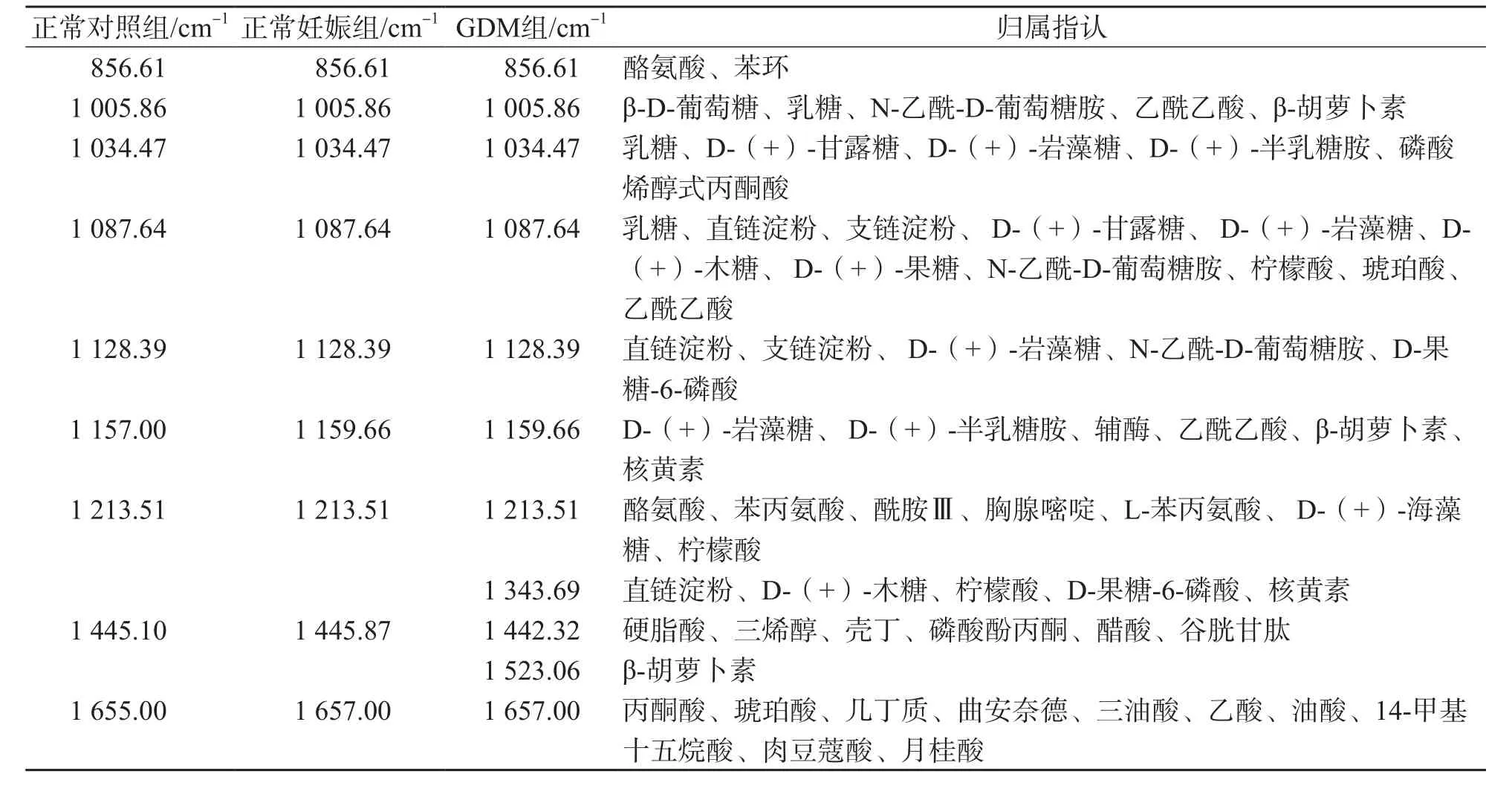
表1 各组拉曼光谱峰归属指认表
2.2 PCA-SVM、PCA-LDA和OPLS 3种模型对拉曼光谱分类能力的评价
采用PCA-SVM、PCA-LDA和OPLS 3种模型对所得拉曼光谱进行分析。结果显示,GDM组、正常妊娠组及正常对照组在1 005.86、1 034.47、1 128.39和1 343.69 cm-1处有明显差异,见图3。PCA模型可以区分GDM组和正常妊娠组、正常对照组,但无法区分正常妊娠组与正常对照组。OPLS模型对GDM组、正常对照及正常妊娠组的区分能力更强,见图4。
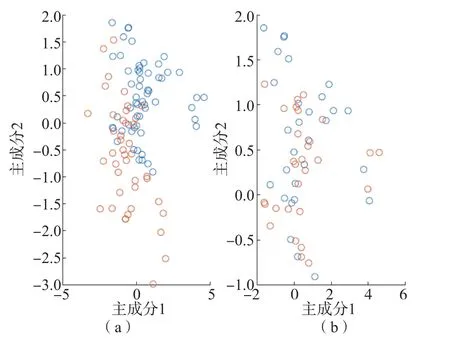
图3 PCA模型区分GDM组、正常对照组及正常妊娠组的散点图
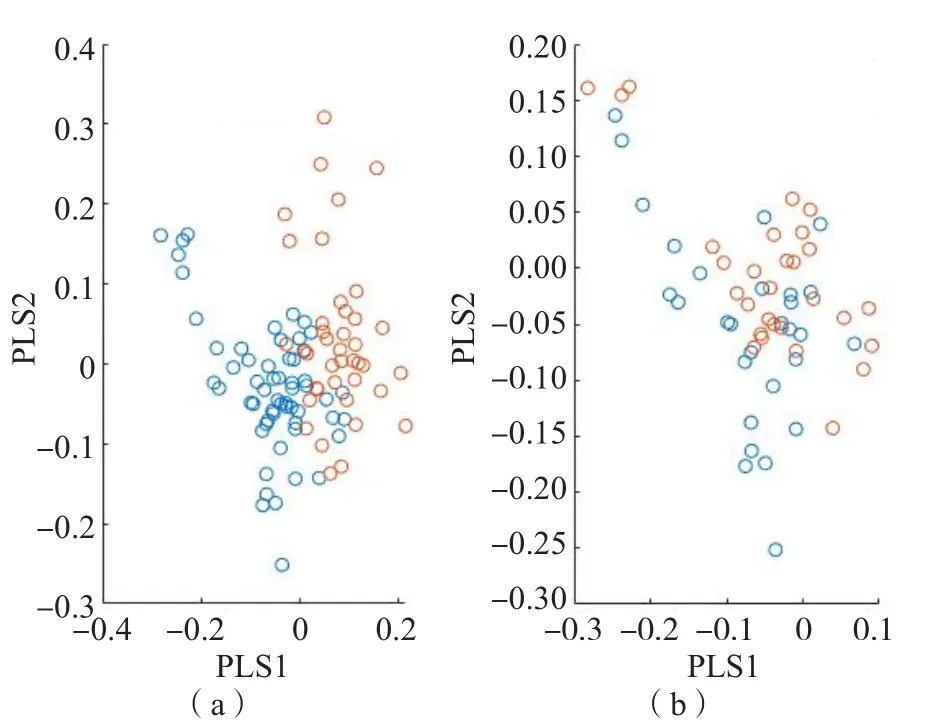
图4 OPLS模型区分GDM组、正常对照组及正常妊娠组的散点图
ROC曲线分析结果显示,PCA-SVM模型、PCA-LDA模型和OPLS模型区分拉曼光谱的曲线下面积(area under curve,AUC)分别为0.91、0.97、0.97,准确度分别为90.34%、91.16%、96.09%,敏感性分别为91.33%、93.00%、100.00%,特异性分别为88.00%、88.50%、90.50%,阳性预测值分别为92.29%、92.98%、94.29%,阴性预测值分别为91.81%、92.00%、100.00%,见表2、图5。

表2 PCA-SVM模型、PCA-LDA模型和OPLS模型对拉曼光谱分类能力的评价 %
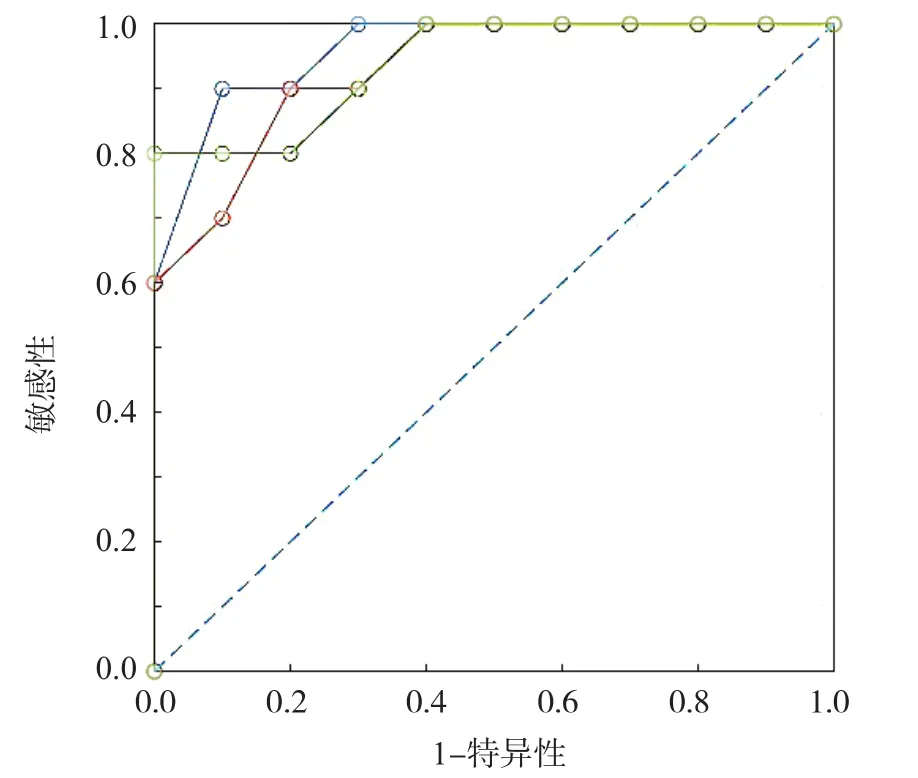
图5 PCA-LDA模型、PCA-SVM模型和OPLS模型判断拉曼光谱分类能力的ROC曲线
2.3 拉曼光谱诊断GDM的价值
采用OPLS模型对GDM患者的拉曼光谱进行区分,并与OGTT进行比较。在78例GDM患者和70名正常对照者中,OGTT有2例假阳性、7例假阴性,敏感性为91.03%,特异性为97.14%,准确度为93.92%,阳性预测值为97.26%,阴性预测值为90.67%;拉曼光谱有5例假阳性、2例假阴性,敏感性为97.43%,特异性为92.86%,准确度为95.27%,阳性预测值为93.83%,阴性预测值为97.01%。
3 讨论
由于拉曼光谱技术在物质检测方面具有高效、简便、无破坏性、成本低、样本量少、样本无需特殊制备、可重复性高且不会对样本造成物理和化学分解等特点,已被广泛应用于化工、刑侦、珠宝鉴定、地质勘探、生物制药以及医学检验等领域,是目前无损分析检测领域的热点[7-9]。近年来,利用拉曼光谱技术开展的各项病变组织的检测和疾病诊断分析在医学界被广泛关注,并在病原微生物的鉴定、肿瘤的早期鉴别与诊断、药物动力学的监测分析、骨科疾病等多个医学领域开展了相应的研究[10-13]。由于拉曼光谱比较适用于液体基质检测,国内外已经有学者将其应用于糖尿病的诊断。LIN等[14]的研究结果显示,基于银纳米粒子的Raman-oxyhb-sers方法与多元统计分析相结合,对2型糖尿病的无标签检测具有很大价值,其诊断准确率分别为90.0%(PLS模型)和95.5%(PCA-LDA模型)。BIRECH等[15]利用拉曼光谱研究了亮氨酸和异亮氨酸作为2型糖尿病生物标志物的潜力,结果显示拉曼光谱在糖尿病的筛查和快速(10 s)诊断方面具有巨大的潜力,该方法还可作为吡格列酮与当地使用的抗糖尿病中药提取物疗效比较研究的替代方法。
本研究采用的XploRA PLUS全自动共聚焦拉曼光谱仪可以显著提高空间分辨率(纵向<2 μm,横向<1 μm),并可有效减少荧光干扰。本研究结果显示,GDM组的拉曼光谱峰与正常对照组的拉曼光谱峰有一定差异。在1 005.86、1 034.47、1 087.64和1 128.39 cm-1处均出现较明显的拉曼光谱峰,通过拉曼位移归属指认,这4个拉曼光谱峰均含有糖化基团,说明拉曼光谱可以反映血清中糖化学结构的改变。在1 005.86、1 034.47、1 128.39和1 343.69 cm-1处,GDM组、正常妊娠组及正常对照组之间有明显差异;且在1 343.69 cm-1处,GDM组有明显的拉曼光谱峰,而正常妊娠组和正常对照组在此处无明显的拉曼峰。归属指认发现拉曼光谱特征峰1 343.69 cm-1主要代表直链淀粉、D-(+)-木糖、柠檬酸、D-果糖-6-磷酸、核黄素。本研究根据以上拉曼光谱特征峰,分别用PCA-SVM模型、PCA-LDA模型和OPLS模型进行分类,结果显示OPLS模型对GDM患者的拉曼光谱具有较好的分类能力。采用OPLS模型区分拉曼光谱诊断GDM的敏感性、准确度高于OGTT,但特异性低于OGTT。因此,拉曼光谱在GDM的早期筛查中可能更具优势。另外,与OGTT比较,检测拉曼光谱只需要采集1次空腹血清,可有效减少孕妇抽血次数。拉曼光谱还可直接从分子层面判断糖化基团,较少受到时间等因素的影响,可降低漏诊率。
综上所述,拉曼光谱结合OPLS模型诊断GDM的敏感性、特异性和准确度均较好,或可用于GDM的筛查和诊断。
