脑苷肌肽联合甲氯芬酯治疗急性脑出血的疗效及对血清MMP-2/9、TSP-1/2、神经相关因子的影响
2021-03-29马雪周世辉
马雪 周世辉
锦州医科大学附属第一医院(辽宁锦州121000)
急性脑出血(acute cerebral hemorrhage,ACH)是临床常见脑血管疾病,具有发病急骤、病情进展迅速等特点,据统计,其发病率占所有急性脑血管病的20%~30%,且死亡风险较高,需给予重视[1-2]。多项研究[3-4]证实,ACH 发病与全身性血管病变密切相关,仅采取利尿、降低颅内压等常规治疗虽于短时间内可取得良好疗效,但远期预后较差。故应在常规治疗基础上给予更可靠治疗方案,以改善预后。盐酸甲氯芬酯属于脑细胞保护剂,可直接作用于患者大脑皮质,加快脑细胞功能活化,促进神经功能恢复[5]。脑苷肌肽属于促神经功能修复的新型药物,在脑血管疾病中应用广泛[6]。但关于两者联合在ACH 中的应用价值仍缺乏循证依据。基于此,本研究初次尝试将脑苷肌肽与甲氯芬酯联用治疗ACH,结果显示,观察组不仅治疗总有效率显著提高,还可抑制炎性因子表达,可见脑苷肌肽与甲氯芬酯联用疗效显著,降低炎症反应程度。
1 资料与方法
1.1 一般资料选取2017年11月至2020年2月我院123例ACH患者,依据随机数字表法分为3组,各组41 例。3 组年龄、性别、出血部位、出血量、发病原因比较,差异无统计学意义(P>0.05),有可比性,见表1。本研究经我院伦理委员会审批通过。

表1 3 组一般资料Tab.1 General information of 3 groups 例(%)
1.2 病例选择标准
1.2.1 纳入标准均经头颅CT 或MRI 检查证实为ACH,且符合《中国脑出血诊治指南(2014)》中ACH 相关诊断标准[7],对患者进行全面评估,包括病史、一般检查、神经系统检查和有关实验室检查,特别是血常规、凝血功能和影像学检查;患者及家属均知情,签订知情承诺书。
1.2.2 排除标准伴有颅内血管畸形者;心肝肾等重要脏器严重功能异常者;对本研究相关药物过敏或存在禁忌者;存在急慢性感染性疾病、自身免疫性疾病者;既往有脑卒中、脑外伤史者;合并恶性肿瘤者;伴有脑疝者;濒临死亡者。
1.3 方法3 组均给予营养支持、降低颅内压、控制血压、利尿、调节酸碱及水电解质平衡、脑保护剂及吸氧等常规治疗。
1.3.1 对照A 组予以脑苷肌肽(吉林振澳制药有限公司,国药准字H22025066,规格:10 mL),20 mL+5%葡萄糖注射液250 mL,静脉滴注,1 次/d。
1.3.2 对照B 组予以甲氯芬酯(南京圣和药业股份有限公司,国药准字H20054399,规格:0.25 g),250 mg+5%葡萄糖注射液250 mL,静脉滴注,1次/d。
1.3.3 观察组予以脑苷肌肽与甲氯芬酯联合治疗,脑苷肌肽治疗方法同对照A 组,甲氯芬酯治疗方法同对照B 组。3 组均持续治疗2 周。
1.4 检测方法于两组治疗前和治疗1、2 周后采集空腹静脉血4 mL,离心处理,2 500 r/min,15 min,取上清液,保存于-70 ℃恒温冰箱内,待检。采用酶联免疫吸附试验法检测血清基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)、血小板反应蛋白1(thrombospondin 1,TSP-1)、血小板反应蛋白2(thrombospondin 2,TSP-2)、脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、神经元特异性烯醇化酶(neuron specific enolase,NSE)、神经生长因子(nerve growth factor,NGF)、神经胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)水平,试剂盒购自法国梅里埃公司,所有操作符合规范。
1.5 临床病情程度评定患者在入院时使用NIHSS量表对每位患者神经功能缺损情况进行评价,分数越高表示神经功能缺损越严重,NIHSS≤14 分为轻中度缺损,NIHSS≥15 分为重度缺损。
1.6 观察指标(1)临床疗效。(2)3 组治疗前和治疗1、2周后绝对、相对脑水肿体积,行头颅MRI 检查,绝对脑水肿体积=脑水肿外缘体积-脑血肿体积;相对体积=脑水肿外缘体积/脑血肿体积。(3)3 组治疗前和治疗1、2 周后血清MMP-2/9、TSP-1/2 水平。(4)3 组治疗 前 和 治疗1、2 周 后 血 清BDNF、NSE、NGF、GFAP 水平。(5)治疗后随访4周,比较3 组治疗前和治疗后2、4 周NIHSS 评分、改良Rankin 量表(mRS)评分,其中NIHSS 评分总分0~42 分,分值越低,提示神经功能恢复越好;mRS 评分:0~6 分,分数越高,预后越差。
1.7 统计学方法采用SPSS 22.0 软件进行统计学分析,计量资料经检验符合正态分布,以均数±标准差对数据进行描述,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。计数资料用率或构成比进行描述,采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 三组临床疗效比较观察组治疗总有效率(95.12%)高于对照A、B 组(75.61%、78.05%),差异有统计学意义(P<0.05);对照A、B 组两组总有效率比较差异无统计学意义(P>0.05),见图1。
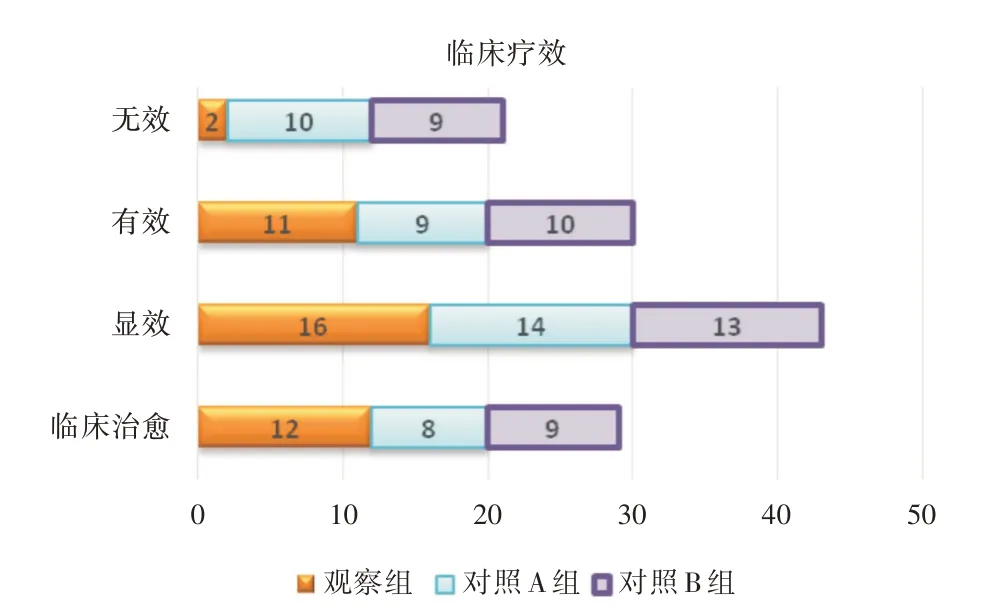
图1 3 组临床疗效Fig.1 Clinical efficacy of 3 groups
2.2 三组绝对、相对脑水肿体积比较治疗1、2 周后,观察组绝对、相对脑水肿体积低于对照A、B 组(P<0.05),见表2。
2.3 三组血清MMP-2/9、TSP-1/2 比较治疗1、2周后,观察组血清MMP-2/9、TSP-1/2 水平低于对照A、B 组(P<0.05),见表3。
表2 3 组绝对、相对脑水肿体积对比Tab.2 Comparison of absolute and relative brain edema volume in 3 groups ±s
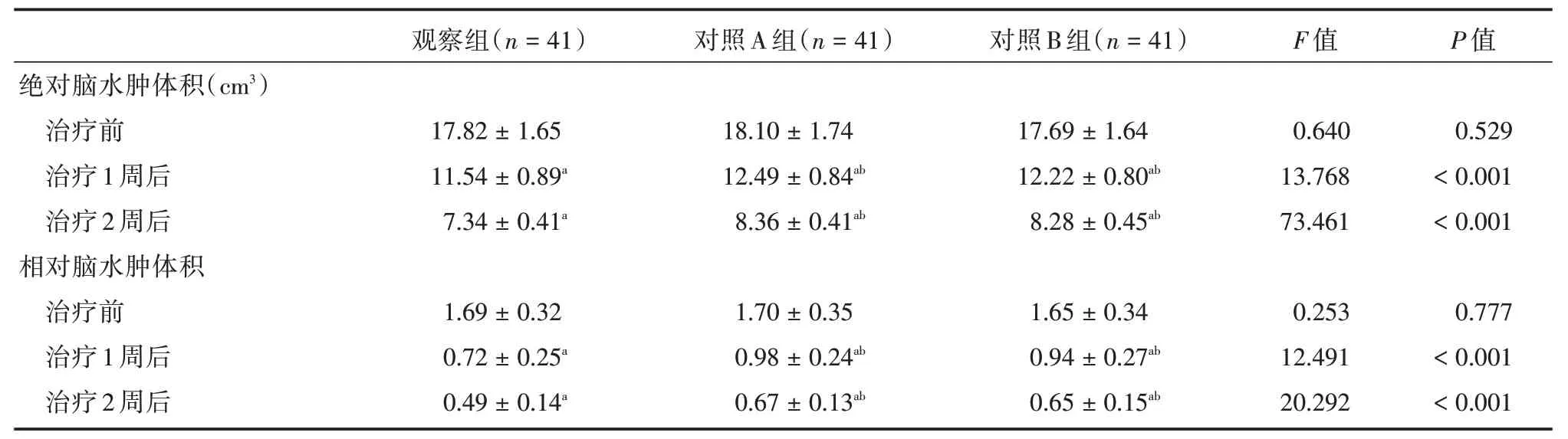
表2 3 组绝对、相对脑水肿体积对比Tab.2 Comparison of absolute and relative brain edema volume in 3 groups ±s
注:与同组治疗前相比,aP <0.05;与同时间点观察组比较,bP <0.05;与同时间点对照A 组比较,cP <0.05;与同时间点对照B 组比较,dP <0.05
绝对脑水肿体积(cm3)治疗前治疗1 周后治疗2 周后相对脑水肿体积治疗前治疗1 周后治疗2 周后观察组(n=41)17.82±1.65 11.54±0.89a 7.34±0.41a 1.69±0.32 0.72±0.25a 0.49±0.14a对照A 组(n=41)18.10±1.74 12.49±0.84ab 8.36±0.41ab 1.70±0.35 0.98±0.24ab 0.67±0.13ab对照B 组(n=41)17.69±1.64 12.22±0.80ab 8.28±0.45ab 1.65±0.34 0.94±0.27ab 0.65±0.15ab F 值0.640 13.768 73.461 0.253 12.491 20.292 P 值0.529<0.001<0.001 0.777<0.001<0.001
2.4 三组神经相关因子水平比较治疗1、2周后,观察组BDNF 水平高于对照A、B 组,NSE、NGF、GFAP 水平低于对照A、B 组(P<0.05),见表4。
2.5 三组NIHSS 评分、mRS 评分比较治疗后2、4 周,观察组NIHSS、mRS 低于对照A、B 组(P<0.05),见表5。
3 讨论
近年来,随着老龄化加剧,高血压性脑出血、动脉粥样硬化性脑出血发病率呈逐年升高趋势,且流行病学调查显示,ACH 患者病死率高达40%,防治形势较为严峻[8-9]。研究表明,药物治疗是改善、维持ACH 患者神经功能和生活自理能力的重要方式[10]。故积极探索合理、可靠的药物治疗方案至关重要。
李艳艳等[11]报道显示,针对ACH 患者在常规治疗基础上给予脑苷肌肽能提高疗效,加快神经功能恢复。张立明[12]研究表明,甲氯芬酯用于ACH 患者治疗中具有明显增效作用。在上述研究基础上,本研究发现,脑苷肌肽与甲氯芬酯联用治疗ACH 疗效显著。分析原因,脑苷肌肽是一种复方制剂,主要成分为神经节苷脂和多肽,可通过抑制兴奋性氨基酸释放,加快神经元修复,参与神经组织分化、修复及再生[13]。脑苷肌肽还能提高血液载氧能力,清除局部脑组织氧自由基,为神经功能恢复提供有利条件[14]。盐酸甲氯芬酯属于人工合成药物,可清除氧自由基、减少蛋白质交联,消除对神经细胞的损害,缓解炎症反应,从而减轻脑出血、脑水肿状态;且盐酸甲氯芬酯具有保护脑细胞作用,还可减少血浆内纤维蛋白原含量,促进其降解产物合成,达到改善脑循环,降低血管阻力,促进神经功能恢复的目的[15]。故脑苷肌肽与甲氯芬酯联用可从不同途径、机制强化疗效。同时,动物试验表明,ACH 大鼠伴有神经细胞凋亡现象[16]。NSE 是一种参与糖酵解途径的烯醇化酶;BDNF 属于具有神经营养作用的蛋白质,主要分布在中枢神经系统,两者均可反映神经功能缺损程度[17]。NGF、GFAP 亦是临床常见神经因子,在反映神经功能改变中具有重要作用[18-19]。本研究表明,单独应用时,脑苷肌肽对上述神经因子的调节作用优于甲氯芬酯,可能与脑苷肌肽较强的神经修复作用有关。两者联用则可显著改善上述神经因子,且明显优于两者单独应用,提示应将脑苷肌肽联合甲氯芬酯作为ACH 患者优先选择治疗方案。
表3 3 组血清MMP-2/9、TSP-1/2 水平对比Tab.3 Comparison of serum MMP-2/9 and TSP-1/2 in three groups ±s

表3 3 组血清MMP-2/9、TSP-1/2 水平对比Tab.3 Comparison of serum MMP-2/9 and TSP-1/2 in three groups ±s
注:与同组治疗前相比,aP <0.05;与同时间点观察组比较,bP <0.05;与同时间点对照A 组比较,cP <0.05;与同时间点对照B 组比较,dP <0.05
MMP-2(μg/mL)治疗前治疗1 周后治疗2 周后MMP-9(μg/mL)治疗前治疗1 周后治疗2 周后TSP-1(ng/mL)治疗前治疗1 周后治疗2 周后TSP-2(ng/mL)治疗前治疗1 周后治疗2 周后观察组(n=41)73.78±10.52 58.51±9.27acd 48.47±8.36acd 221.49±21.84 138.34±15.63acd 69.29±10.27acd 155.86±9.25 126.94±8.96acd 113.25±8.54acd 146.94±9.82 112.47±8.76acd 98.25±8.12acd对照A 组(n=41)74.52±11.57 69.84±8.12abd 58.41±7.69abd 225.69±24.59 158.36±16.85abd 86.24±12.36abd 157.84±9.63 145.85±9.74abd 126.37±8.96abd 147.82±9.29 126.94±9.83abd 112.69±8.69abd对照B 组(n=41)75.34±10.82 64.12±9.84abc 53.76±8.69abc 224.36±22.16 149.32±13.26abc 78.36±11.26abc 156.84±8.52 137.41±9.12abc 119.69±9.12abc 145.27±9.41 119.85±9.01abc 105.36±8.74abc F 值0.207 15.873 14.874 0.360 17.560 22.983 0.481 42.730 22.394 0.761 59.560 29.436 P 值0.813<0.001<0.001 0.698<0.001<0.001 0.620<0.001<0.001 0.470<0.001<0.001
表4 3 组神经相关因子相关因子对比Tab.4 Comparison of nerve related factors among 3 groups ±s
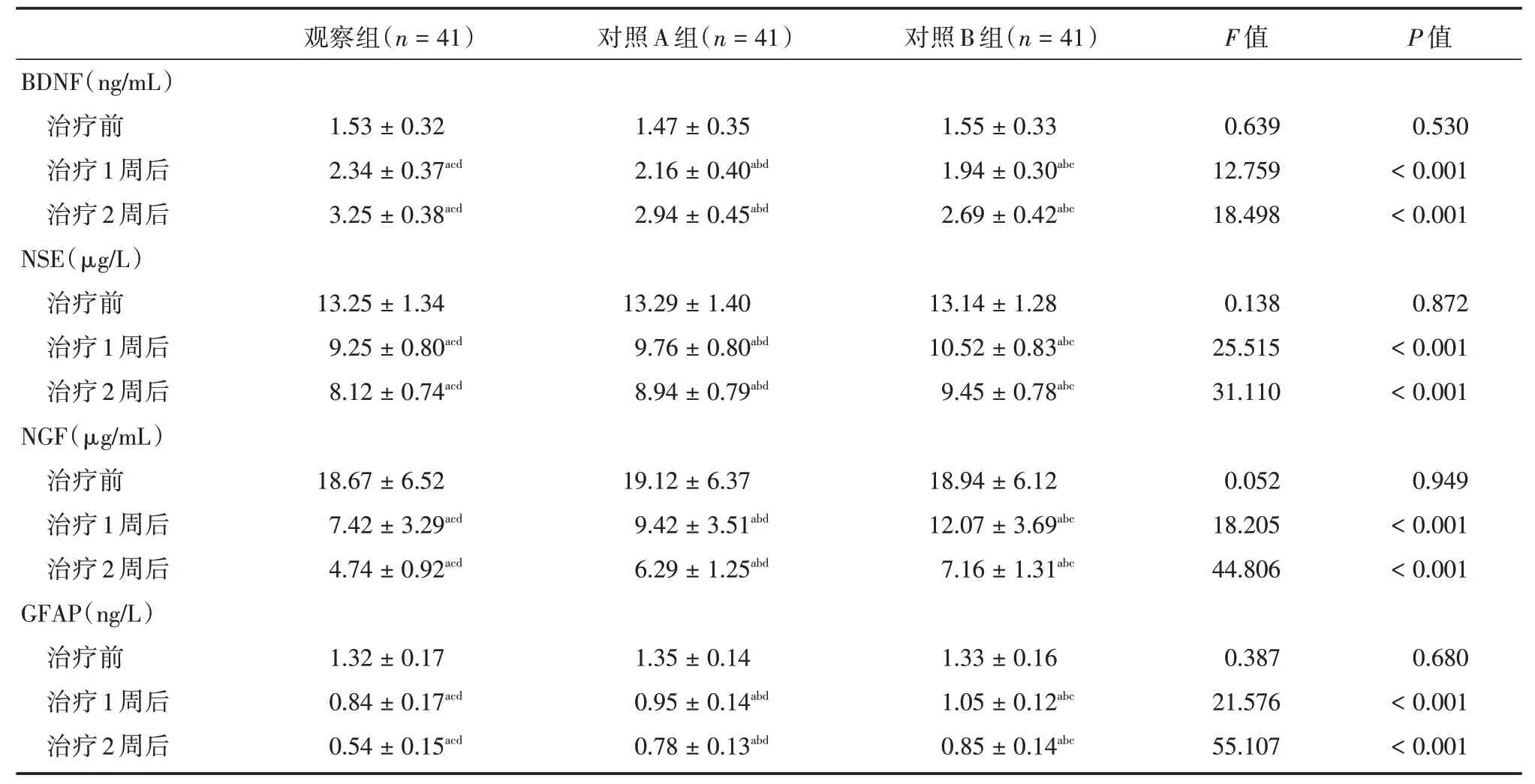
表4 3 组神经相关因子相关因子对比Tab.4 Comparison of nerve related factors among 3 groups ±s
注:与同组治疗前相比,aP <0.05;与同时间点观察组比较,bP <0.05;与同时间点对照A 组比较,cP <0.05;与同时间点对照B 组比较,dP <0.05
BDNF(ng/mL)治疗前治疗1 周后治疗2 周后NSE(μg/L)治疗前治疗1 周后治疗2 周后NGF(μg/mL)治疗前治疗1 周后治疗2 周后GFAP(ng/L)治疗前治疗1 周后治疗2 周后观察组(n=41)1.53±0.32 2.34±0.37acd 3.25±0.38acd 13.25±1.34 9.25±0.80acd 8.12±0.74acd 18.67±6.52 7.42±3.29acd 4.74±0.92acd 1.32±0.17 0.84±0.17acd 0.54±0.15acd对照A 组(n=41)1.47±0.35 2.16±0.40abd 2.94±0.45abd 13.29±1.40 9.76±0.80abd 8.94±0.79abd 19.12±6.37 9.42±3.51abd 6.29±1.25abd 1.35±0.14 0.95±0.14abd 0.78±0.13abd对照B 组(n=41)1.55±0.33 1.94±0.30abc 2.69±0.42abc 13.14±1.28 10.52±0.83abc 9.45±0.78abc 18.94±6.12 12.07±3.69abc 7.16±1.31abc 1.33±0.16 1.05±0.12abc 0.85±0.14abc F 值0.639 12.759 18.498 0.138 25.515 31.110 0.052 18.205 44.806 0.387 21.576 55.107 P 值0.530<0.001<0.001 0.872<0.001<0.001 0.949<0.001<0.001 0.680<0.001<0.001
表5 3 组NIHSS、mRS 评分对比Tab.5 Comparison of NIHSS,mRS scores of three groups±s
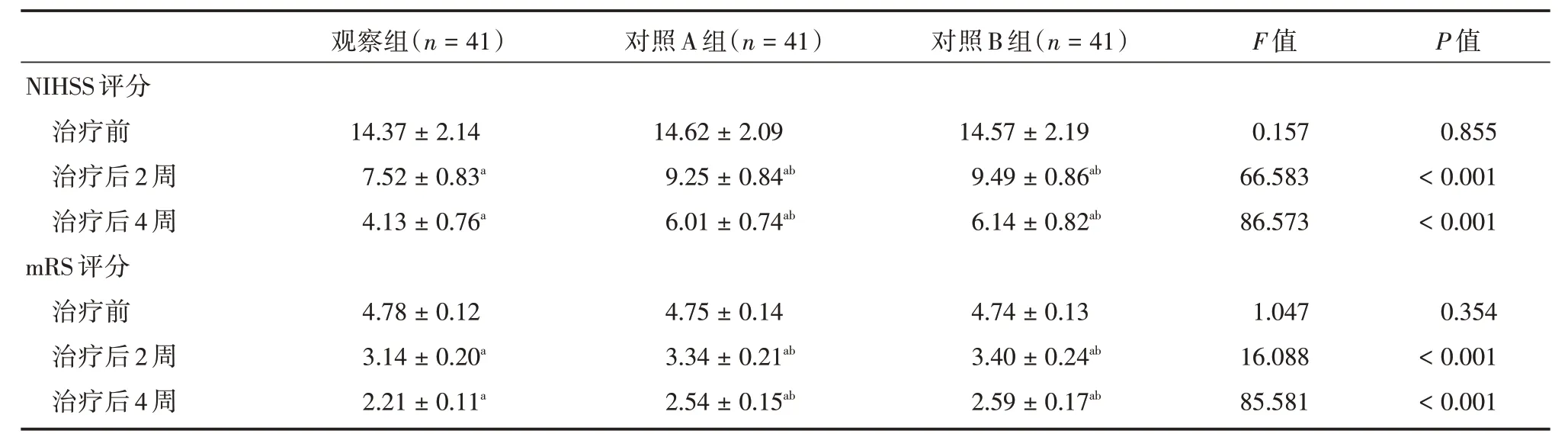
表5 3 组NIHSS、mRS 评分对比Tab.5 Comparison of NIHSS,mRS scores of three groups±s
注:与同组治疗前相比,aP <0.05;与同时间点观察组比较,bP <0.05;与同时间点对照A 组比较,cP <0.05;与同时间点对照B 组比较,dP <0.05
(n=41) 对照A 组(n=41) 对照B 组(n=41)F 值P 值7±2.1414.62±2.0914.57±2.190.1570.855 NIHSS 评分治疗前治疗后2 周治疗后4 周mRS 评分治疗前治疗后2 周治疗后4 周观察组14.3 7.52±0.83a 4.13±0.76a 4.78±0.12 3.14±0.20a 2.21±0.11a 9.25±0.84ab 6.01±0.74ab 4.75±0.14 3.34±0.21ab 2.54±0.15ab 9.49±0.86ab 6.14±0.82ab 4.74±0.13 3.40±0.24ab 2.59±0.17ab 66.583 86.573 1.047 16.088 85.581<0.001<0.001 0.354<0.001<0.001
研究[20]证实,ACH发生与进展由多种分子机制共同参与,其中MMPs 与TSP 可能发挥重要作用。MMP-2、MMP-9 可通过降解血管基底膜、迁移中性粒细胞,加重局部脑组织炎症反应,造成血脑屏障受损,从而引发脑水肿,导致脑出血病情恶化[21]。TSP-1、TSP-2 属于调节型基质糖蛋白有关家族成员,主要由被激活的内皮细胞、血小板、胶质细胞、神经元分泌,有关文献指出,ACH 患者因受到病变区域环境刺激,会明显增加TSP-1、TSP-2分泌量[22]。本研究发现,脑苷肌肽与甲氯芬酯联用能显著降低血清MMP-2/9、TSP-1/2 水平。分析原因,可能是由于脑苷肌肽具有修复神经元、加快神经组织再生、加速脑组织新陈代谢作用;盐酸甲氯芬酯可促进侧支循环建立,增加脑细胞血管网,两者联用可共同发挥改善中枢神经,减轻脑水肿,促进病情改善作用,从而降低血清MMP-2/9、TSP-1/2水平,进一步减轻神经功能损伤,加快ACH 病情转归。此外,本研究于治疗后随访4 周,发现观察组治疗后2、4 周NIHSS、mRS 低于对照A、B 组,表明脑苷肌肽与甲氯芬酯联用不仅可促进神经功能恢复,改善预后情况。但本研究选取样本量较少,可能造成数据偏移,需扩大样本量作进一步分析与探究。
综上可知,脑苷肌肽与甲氯芬酯联用治疗ACH 疗效显著,可通过调节血清MMP-2/9、TSP-1/2水平、调节神经相关因子促进神经功能恢复,改善预后。
