经皮肾镜碎石术治疗复杂性肾结石合并艾滋病病毒感染患者68例
2021-03-29李南南唐智旺汪志民陈智勇
李南南 唐智旺 汪志民 陈智勇
1长沙市第一医院泌尿外科(长沙410005);2中南大学湘雅医院泌尿外科(长沙410008)
艾滋病(acquired immune deficiency syndrome,AIDS),即获得性免疫缺陷综合征,是指因感染艾滋病病毒(HIV)所致的一种具有严重社会危害性的慢性传染性疾病,目前已成为国际上最突出的公共卫生问题之一[1]。截至2018年底,全球约有3 690 多万HIV 感染者/AIDS 患者,其中59%接受逆转录病毒治疗(antiretroviral therapy,ART)[2]。随着高效抗逆转录病毒治疗(highly active antiretrovirustherapy,HAART)的推广应用,HIV 感染者生存期明显延长,病死率降低,因合并泌尿外科疾病需要手术干预的患者也逐渐增多[3]。AIDS 患者的手术治疗也成为泌尿外科医师临床上经常遇到的问题。复杂性肾结石指≥2.5 cm 的肾结石,包括完全性、部分性鹿角形肾结石、多发性肾结石、孤立肾结石、感染性结石、无积水肾结石、复发性结石以及伴有解剖异常的肾结石[4]。因其具有结石结构复杂、手术中难以取净结石和术后结石复发率高等特点,治疗难度较大。目前文献报道复杂性肾结石合并HIV 感染患者手术治疗病例较少。长沙市第一人民医院是收治HIV 感染者的省、市级定点医院,自2010年1月至2020年3月,采用经皮肾镜碎石术(percutaneous nephrolithotomy,PCNL)治疗复杂性肾结石合并HIV感染患者68例,效果满意,现报告如下。
1 资料与方法
1.1 一般资料收集长沙市第一人民医院2010年1月至2020年3月收治的复杂性肾结石合并HIV感染患者共68 例为研究对象(HIV+组),并收集本院同时段收治的72 例不伴HIV 感染普通复杂性肾结石患者围手术期资料进行对照(HIV-组),以评价合并HIV感染复杂性肾结石患者行PCNL手术的安全性。两组的性别、年龄、结石大小等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
HIV+组所有患者均经省级以上疾病预防控制中心确证为HIV 抗体阳性,HAART 治疗无间断。其中男性患者42 例,女性26 例。年龄25 ~63 岁,中位年龄38 岁,BMI 指数17 ~26 kg/m2。术前均经X 线腹部平片(KUB)、超声及计算机断层扫描(CT)检查确诊为复杂性肾结石,其中右肾结石36 例,左肾结石28 例,双肾结石4 例。马蹄肾结石3 例,合并肾盏憩室内结石2 例,2 例既往有患肾开放手术史。结石最大直径2.5 ~4.8 cm,中位数为2.8 cm。31 例术前有患侧腰部疼痛、尿频等症状。2 例患者有高热(体温分别为39.3、40℃),无畏寒。8 例患者曾接受体外冲击波碎石术(extracorporeal shock wave lithotripsy,ESWL)治疗失败。所有病例中,合并高血压病11 例,合并糖尿病4 例。合并慢性肾功能不全者2 例,术前血肌酐分别为472、346 μmol/L。术前CD4+T 淋巴细胞计数(254.9±31.7)cell/μL。
1.2 术前准备所有患者术前常规行血常规、尿常规、尿培养、出凝血时间、生化及心电图等检查排除治疗禁忌证。HIV+组术前中段尿培养标本阳性者22 例,均给予敏感抗生素治疗3 ~5 d,复查尿培养转阴后手术。2 例发热患者待体温恢复正常3日以上复查尿培养,提示无细菌生长后安排手术。术前CD4+T 淋巴细胞计数需>200 cell/μL。HIV-组术前中段尿培养标本阳性者10 例,给予敏感抗生素治疗3 ~5 d,复查尿培养转阴后手术,无发热患者。
1.3 治疗方法所有患者均行标准通道经皮肾镜碎石术,HIV 感染患者围手术期需在严密防护下实施手术及相关操作诊疗。患者全身麻醉下先取截石位,膀胱镜下于患侧输尿管内逆行置入F6 输尿管导管,连接体外制造“人工肾积水”以协助建立肾穿刺通道。再改患者体位为俯卧位,B 超引导下,经患肾中盏后组肾盏建立皮肾工作通道(通道直径24F),其中2 例HIV+患者因部分结石位于肾下盏憩室内,于肾下盏后组肾盏建立另一条经皮肾穿刺通道。3 例HIV-患者经肾中盏、下盏建立双通道完成碎石手术。术中使用14F 肾镜,并采用钬激光或EMS 第四代弹道超声碎石清石系统碎石,术毕留置F6 双J 管和F18 肾造瘘管。术后3 ~5 d 复查KUB 或B 超。必要时行肾脏CT 检查,若无结石残留或残石直径<4 mm,无梗阻及临床症状,肾造瘘管待引流液转清后拔除。若有较大残余结石,则行原通道二期经皮肾取石术治疗。术后1 个月膀胱镜下拔除双J 管。
1.4 观察指标观察患者一次性结石清除率情况,并记录患者术后并发症发生率、手术时间、平均住院时间、术中出血量等临床数据。对比HIV+、HIV-两组患者在术后新发泌尿道感染、肺部感染、肾造瘘口感染、新发机会性感染等有无差异。重点监测HIV+组患者体温、白细胞(WBC)、血小板(PLT)、C 反应蛋白(CRP)、CD4+T 淋巴细胞计数等相关指标。
1.5 统计学方法采用SPSS 22.0 统计软件对调查结果进行统计分析,计量资料以均数±标准差表示,手术前后比较采用配对t检验;计数资料进行χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者围手术期指标比较两组患者均一期成功建立经皮肾穿刺通道,行碎石手术治疗。术中、术后无大出血、感染性休克、胸膜损伤及周围脏器损伤等严重并发症发生,无介入栓塞、输血病例。合并HIV感染患者中62例一期碎石排石,清除率为91.17%(62/68)。1 例患者残存结石>0.4 cm,予以出院半月后,二期来院经原窦道碎石手术完整清除结石。5例患者术后复查结石直径<0.4 cm,术后给予口服排石药物辅助治疗,1月后复查超声提示结石排净。HIV+组患者术后2 例出现明显血尿,予以体外牵拉肾造瘘管加压,卧床休息3 d 后血尿消失。手术时间(93.62±10.64)min,术中出血量(145.23 ± 21.32)mL,住院时间(5.2 ± 2.7)d,总并发症发生率17.65%(12/68)。患者术中及围手术期,无医务人员职业暴露事件发生。两组在手术时间、术中出血量、一期碎石清除率、住院时间等方面差异无统计学意义(P>0.05),见表1。
表1 两组患者围手术期指标比较Tab.1 Comparison of perioperative indexes between the two groups ±s
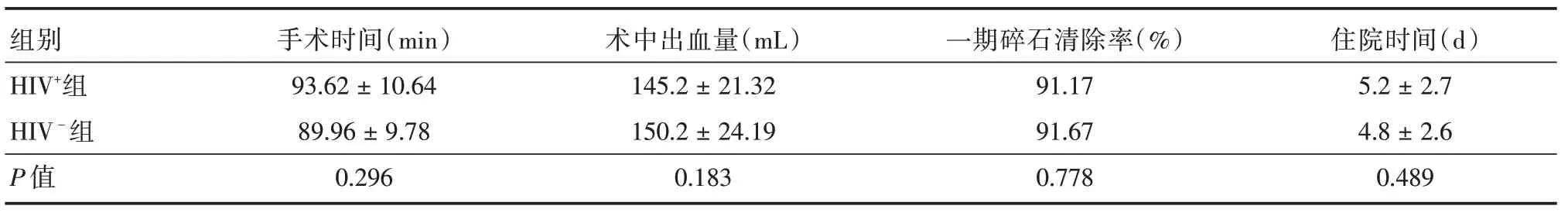
表1 两组患者围手术期指标比较Tab.1 Comparison of perioperative indexes between the two groups ±s
组别HIV+组HIV-组P 值手术时间(min)93.62±10.64 89.96±9.78 0.296术中出血量(mL)145.2±21.32 150.2±24.19 0.183一期碎石清除率(%)91.17 91.67 0.778住院时间(d)5.2±2.7 4.8±2.6 0.489
2.2 两组患者术后新发感染并发症比较两组患者在术后新发尿路感染、肺部感染、肾造瘘口感染等主要感染并发症方面差异无统计学意义(P>0.05)。HIV+组术后新发机会性感染1 例(真菌性尿路感染),经抗真菌治疗后痊愈,见表2。术后3例患者出现发热(最高体温38.1 ℃),经抗感染及对症治疗后恢复正常。5 例术后新发尿路感染,尿培养提示大肠埃希菌感染,予以抗感染治疗后复查尿培养转阴。

表2 两组术后新发感染并发症比较Tab.2 Comparison of new postoperative infection complications between the two groups例
2.3 HIV 阳性患者手术前后CD4 计数及炎症指标的比较68 例HIV 阳性患者术前均检查CD4+T淋巴细胞计数,术后1 d 复查CD4+T 淋巴细胞计数,与术前比较差异无统计学意义(P>0.05)。手术前后相关炎症指标(白细胞、血小板、CRP)等比较差异均无统计学意义(P>0.05)。2 例术前合并慢性肾功能不全患者,术后1、3 d 和1 周连续监测血肌酐无明显异常变化,见表3。
表3 HIV 阳性患者PCNL 手术前后指标比较Tab.3 Comparison of indexes before and after PCNL surgery in HIV-positive patients ±s
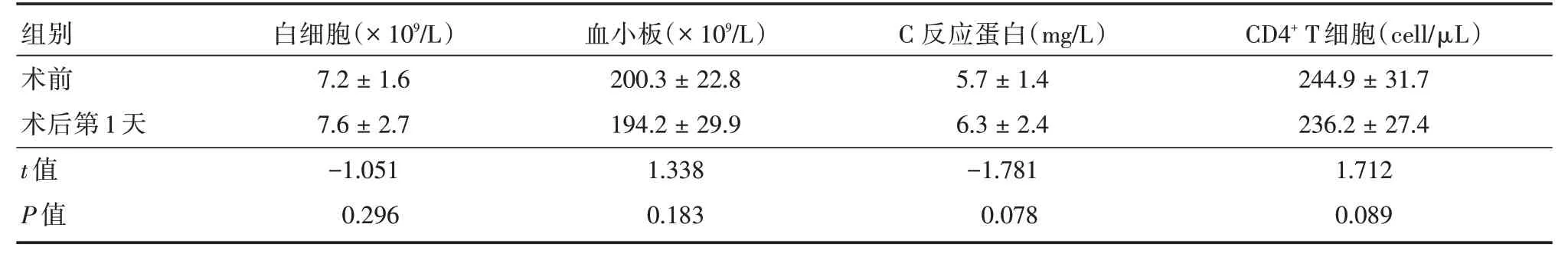
表3 HIV 阳性患者PCNL 手术前后指标比较Tab.3 Comparison of indexes before and after PCNL surgery in HIV-positive patients ±s
组别术前术后第1 天t 值P 值白细胞(×109/L)7.2±1.6 7.6±2.7-1.051 0.296血小板(×109/L)200.3±22.8 194.2±29.9 1.338 0.183 C 反应蛋白(mg/L)5.7±1.4 6.3±2.4-1.781 0.078 CD4+T 细胞(cell/μL)244.9±31.7 236.2±27.4 1.712 0.089
3 讨论
目前研究已表明,结石形成受性别、种族、遗传、环境地域、饮食习惯和药物等因素影响[5]。HIV 患者因其自身免疫力降低及生活方式等因素,容易出现泌尿道梗阻、感染[6]。随着高效抗逆转录病毒治疗(HAART)的广泛应用,由其引发的药物相关性结石报道不断增多。临床上针对HIV逆转录病毒的化学治疗药物归纳起来有三大类,即:核苷类抗逆转录病毒抑制剂(NRTI)、非核苷类抗逆转录病毒抑制剂(NNRTI)和蛋白酶抑制剂(PI)。前两类是核苷和非核苷逆转录酶抑制剂,阻断HIV 病毒的RNA 向DNA 转换,从而防止病毒感染宿主细胞。后一类药物为蛋白酶抑制剂,可以阻止病毒的片段组装成完整的病毒。PI 的代表药物有:利杜那韦(ritonavir,RTV)、茚地那韦(indinavir,IDV)、沙奎那韦(saquinavir ,SQR)和尼非那韦(nelfmavir ,NFV)。特别是使用茚地那韦后,可明显增加泌尿系结石的发生率[7]。SCHWARTZ等[8]报道尿石症在服用IDV 的患者中发病率达3%~20%,显著高于在一般人群中的发病率(0.1% ~0.4%)。SUTHERLAND 等[9]报道了12 例IDV 单日治疗剂量大于2.4 g 的患者,有8例发生了IDV药物相关性尿石症。由于IDV 在尿液中有较高的排泌量,生理pH 值下溶解度较低,当尿液中药物成份达到一定浓度后,药物晶体很容易析出形成药物结晶,发展成为尿路结石;或成为结石核心,在此基础上形成混合性结石[10]。
复杂性肾结石好发于肾盏、肾盂及输尿管连接部,多以巨大肾铸形结石及多发结石为主要特征,结石形态可表现为鹿角形结石和马蹄形结石[11]。复杂性肾结石仍是目前临床处理相对比较棘手的问题[12-13]。近年来,随着现代腔内泌尿外科技术的发展,特别是PNCL 的广泛应用,PCNL 已逐渐取代传统开放手术,成为治疗复杂性肾结石的首选方法[14]。但PCNL 术中单一通道常无法探及全部肾盏,存在清石率不尽满意可能。因此,术中常需添加第二通道,甚至多通道碎石可能,增加了出血、感染的风险。BIUM 等[15]的研究中,采用多通道经皮肾镜碎石治疗双侧复杂性肾结石,总结石取净率达88.9%。本研究中有2 例HIV+患者及3 例HIV-患者均经肾中盏、下盏建立双通道一期完成碎石手术,总计两组患者一期结石清除率分别为91.17%、91.67%,清石效果满意。因此,在保证患者手术安全的基础上,对于单通道难以顺利完成碎石的复杂性肾结石患者,可以通过增加辅助通道协助碎石,以提高结石清除率。并减少HIV 患者因反复结石手术,所带来的麻醉、手术及职业暴露等相关风险。本研究对2 例HIV 感染肾铸形结石合并肾盏憩室内结石患者,采取超声引导下建立第二穿刺通道,均顺利完成碎石。术后无出血、感染等现象发生。需要特别提出的是,有学者认为因第一通道在穿刺、扩张、碎石过程中可能造成出血,以及术中冲水引起的肾周水肿等导致肾脏形态改变,从而增加了第二通道穿刺难度,对术中技术要求较高[16]。因此,对于复杂性肾结石行PCNL 手术,需强调操作人员应具有一定的超声基础知识以及前期操作经验,确保可以实时追踪穿刺到目标肾盏的路径,同时避免损伤周围重要脏器及肾脏大血管。建立穿刺通道方向时应选择后组肾盏,靠近肾无血管区进入。对于目标肾盏的准确进入,可使术中出血的风险降低,增加结石清除率。同时,因复杂性肾结石的碎石负荷更大,碎石过程中动作应尽量轻柔、精确,Peel-away鞘的摆动幅度不宜过大,避免造成患者肾裂伤、肾盏黏膜撕脱及肾盏颈裂伤等情况发生,增加手术难度。
随着HIV 感染者对手术需求的增多,术前患者免疫状态的评估、术后感染的控制等成为了医疗临床工作者关注的焦点[17-18]。GAHAGAN 等[19]报道认为HIV 感染患者的术后疗效与普通患者相比并没有什么差异,但HIV 感染者术后的并发症和死亡率相对更高,这种差异可能与HIV 感染者的整体免疫状况更差有关。本研究对比了合并HIV 感染与不伴HIV 感染的复杂性肾结石患者在手术时间、术中出血量、一期碎石清除率、住院时间等方面疗效数据,两者差异无统计学意义。两组患者术中、术后均无大出血、感染性休克、胸膜损伤及周围脏器损伤等严重并发症发生,无介入栓塞、输血病例,与文献报道基本一致。免疫评估方面,当前对HIV 患者手术指征的把握主要是根据CD4+T 淋巴细胞计数水平,它是评估免疫功能的重要指标。刘立等[20]通过分析发生脓毒症的影响因素发现,HIV/AIDS 患者CD4 值<200 cells/μL 时发生脓毒症的风险较大。认为其原因为CD4 低时机会性感染的风险增加,存在机会性感染的患者在术后发生脓毒症的风险也增大。本组研究中,所有68 例HIV+患者入院时均已于我院艾滋病科行系统HAART 治疗,术前CD4+T 淋巴细胞计数控制在200 cell/μL 以上。并严格强调了术前尿培养的重要地位,我们对术前中段尿培养阳性的22 例患者,均给予敏感抗生素治疗3~5 d,复查尿培养转阴后手术。2 例发热患者待体温恢复正常3 d 以上复查尿培养,提示无细菌生长后手术。结果显示,术后仅有4.41%(3/68)的患者出现发热,术后尿路感染新发率7.35%(5/68),肺部感染新发率1.47%(1/68),无脓毒性休克病例发生,与HIV 阴性普通患者无明显差异。对比HIV 感染患者手术前后相关炎症指标(白细胞、血小板、CRP)差异无统计学意义,提示术后感染发生率较低,手术安全性高。可能与以下因素有关:(1)强调了CD4+T 淋巴细胞计数对手术时机选择的重要性。将CD4 值>200 cells/μL 作为复杂性结石行经皮肾镜碎石术的重要条件,可降低机会性感染发生率,减少术后感染的风险。当CD4 值较低时,应严格控制择期手术的开展,继续针对HIV 规范治疗,等到术前机会性感染因素纠正后再开展手术。(2)HIV 感染者因其自身免疫功能的减退,需加强围手术期的整体管理。对术前出现体温异常,或已经明确的中段尿培养阳性病例,术前需足量、足疗程应用敏感抗生素治疗。待患者体温正常,引流液清亮,复查尿培养正常后再行手术。同时,还需综合考虑患者一般营养状况、基础疾病、手术创伤大小、预后等各方面因素。术前加强营养支持治疗,纠正电解质紊乱,必要时输血、输白蛋白等措施改善患者的机体状况。(3)严格控制手术时间。相对于传统开放手术而言,经皮肾镜手术具有微创性、对患者肾功能损害小、术后恢复快等优点,这一定程度降低了HIV 感染患者术后切口、呼吸道、消化道感染的风险,减少对患者免疫功能的影响。但需警惕的是,PCNL 术治疗复杂性肾结石,需要对患者的结石进行彻底粉碎,较长时间的粉碎结石过程,可能造成细菌毒素大量释放,细菌毒素吸收入血常引起患者术后高热及感染。因此,必须严格控制手术时间,避免尿源性脓毒血症的发生。对于碎石负荷较大的患者,可通过留置肾造瘘管保留通道,择期二次手术治疗为宜。
对HIV 感染患者行PCNL 手术,因操作过程中医务人员需长时间暴露于患者血液、尿液环境中,存在较高程度的职业暴露风险。我院为艾滋病治疗定点医院,建立了完善的职业暴露预防及预警处理机制[21]。68例HIV感染合并复杂性肾结石患者术中及围手术期,无医务人员职业暴露事件发生。为有效防止PCNL 围手术期职业暴露,应该做到:(1)强调医护人员术中密切配合的重要性,所有参加手术的人员应注意力集中。手术间外悬挂隔离标志,禁止手术无关人员参观手术。(2)凡是手部、头颈部有伤口的人员不得参加此类手术。(3)严格做好防护,尽量选用一次性手术用物。穿洗手手术衣后再穿一次性隔离衣裤、帽、脚套、戴双层一次性口罩,穿一次性双层手术衣、靴套。(4)强调手术人员必须戴防护面罩或眼罩、避免术中患者的血液或分泌物污染眼睛。(5)手术人员戴双层乳胶手套,术中一旦手套破损必须立即更换,并用碘伏或消毒凝胶再次擦手;手术结束后需检查手套是否完好无损。(6)术后所有内镜器械经2%的戊二醛液中浸泡30 min,初步清洗处理后隔离密闭,经污物通道送到中心供应室,按感染性用物及硬式内镜清洗消毒或灭菌。摄像系统连接线、冷光源线取下防护套后均用75%酒精擦拭2 遍。手术室间需行严格空气消毒处理。
综上所述,对复杂性肾结石合并HIV 感染患者行经皮肾镜碎石术,术前进行充分的免疫评估,做好围手术期准备,术中严格遵守手术操作规定和防护措施,对于医患而言,总体是安全的,可取得良好的治疗效果。
