血清基质金属蛋白酶-12、纤维蛋白原、Clara细胞分泌蛋白-16联合临床特征预测慢性阻塞性肺疾病急性加重期患者预后的风险
2021-03-29郝兴亮王莹莹张建李霜王乃志纪艳荣
郝兴亮 王莹莹 张建 李霜 王乃志 纪艳荣
胜利油田中心医院1呼吸与危重症医学科,2临床药学部(山东东营257034)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)作为一种以不完全可逆的气流受限为特征的破坏性肺部疾病,使患者短期内出现咳痰、气短、咳嗽、痰量增多且呈脓性等症状,对患者及其家人生存质量带来严重影响[1]。有关报道表明,COPD 在世界范围内患病率高达10%,进展至急性加重期后会导致较高的致残率和病死率,给社会经济带来沉重负担[2]。急性加重期COPD 患者的发生频率和严重程度是决定预后的重要因素,因此在急性加重期给予准确的个人风险评估对临床管理和医疗资源的配置有重要价值,但是目前关于急性加重期患者预后的评估依据存在普遍争议[3]。当前采用血清标志物对急性加重期COPD 患者病情严重程度进行评估成为临床研究热点,而基质金属蛋白酶-12(matrix metalloproteinase-12,MMP-12)、纤维蛋白原(fibrinogen,FIB)、Clara 细胞分泌蛋白-16(clara cell secretory protein-16,CC-16)作为气管及肺部分泌炎性细胞,可能对急性加重期COPD 患者预后的预测有重要意义[4]。本研究选取我院近年来收治的150 例急性加重期COPD 患者作为研究对象,探讨血清MMP-12、FIB、CC-16 水平联合相关临床特征预测COPD 急性加重期患者预后的价值,现报告如下。
1 资料与方法
1.1 一般资料选取2018年1-10月我院呼吸内科收治的150 例COPD 患者,男96 例,女54 例;年龄45 ~85 岁,平均(62.34 ± 6.53)岁。本研究经我院伦理委员会审核并批准实行。
1.2 纳入标准(1)均符合2007年中华医学会呼吸病学分会制定的《慢性阻塞性肺疾病诊治指南(2013年修订版)》[5]关于急性加重期COPD 的诊断标准;(2)患者及其家属知情并签署知情同意书。
1.3 排除标准(1)非急性加重期;(2)在随访过程中因其他系统疾病引起的住院或者死亡;(3)合并肝脏疾病、泌尿系统疾病、肿瘤;(4)胸片检查提示明显浸润性改变;(5)伴有哮喘、囊性纤维化、结核、支气管扩张等其他严重肺部疾患。
1.4 方法(1)临床资料收集:收集患者性别、年龄、病程、肺功能分级、吸烟史、熬夜史、合并症(有无冠心病、糖尿病、消化道出血等)、生化指标检测结果(MMP-12、FIB、CC-16)等临床资料;肺功能分级参照《慢性阻塞性肺疾病急性加重诊治中国专家共识》[6]相关标准,将患者吸入支气管扩张剂后第1 秒用力呼气容积(forced expiratory volume in the first second,FEV1)/用力肺活量(Forced vital capacity,FVC)<70%定义为气流受限,并将其严重程度分为4 级,Ⅰ级(轻度)为FEV1%≥80%,Ⅱ级(中度)为50% ≤FEV1% <79%,Ⅲ级(重度)为:30% ≤FEV1% <50%,Ⅳ级(极重度)为FEV1% <30%,FEV1 及FVC 采用德国耶格公司Masterscope肺功能仪进行测量;生化指标分别于患者入院时及入院第10 天及出院后30 d(健康对照组在体检时进行血样抽取)抽取空腹静脉血3 mL,分离血浆后置入-70 ℃冰箱保存,0.13 mol/L 枸橼酸钠以9∶1抗凝,3 000 r/min 离心10 min,采用凝固终点法检测血浆FIB 水平,试剂盒购自菲舍尔诊断太平洋凝血制品公司,2 000 r/min 离心20 min 后采用双抗夹心酶联免疫吸附法检测血清MMP-12、CC-16 水平,试剂盒分别购自德国R&D 公司和北京四正柏生物科技有限公司,仪器均为Thermo 公司生产的酶标仪。(2)预后随访:对急性加重期COPD 患者进行为期1年的电话随访,将随访期间因COPD 或其并发症(如肺心病等)引起的再入院治疗或死亡定义为预后不良,随访期间未发生上述事件的患者定义为预后良好,并比较两组患者临床资料。
1.5 统计学方法应用SPSS 22.0 统计软件处理数据,计数资料用例(%)表示,采用χ2检验,计量资料以()表示,两组间比较采用t检验,利用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析MMP-12、FIB、CC-16 预测COPD急性加重期患者预后不良的价值,多因素分析采取非条件logistic 逐步回归分析,P<0.05 为差异有统计学意义。
2 结果
2.1 COPD急性加重期患者预后的影响因素分析预后不良患者中年龄≥60 岁、肺功能Ⅲ~Ⅳ级、吸烟、合并冠心病、合并糖尿病、合并消化道出血出现比例及MMP-12、FIB、CC-16 水平显著高于预后良好患者,差异有统计学意义(P<0.05)。见表1。
2.2 MMP-12、FIB、CC-16水平预测COPD急性加重期患者预后不良的ROC 曲线分析MMP-12、FIB、CC-16 水平预测COPD 急性加重期患者预后不良的下曲线面积分别为0.719、0.824、0.683,最佳截断值20.930、3.465、0.405。MMP-12、FIB、CC-16 水平预测COPD 急性加重期患者预后不良的ROC 曲线图见图1-3。
2.3 COPD 急性加重期患者预后不良的多因素logistic回归分析将有差异变量纳入logistic 回归分析模型,并进行量化赋值。最后经logistic 回归性分析证实MMP-12 ≥20.930 pg/mL、FIB ≥3.465 g/L、CC-16 ≥0.405 pg/mL、年龄≥60 岁、肺功能Ⅲ-Ⅳ级、吸烟、合并冠心病、合并糖尿病、合并消化道出血是COPD 急性加重期患者预后不良的危险因素。见表2。
3 讨论
COPD对患者生存质量、肺功能、疾病进程和社会经济负担均产生严重的负面影响,不仅成为其死亡的重要影响因素,还是慢阻肺患者医疗费用居高不下的主要原因[7]。急性加重期COPD 患者在微生物、污染等诱发因素作用下,使得气道炎症加剧,进而引起支气管黏膜充血水肿,增加黏液分泌、平滑肌痉挛,加重气道狭窄,导致呼气性气流受限,肺动态过度充气,从而出现急性加重症状,一旦肺部炎症溢出,则可导致全身性的炎症反应[8-10]。目前慢阻肺急性加重的诊断完全依赖于临床表现,缺乏量化指标,炎性生物标志物作为一种定量指标,在慢阻肺急性加重的辅助量化诊断、严重程度评估及判断急性加重的病因和预后方面的作用值得期待[11]。

表1 COPD 急性加重期患者预后的影响因素分析Tab.1 Analysis of prognostic factors in patients with acute exacerbation of COPD 例(%)
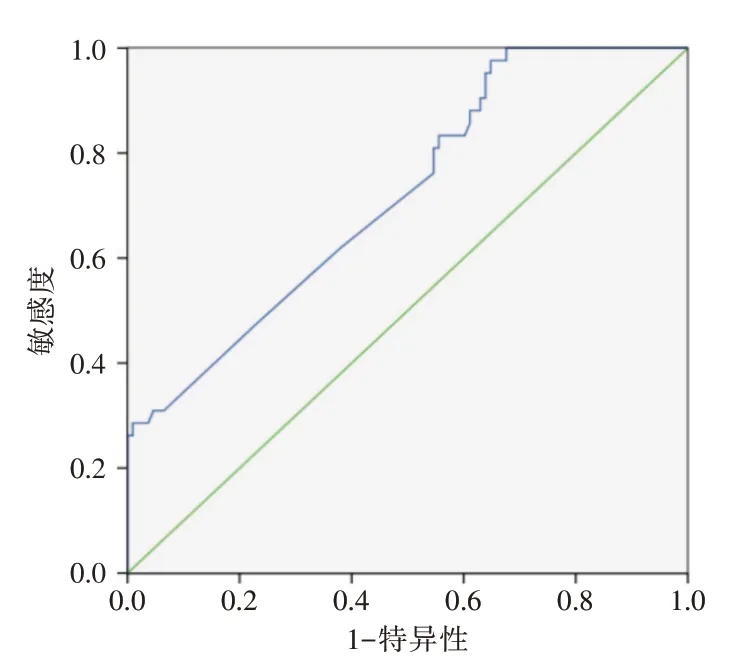
图1 MMP-12 预测COPD 急性加重期患者预后不良的ROC 图Fig.1 ROC chart of MMP-12 in predicting poor prognosis in patients with acute exacerbation of COPD

图2 FIB 预测COPD 急性加重期患者预后不良的ROC 图Fig.2 ROC chart of FIB predicting poor prognosis in patients with acute exacerbation of COPD

图3 CC-16预测COPD急性加重期患者预后不良的ROC图Fig.3 ROC chart of CC-16 predicting poor prognosis in patients with acute exacerbation of COPD
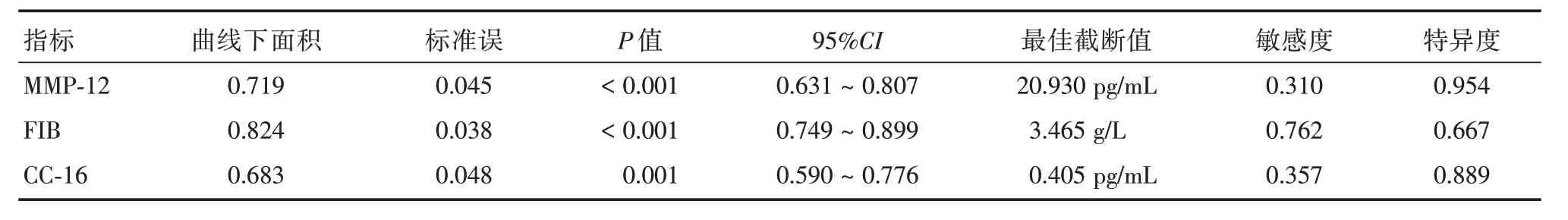
表2 MMP-12、FIB、CC-16水平预测COPD急性加重期患者预后不良的ROC曲线分析Tab.2 ROC curve analysis of MMP-12,FIB and CC-16 levels predicting poor prognosis in patients with acute exacerbation of COPD
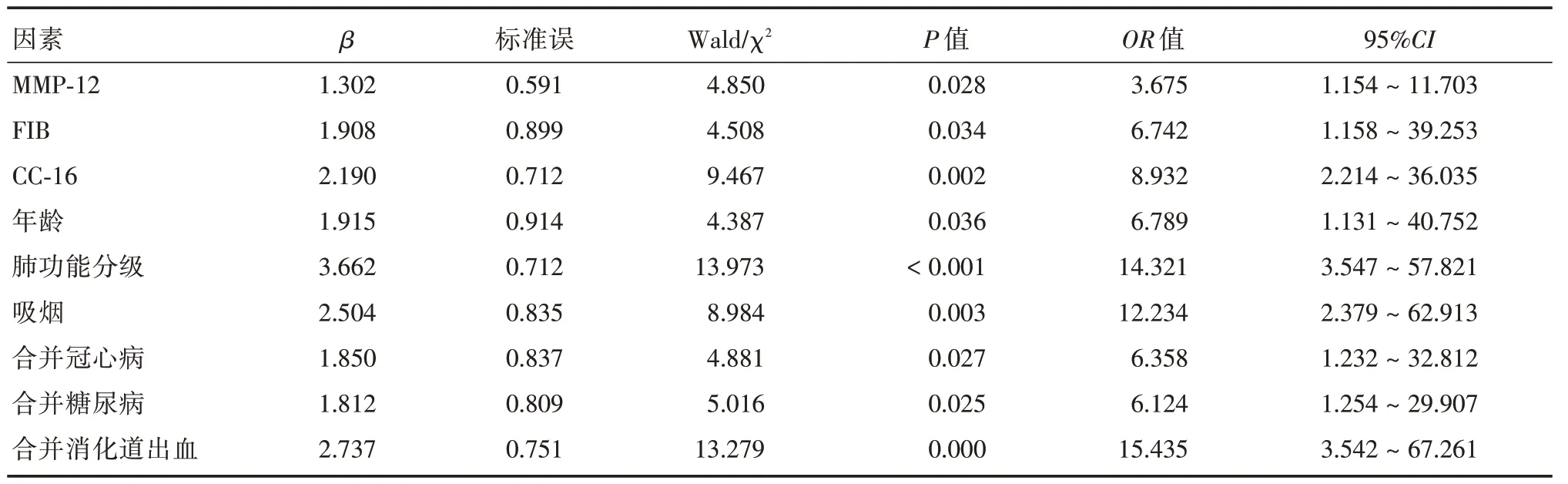
表3 COPD 急性加重期患者预后不良的多因素Logistic 回归分析Tab.3 Multivariate logistic regression analysis of poor prognosis in patients with acute exacerbation of COPD
预后不良患者中年龄≥60 岁、肺功能Ⅲ~Ⅳ级、吸烟、合并冠心病、合并糖尿病、合并消化道出血比例及MMP-12、FIB、CC-16 水平显著高于预后良好患者,提示年龄、肺功能分级、合并症及MMP-12、FIB、CC-16 水平对急性加重期COPD 患者预后有重要的预测作用。MMPs 主要由巨噬细胞以酶原方式分泌,可降解多种细胞外基质,可诱导单核/巨噬细胞聚集,加重肺部炎症反应,作为一组包含锌离子的内肽酶家族,通常由钙离子激活并具有降解大部分细胞外基质成分的功效,在炎症、疮口愈合、肿瘤浸润等疾病发展机制中发挥重要作用[12-13]。而急性加重期COPD 患者经受治疗后,MMP-12 水平有了显著降低,但经过后期持续随访比较,发生预后不良患者体内MMP-12 水平均较预后良好患者有明显升高,提示患者在出院时肺部仍有较多残余炎症细胞聚集,并且可能处于持续发展状态,并最终导致住院或死亡[14]。FIB 由肝细胞合成,作为一类糖蛋白,其生物学功能与血液凝固、细胞粘附、增殖伸展、吞噬等活动有密切关联,其分子量在所有凝血蛋白原中最大,且呈链状不对称结构,能增加血浆浓稠度,促使肺内微小动脉血栓形成,加重机体缺氧状态[15]。患者出院时FIB较高的水平可能提示患者此时仍处于机体缺氧状态,因而出院后呼吸衰竭发生可能性会更大[16]。COPD 急性加重期患者受炎症、氧化应激、感染等因素的影响,会明显增加肺泡-毛细血管通透性从而增强CC-16 表达,作为Clara 细胞分泌的主要功能性蛋白,CC-16 可抑制磷脂酶A2 的活性,减少细胞膜磷脂分解,还可直接抑制多种炎症因子的表达及其生物学活性,在哮喘、COPD 、急性肺损伤发展机制中发挥重要作用因此提示患者仍处于高度肺部炎症浸润状态[17]。FÜSUN 等[18]的研究通过比较常规血清指标在急性COPD 及平稳期COPD患者中的不同表达,对其在COPD 干预效果进行分析,得出炎性生物标志物在COPD 患者病情进一步加重中有明显推动作用,本研究结果与之类似,但本研究直接将不同预后患者血清水平进行比较,对血清指标影响其预后机制的说明更有说服力。
老年人各种脏器易发生退行性变化,自身免疫功能较年轻人更低,肺组织结构及形态均发生减退,从而更易引起肺部感染。干丽萍等[19]的研究表明,急性加重期患者年龄越高,COPD 治疗难度越大,疾病进展越快,死亡风险更高,这与本研究结果相类似。肺功能测定是目前用于评价肺功能障碍程度所用的主要标准。当气流阻塞变严重时,会导致患者通气过度而引起呼吸肌功能障碍,使得患者呼吸更吃力,加重机体缺氧,对营养物质的摄取则会更大,从而引起器官免疫机能下降,增加预后不良风险[20]。香烟烟雾中包含尼古丁、焦油、亚硝基胺、氢氰酸等有害物质,长期吸入会引起支气管黏膜纤毛受损,使得肺泡吞噬细胞、清洁运动的作用减弱,肺部组织结构受到破坏,肺组织损伤加重,蛋白酶功能丧失,并且还破坏蛋白酶和抗蛋白酶平衡,使得COPD 病情更为严重[21]。冠心病、糖尿病、消化道出血等并发症均可能通过影响器官功能而降低患者机体免疫力,增加其缺氧和机体功能紊乱风险,最终导致患者预后不良[22]。
另外,本研究创新性将logistic 回归分析模型应用于各临床特征及MMP-12、FIB、CC-16 水平对急性加重期COPD 患者的预测,通过分析影响其预后的危险因素,来表现其价值,可信度较高。但在研究设计中也尚存在不足,患者预后原因还可能与急性期治疗方式、治疗指标相关,但本研究为回顾性分析,在纳入病例时不能更好处理两组患者基本信息的均衡性,因此还需通过扩大样本量进行前瞻性研究来进一步对其预后预测价值进行证实。
综上,MMP-12 ≥20.930 pg/mL、FIB ≥3.465 g/L,CC-16 ≥0.405 pg/mL、年龄≥60 岁、肺功能Ⅲ-Ⅳ级、吸烟、合并冠心病、合并糖尿病、合并消化道出血是COPD 急性加重期患者预后不良的危险因素,临床医师在对其进行治疗时需密切关注上述指标或症状,以采取及时有效的干预。
