磷酸化修饰对山豆根多糖抗Ⅰ型鸭肝炎病毒效果的影响
2021-03-29何淼张宝康粟灵琳杜红旭明珂白景英刘家国王德云武毅
何淼,张宝康,粟灵琳,杜红旭,明珂,白景英,刘家国,王德云,武毅
(南京农业大学动物医学院/教育部动物健康与食品安全国际合作联合实验室,江苏 南京 210095)
鸭病毒性肝炎(duck viral hepatitis,DVH)是由鸭肝炎病毒(duck hepatitis virus,DHV)引起的高传染性、高致死率的烈性传染病。DHV-1被认为是分布最广泛、危害最大的一类[1]。最近根据序列分析将其归为小核糖核酸病毒科的一员[2],并重新命名为鸭甲型肝炎病毒Ⅰ型(DHAV-1)。DHAV-1是一种RNA病毒,没有包膜,在胞质中繁殖,病毒颗粒具有很强的抗性,在自然条件下很难清除[3],一旦感染,雏鸭死亡率可达100%,对全球养鸭业产生巨大危害。康复鸭血清虽有一定保护作用,但需要逐只注射,使用不便、人工成本高、应激大,限制其临床应用,因此,鸭病毒性肝炎的治疗急需替代药物。
根据中医理论,山豆根具有清热、解毒、保肝作用,其主要活性成分为生物碱、多糖。研究表明山豆根多糖(Bush Sophora Root polysaccharide,BSRPS)可以有效清除氧自由基,调节细胞因子和调节免疫[4-5]。所有这些功能都有助于提高感染DHAV-1的雏鸭存活率。而化学修饰则提高多糖的这些生物活性,如增强其免疫调节、抗肿瘤、抗病毒、抗氧化等活性[6-8]。我们前期的研究表明BSRPS具有良好的抗DHAV-1病毒作用[5],硫酸化修饰还可以进一步提高BSRPS的抗病毒和抗炎作用。但是,硫酸化修饰条件要求高、污染大、危险性高。我们发明的甙糖类成分磷酸化修饰法[9]条件温和、环保,修饰物活性高。但BSRPS磷酸化修饰是否可以获得相似的结果,尚未见报道。
病毒感染可诱导产生大量自由基[10]。过量自由基导致的氧化应激损伤被认为是RNA病毒感染引起的一种主要的病理损伤机制[11-12]。我们在前期研究中也发现DHAV-1感染可产生大量自由基,所以清除多余自由基可有效缓解肝损伤[13]。氧化还原平衡存在于组织和细胞中,由抗氧化酶系统,包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和大量抗氧化物质,如谷胱甘肽(GSH)组成,这种平衡是许多能量代谢乃至生命活动的基础。一旦平衡被打破,如酶系统活性下降、抗氧化物质消耗殆尽、多余氧自由基的产生和积累等,会导致脂质、DNA和蛋白质[14]的过氧化。这些都说明消除氧自由基对减轻DHAV-1所致的肝损伤至关重要[15]。
因此,本试验采用水提醇沉法制备BSRPS,采用多聚磷酸盐法对BSRPS进行修饰,经体内、外试验研究BSRPS和pBSRPS的抗DHAV-1活性和对DHAV-1感染雏鸭的保护作用和雏鸭体内氧化损伤变化,以评价其治疗效果。
1 材料与方法
1.1 主要试剂和仪器
RNA提取试剂盒购于AngleGene公司,反转录试剂盒(R223-01)和Real-time qPCR试剂盒购于南京诺唯赞生物科技有限公司。SOD、MDA、CAT检测试剂盒购于Solarbio,GSH和诱导型一氧化氮合酶(iNOS)检测试剂盒购于南京建成生物技术公司。
四甲基偶氮唑蓝(MTT),购于Solarbio公司;DMEM(Gibco公司),按说明书用去离子水配制,0.22 μm微孔滤膜过滤除菌,加入100 IU·mL-1青霉素、100 IU·mL-1链霉素、0.75 mg·mL-1谷氨酰胺及10%(完全培养基)或1%(维持培养基,MM)小牛血清(杭州四季青公司),以56 g·L-1NaHCO3调pH值至7.4,4 ℃保存;正丁醇、乙醇、三偏磷酸钠、三聚磷酸钠等试剂均为国产分析纯,溴化钾为国产光谱纯。
Nicolet FT-IR 200型傅里叶红外变换光谱仪、Applied Biosystems实时荧光定量PCR仪、Multiskan FC型多功能酶标仪均购自Thermoscientific(美国);UnicelDxC 600 Synchron全自动生化分析仪购自Beckmancoulter(美国)。
用于攻毒试验和抗病毒检测的DHAV-1(LQ2株)由山东省农业科学院家禽研究所提供,并通过接种鸭胚单层肝细胞(DEH)进行增殖。采用Reed-Mueech法[16]测定病毒液的TCID50。用维持培养基(MM)将其稀释成 5×10-2(50 TCID50·mL-1),用于抗病毒检测。
1.2 BSRPS和pBSRPS的制备
1.2.1 BSRPS的提取和pBSRPS的制备采用水提醇沉法[17]提取山豆根粗多糖,用Sevage方法[18]对BSRPS进行纯化后,用苯酚-硫酸法[19]测定多糖含量为89.56%。采用多聚磷酸盐法[20]制备pBSRPS后,用苯酚-硫酸法测定多糖含量为60.42%,钼蓝比色法测定磷酸盐含量为37.43%。
1.2.2 红外光谱分析采用溴化钾压片法测定山豆根及其磷酸化产物在400~4 000 cm-1处的FT-IR光谱[7]。将100 mg溴化钾(KBr)研磨、压片后测得光谱背景,再将1.5 mg样品与100 mg KBr混合研磨、压片后再次测量光谱。
1.3 BSRPS和pBSRPS体外抗DHAV-1活性的比较
采用文献[21]的方法制备鸭胚单层肝脏细胞(DEH)于96孔板中,设置细胞对照组(仅加入维持培养基)、病毒对照组和加药组。将DHAV-1病毒100 μL加入到单层细胞中,放入CO2细胞培养箱2 h,使病毒吸附细胞,后用D-Hank’s溶液洗净后备用。前期的研究以倍比稀释的方式用MTT法测得BSRPS和pBSRPS的最大安全浓度分别为2 000和15.63 μg·mL-1,现将山豆根多糖及其磷酸化修饰物分别从药物的最大安全浓度2 000和15.63 μg·mL-1再次以倍比稀释加入药物组中;细胞对照组和病毒对照组仅加入相同体积的MM。每组6个重复。共同培养72 h后用MTT法[22]测定细胞活力。病毒抑制率计算公式[23]:
病毒抑制率=(A药物+病毒-A病毒对照)/(A空白对照-A病毒对照)×100%。
1.4 BSRPS和pBSRPS抗DHAV-1增殖作用比较
将制备好的鸭胚单层肝脏细胞接种于24孔板中,设置细胞对照组(CC)、病毒对照组(VC)和加药组(BSRPS组和pBSRPS组)。细胞对照组加入1% DMEM,病毒对照组和加药组加入用1%DMEM稀释好的DHAV-1病毒400 μL,于 37 ℃ 5% CO2培养箱内培养1.5 h后弃去培养液,用D-Hank’s溶液冲洗。将山豆根多糖及其磷酸化修饰物分别稀释至最有效抗病毒浓度2 000和15.63 μg·mL-1后加入试验组细胞中,每孔400 μL;细胞对照组和病毒对照组仅加入相同体积的MM。每组设置4个重复孔。继续培养2 h后,弃去培养液,收集细胞,提取总RNA供病毒吸附分析使用。再培养12 h后弃去培养液,收集细胞,提取总RNA供病毒复制分析使用。继续培养24 h后,吸取100 μL上清液,与100 μL DEH细胞混合(作为内参),提取总RNA供病毒释放分析用[24]。
参照文献[25]设计的引物,采用RNApure总RNA提取试剂盒(Angle Gene)提取并确保提取后的总RNA浓度(D260/D280值)为1.8~2.1。反转录根据HiScript@Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)试剂盒(Vazyme)说明书,按照50 ℃ 15 min、85 ℃ 5 s的过程进行反转录。PCR反应按照ChanQTM SYBR@qPCR Master Mix试剂盒(Vazyme)说明书进行操作。
1.5 BSRPS和pBSRPS对DHAV-1感染雏鸭的治疗作用
1.5.1 动物分组处理和样本采集240只1日龄未免疫樱桃谷鸭,饲养至4~6日龄时,随机均分为4组:BSRPS、pBSRPS、VC和空白对照(BC)组(单独饲养),每组60只。BSRPS、pBSRPS、VC组每只分别肌肉注射0.2 mL DHAV-1病毒。在攻毒后,BSRPS组和pBSRPS组分别按每只5和3 mg·d-1将药物混于饮水中给药,连续给药3 d。分别在攻毒后4、8和54 h时每组随机抓取5只雏鸭,颈动脉采血4 mL(提前混有肝素钠)并取肝脏组织约10 g,离心分离血清。肝脏组织5 g保存在冻存管并置于液氮中用于检测抗氧化酶活性;另一部分组织约5 g置于多聚甲醛中固定,用于HE染色和观察病理变化。每天观察临床症状并记录死亡数,连续观察5 d。每当雏鸭死亡时立即解剖并观察是否有明显著病理变化。
1.5.2 动态存活率计算各组在最终统计存活率时剔除采样样本(每组共15只)。存活率=存活数/各组有效样本数×100%。
1.5.3 肝损伤生化指标测定血清中天门冬氨酸氨基转移酶(AST)、谷氨酸-丙酮酸氨基转移酶(ALT)、高密度脂蛋白(HDLC)、低密度脂蛋白(LDLC)、总胆红素(T-Bili)、总胆固醇(T-CHO)和总甘油三酯(TG)含量的测定采用全自动生化分析仪进行测定。
1.5.4 肝脏过氧化损伤评价指标的检测GSH、MDA、SOD、CAT、iNOS活性或含量的检测分别采用GSH、MDA、SOD、CAT、iNOS试剂盒。
1.6 统计分析
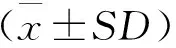
2 结果与分析
2.1 BSRPS磷酸化修饰结果鉴定

图1 BSRPS和pBSRPS的红外光谱分析结果Fig.1 Infrared spectrum analysis results of BSRPS and pBSRPS
2.2 BSRPS和pBSRPS的体外抗DHAV-1感染活性
各种药物处理后,DEH被DHAV-1感染后的A570值和病毒抑制率见表1。VC组A570值均显著低于CC组(P<0.05)。而BSRPS和pBSRPS处理后A570值显著升高(P<0.05)。pBSRPS和BSRPS分别在15.63和500 μg·mL-1时的病毒抑制率最高,分别为57.87%和53.66%,前者稍高于后者。

表1 各药物处理后鸭胚单层肝细胞(DEH)的A570值及病毒抑制率Table 1 A570 value and virus inhibition rate of DEH after each drug treatment
2.3 BSRPS及pBSRPS体外抗DHAV-1增殖作用效果比较
将VC组的病毒基因表达量设置为1,CC组未检测到DHAV-1基因的表达,故其相对表达量为0。BSRPS和pBSRPS对DHAV-1吸附的影响结果如图2-A所示,BSRPS和pBSRPS组的DHAV-1基因相对表达量分别为0.992 6和0.948 4,均与VC组无显著差异(P>0.05),表示二者对病毒的吸附均无显著作用。BSRPS和pBSRPS抑制病毒复制的结果如图2-B所示。BSRPS和pBSRPS组DHAV-1基因相对表达量分别为0.546 1和0.316 1,二者均显著低于VC组(P<0.05),pBSRPS组也显著低于BSRPS组(P<0.05),说明2种药物均可以显著抑制病毒复制,pBSRPS作用优于BSRPS。BSRPS和pBSRPS对病毒释放的影响见图2-C,BSRPS和pBSRPS组的病毒基因相对表达量均显著低于VC组。pBSRPS组的病毒基因表达量略低于BSRPS组(P>0.05)。

图2 BSRPS和pBSRPS的抗DHAV-1增殖作用Fig.2 Anti-DHAV-1 proliferation effects of BSRPS and pBSRPS A. 对DHAV-1吸附的影响Effects on DHAV-1 adsorption;B. 对DHAV-1复制的影响Effects on DHAV-1 replication;C. 对DHAV-1释放的影响Effects on DHAV-1 release.不同字母表示不同处理间差异显著(P<0.05)。Different superscript letters are significantly different(P<0.05)among different treatments.
2.4 BSRPS和pBSRPS对DHAV-1感染雏鸭的治疗效果比较
由图3可见:VC组雏鸭84 h全部死亡,空白对照(BC)组未发现雏鸭死亡。BC、VC、BSRPS和pBSRPS组雏鸭的最终生存率分别为100.0%、0%、26.7%、37.8%,2个药物治疗组的最终生存率明显高于VC组,pBSRPS组较BSRPS组高11百分点。2个药物组各时间点雏鸭存活率趋势与VC组相似:第1个死亡高峰出现在24 h,然后下降。VC组的死亡高峰期为24~48 h,而药物组的死亡数量较少。

图3 BSRPS和pBSRPS对DHAV-1感染后 各组雏鸭存活率的影响Fig.3 Effect of BSRPS and pBSRPS on survival rate of ducklings infected with DHAV-1
2.5 BSRPS和pBSRPS对DHAV-1感染雏鸭肝脏病理变化的影响
由各组肝脏H&E染色结果(图4)可见:BC组肝脏未见病理改变,脊索清晰整齐,未见炎症渗出或坏死;VC组可见大范围淋巴细胞浸润(箭头标记处),伴有脊髓紊乱,肝细胞坏死严重;BSRPS组和pBSRPS组仅存在部分淋巴细胞浸润和坏死,pBSRPS组病变较BSRPS组轻。
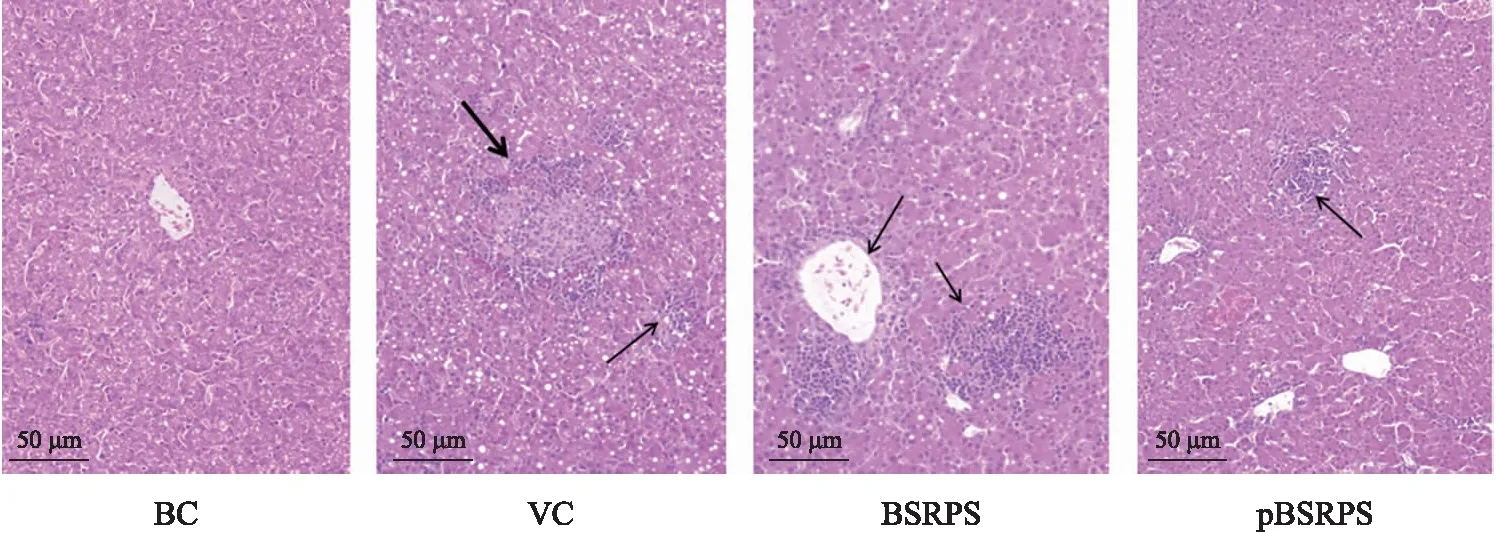
图4 BSRPS和pBSRPS对DHAV-1感染后各组肝脏病理变化的影响Fig.4 Effect of BSRPS and pBSRPS on pathological changes of liver in each group infected with DHAV-1箭头指示淋巴细胞浸润。The arrows indicate the lymphocylic infiltration.
2.6 BSRPS和pBSRPS对DHAV-1感染雏鸭肝损伤评价指标的影响
如表2所示:血清AST活性各时间点VC组均显著高于其余各组(P<0.05,4 h BSRPS组除外)。在4和54 h时BSRPS组显著高于pBSRPS组和BC组(P<0.05),后2组间差异不显著;8 h时,3组间没有显著差异。血清ALT活性在8、54 h时VC组显著高于其余各组(P<0.05);此变化趋势与同时间点AST的活性趋势相同。

表2 各组不同时间点肝损伤指标的变化Table 2 Changes of liver injury indexes in each group at different sampling time points
血清TG、T-CHO、HDLC、LDLC是血浆中血脂成分。各时间点VC组TG含量均显著高于同期其余各组,其余3组间同时间点内均无显著差异(54 h时BSRPS组显著高于BC和pBSRPS除外)。T-CHO含量,4 h时各组间没有显著差异;8 h时,除BC组显著高于其余3组外,其余各组间无显著差异;54 h时,VC组显著低于BC组和pBSRPS组,其余各组间无显著差异。HDLC含量,各组间各时间的趋势基本一致;BC组各时间点均显著高于其他3组;VC组均显著低于pBSRPS组,低于BSRPS组。LDLC含量,4 h时,各组间无显著差异;8和54 h,VC组均显著高于其余各组,除8 h时BC组显著低于BSRPS组和pBSRPS组外,其余未见显著差异。T-Bili含量,4 h时各组间没有显著差异;8和54 h时,VC组均显著高于同时间点其余3组(8 h时BSRPS除外),54 h时BSRPS组显著高于BC组和pBSRPS组,其余未见显著差异。
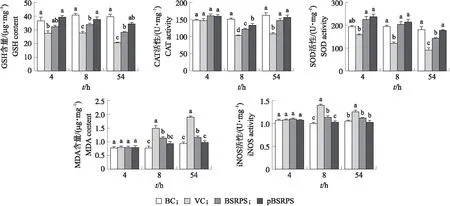
图5 不同时间点肝组织氧化损伤评价指标变化Fig.5 Changes of evaluation indexes of liver tissue oxidative damage at different sampling time points
2.7 BSRPS和pBSRPS对DHAV-1感染雏鸭肝脏过氧化损伤评价指标的影响
如图4所示:VC组GSH含量在各时间点均最低,4 h时显著低于BC组和pBSRPS组,8和54 h时显著低于其余各组;8和54 h时BSRPS组显著低于BC组;pBSRPS组在各时间点与BC组均无差异。4 h时各组肝脏组织CAT活性无显著差异;8和54 h时,VC组均显著低于其余各组;8 h时BSRPS组与pBSRPS组接近并均显著低于BC组,54 h时BSRPS组显著低于pBSRPS组和BC组,BSRPS和pBSRPS组间无显著差异。各时间点VC组SOD活性除在4 h时与BC组无显著差异外,在8和54 h均显著低于其余各组;4和8 h时,BC组、BSRPS组与pBSRPS组3组间无显著差异;54 h时,pBSRPS组与BC组接近,并均显著高于BSRPS组。MDA与iNOS的变化趋势基本接近,4 h时各组间无显著差异;8和54 h时VC组均显著高于其他各组,其次是BSRPS组,均显著高于BC组,pBSRPS组则与BC组均无显著差异。
3 讨论
鸭病毒性肝炎是由鸭肝炎病毒引起的一种急性传染病,临床表现为发病急、死亡快。病死雏鸭出现明显的角弓反张,肝脏上有瘀斑和紫癜,是一种传染性很强的疾病,给全球的养鸭业带来了巨大的损失。而中药的抗病毒作用在这一领域具有广阔的应用前景[27-28]。
在本研究中,BSRPS在体外对病毒复制和释放有较好的抑制作用,BSRPS治疗后的雏鸭成活率也明显提高,肝脏损伤和氧化损伤也明显减轻。表明BSPRS在体内外均具有抗病毒和抗氧化作用。但BSRPS在应用中存在许多问题,如溶液稳定性差、应用浓度高、味苦等。许多研究报道,多糖的化学修饰可以提高其抗病毒和抗氧化活性。BSRPS和硫酸化山豆根多糖(sBSRPS)具有良好的抗DHAV-1活性,且sBSRPS比BSRPS具有更好的抗DHAV-1活性,说明多糖的修饰可以提高其生物活性[25,29]。但硫酸化修饰环境污染大,操作危险性高。而磷酸化修饰则反应缓和、无明显污染,操作安全。
采用MTT法检测药物体外抗病毒活性,570 nm处吸光值越高,说明细胞活性越高,药物抗病毒效果越好[30],病毒抑制率则直接反映药物的抗病毒作用。BSRPS和pBSRPS在药物有效浓度范围内,病毒抑制率接近。而且2种药物对DHAV-1复制均有显著的抑制效果,pBSRPS作用效果优于BSRPS;2种药物对病毒释放的抑制作用接近,说明pBSRPS具有较强的抗病毒复制能力。这可能是由于引入酸离子,增加了药物的活性,增强了抗病毒复制能力[30]。而且磷酸化可以提高药物的溶解稳定性,减少沉淀和药物的应用浓度和剂量。
体内试验是最终反映药物生物活性的最佳和最终方式。通过雏鸭感染治疗试验,发现BSRPS和pBSRPS均显著提高了感染雏鸭的存活率,且pBSRPS效果优于BSRPS 11百分点,这个效果与本实验室前期采用硫酸化修饰法获得的sBSRPS基本一致[25]。H&E染色显示,2种药物均可以缓解被感染雏鸭肝脏损伤。为了进一步评价,我们检测了肝损伤评价的生物标志物,包括ALT、AST、TG、T-CHO、HDLC、LDLC和T-Bili。血清总甘油三酯、总胆固醇和高密度脂蛋白是肝脏脂肪代谢的重要指标,反映肝脏的健康状况[31]。肝脏也是内源性胆固醇合成的主要器官,肝脏损伤会降低其合成量。HDLC的合成和LDLC的代谢也主要发生在肝脏,肝脏损伤可导致这2种成分相反的变化趋势。试验结果显示,VC组的ALT、AST、TG、LDLC和T-bili均明显高于BC组,HDLC和T-CHO则显著低于BC组,而BSRPS组和pBSRPS组上述变化明显减轻,尤其是pBSRPS组,各指标水平基本与BC组接近。提示DHAV-1感染造成了雏鸭明显肝脏损伤,而且从感染初期就出现;而BSRPS和pBSRPS均可有效缓减这种损伤,且pBSRPS的作用明显优于BSRPS,尤其在恢复期更明显。
肝脏作为机体最大的代谢器官,代谢活动旺盛,正常生理活动下即有少量ROS产生,可被机体氧化防御系统所清除,但是DHAV-1感染后,会影响细胞内代谢状况,抑制线粒体呼吸链上的电子传递,使电子漏出,形成大量ROS。ROS一方面可以作为刺激信号激活雏鸭免疫系统,激活吞噬细胞以增强机体的抗病毒能力;另一方面,病毒在胞浆中繁殖,持续感染产生的ROS可以作为杀伤因子,对病毒有直接损伤作用。但是,过多的ROS会增加抗氧化防御系统的压力,破坏氧化还原平衡,进而损伤细胞结构和功能,引起雏鸭严重的氧化应激并刺激炎性因子的释放[10],抑制细胞凋亡,造成肝脏炎症,创造出更适合病毒增殖的环境,这也成为DHAV-1感染雏鸭的一种主要致病机制[13]。本试验也获得相似结果。甚至在感染初期(4 h),雏鸭体内SOD活性和GSH含量即显著降低。揭示在病毒感染的早期阶段,由于病毒进入和侵害机体,肝脏抗氧化物质首先被消耗和过氧化物累积。而经BSRPS和pBSRPS治疗后,上述变化均不明显,说明2种药物可以有效减少抗氧化物质消耗和过氧化物的累积。随着病毒在体内的逐渐增殖,过氧化物积累逐渐增多,抗氧化物质逐渐消耗而进一步降低。我们的试验结果显示,到8 h时,各组雏鸭体内病毒基因拷贝数增至最高水平[25],MDA含量和iNOS活性均逐步上升,血清SOD、CAT活性和GSH含量均进一步降低,以VC组变化最明显,2个药物组尤其是pBSRPS组变化基本与BC组水平一致,说明DHAV-1感染引起的肝损伤,与病毒增殖有关,2种药物尤其是磷酸化修饰物具有明显的抑制病毒增殖,从而减轻雏鸭肝损伤作用。到恢复期(54 h),各组血液病毒基因拷贝数均显著降低[32],但是MDA含量和iNOS活性均没有下降,VC组的MDA含量甚至较8 h更高;而SOD、CAT活性和GSH含量与8 h相比有不同程度下降,2个药物组尤其是pBSRPS组的上述变化明显轻于VC组,甚至与BC组接近。这可能是在感染前期由于病毒大量增殖从而累积大量的氧化物质和消耗大量的抗氧化物,造成机体不可逆损伤,因此在感染24和48 h出现死亡高峰,到54 h时尚未来得及修复,这种变化,也进一步印证我们前面的推断。而 2个药物组,尤其是磷酸化修饰物组出现明显较轻的变化,说明其确实具有较好的抗DHAV-1感染作用和减轻肝损伤效果。
病毒是一种严格意义上的细胞寄生生物。它没有酶系统,只能依靠宿主细胞的代谢系统和能量来合成自己的蛋白质和核酸,完成自己的生命过程。中药的抗病毒作用主要分为直接抗病毒作用和间接抗病毒作用。中药的直接抗病毒作用包括抗病毒、抗感染和抑制繁殖,而多糖及其磷酸化修饰对病毒的复制和释放具有明显的抑制作用。病毒在细胞内的复制需要消耗大量的物质和能量,不可避免地会对宿主细胞的新陈代谢产生不利影响。在我们的研究中也发现磷酸化修饰提高了BSPRS对病毒复制的抑制能力,因此BSRPS和pBSRPS也可能通过上述间接抗病毒途径对病毒起到抑制作用,即调节代谢、减轻肝脏和氧化损伤。细胞内存在复杂的代谢过程,包括线粒体能量代谢、自噬和凋亡。病毒对这些过程的任何影响都会引起细胞代谢紊乱,导致进一步的氧化损伤甚至死亡。因此,多糖对DHAV-1感染的治疗作用及机制仍需进一步研究。
