小鼠胚胎期与成熟期肝脏表达谱芯片数据挖掘及生物信息学分析
2021-03-28杨书红
吕 兴 杨书红
1.武汉市泰康同济(武汉)医院普外科,湖北武汉 430050;2.华中科技大学同济医学院附属同济医院妇产科,湖北武汉 430030
肝脏的发育受到时间与空间的精细调控。肝脏发育不同阶段的差异表达基因(DEGs)对其结构形成、功能的成熟有关键作用。小鼠在孕8.5~9.5 d(人类孕23~26 d)可检测到肝细胞特异性遗传标记[1],从13.5 d 左右(人则从孕56~58 d 开始,孕210 d 左右结束)来源于内胚层组织的肝祖细胞开始向肝细胞及胆管细胞分化,随后在特定基因的调控下逐渐发育成熟,功能亦逐渐完善[2]。在此期间mRNA 表达谱亦随着时间逐渐发生变化[3]。为深度分析肝脏在胚胎期与成熟期表达基因差异性,本文将对胚胎期(ED14)与成熟期(PND 56)表达谱芯片进行分析,深度挖掘肝脏发育过程中的变化机制。
1 方法学
1.1 DEGs 的筛选
从美国国家生物技术信息中心(NCBI)的GEO数据库下载编号为GSE65063 的基因表达谱数据,提取其中ED14 及生后56 d(PND 56)芯片,采用在线分析软件GEO2R 完成DEGs 筛选,表达差异用差异倍数(fold change,FC)表示,筛选标准为P <0.001,|log2FC|≥2。将原始数据下载,匹配出筛选的上调及下调前25 个基因相对应的矩阵表达值,利用软件HemI 进行热点图绘制。采用Excel 绘制火山图。
1.2 DEGs 的富集分析
使用DAVID 在线分析网站分别对上调和下调DEGs 进行基因本体论(gene ontology,GO)及京都基因与基因组百科全书(KEGG)生物学通路富集分析。
1.3 DEGs 编码蛋白质的相互作用(PPI)分析
利用STRING 在线数据库对DEGs 所编码蛋白质进行分析,探寻PPI 规律(结合可信度选择0.7),运用CytoScape 软件完成可视化;随后进行功能模块构建(采用CytoScape 软件中加载的MCODE 插件),将排列前3 的模块分别导出,并将该3 个模块相关基因导入在线分析软件STRING 进行GO 与KEGG 分析。
1.4 筛选枢纽基因
采用Cytoscape 软件中加载的CytoHubba 插件中的12 种拓扑分析方法计算PPI 网络中各蛋白质的拓扑参数,将12 种算法所获参数从大到小进行排序,取前20 个基因,12 种算法中,初步认为有5 种及以上算法都排在前20 的基因为枢纽基因。
1.5 探讨关键枢纽基因的相互作用关系
使用STRING 数据库构建关键枢纽基因之间相互作用关系网络。
2 结果
2.1 DEGs 筛选结果
成熟期肝脏与胚胎期比较,共筛选出2969 个DEGs,其中上调1620 个,下调1349 个。如图1A箱线图所示,六组样本均值基本在一条直线,可用作后续分析。DEGs 火山图与前50 个DEGs 的热点图如图1B、C所示。
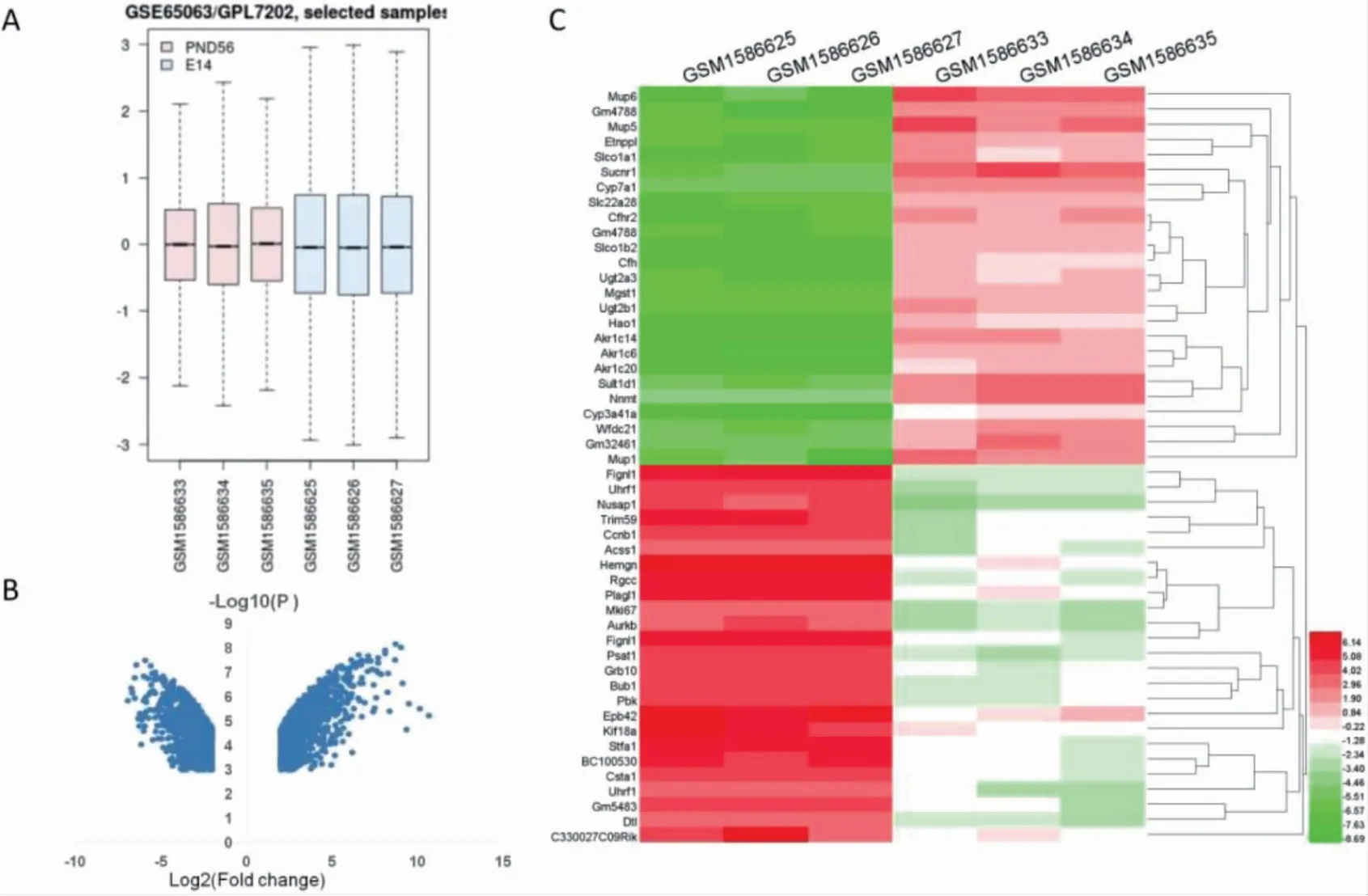
图1 GSE65063 芯片分析结果
2.2 DEGs GO 与KEGG 富集分析结果
GO 分析分为3 个部分:细胞组分、分子功能及生物过程。
2.2.1 上调DEGs 分析结果 如图2 所示,上调DEGs明显富集的细胞成分主要在细胞内膜结合细胞器、细胞外泌体、细胞器膜、线粒体等。富集的分子功能包括氧化还原酶活性、铁离子结合、单氧酶活性、芳香化酶活性等。生物过程主要富集在代谢相关过程包括氧化还原、脂代谢、脂肪酸代谢、三酰甘油及稳态维持等方面。上调DEGs 主要富集在代谢有关通路如代谢通路、化学致癌、视黄醇代谢、甾体激素合成等。
2.2.2 下调DEGs 分析结果 下调DEGs 明显富集的细胞成分则主要分布在细胞核、细胞浆、染色体、核质等与细胞增殖分裂相关的细胞器。分子功能富集的条目包括DNA 结合、核酸结合、蛋白结合、多聚(A)RNA 结合等。生物过程包括:细胞周期、细胞分裂、DNA 复制、DNA 修复等。这些条目与细胞增殖分裂密切相关。
下调DEGs 富集的KEGG 信号通路(FDR<0.05)与细胞增殖、分裂有关,如细胞周期、DNA 复制、错配修复等共7 条。见图3。
2.3 DEGs 的PPI 网络功能模块分析结果
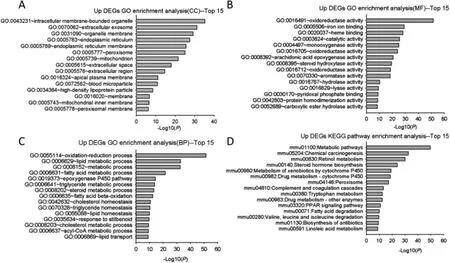
图2 上调DEGs GO 与KEGG 信号通路富集分析(展示前15 个条目)
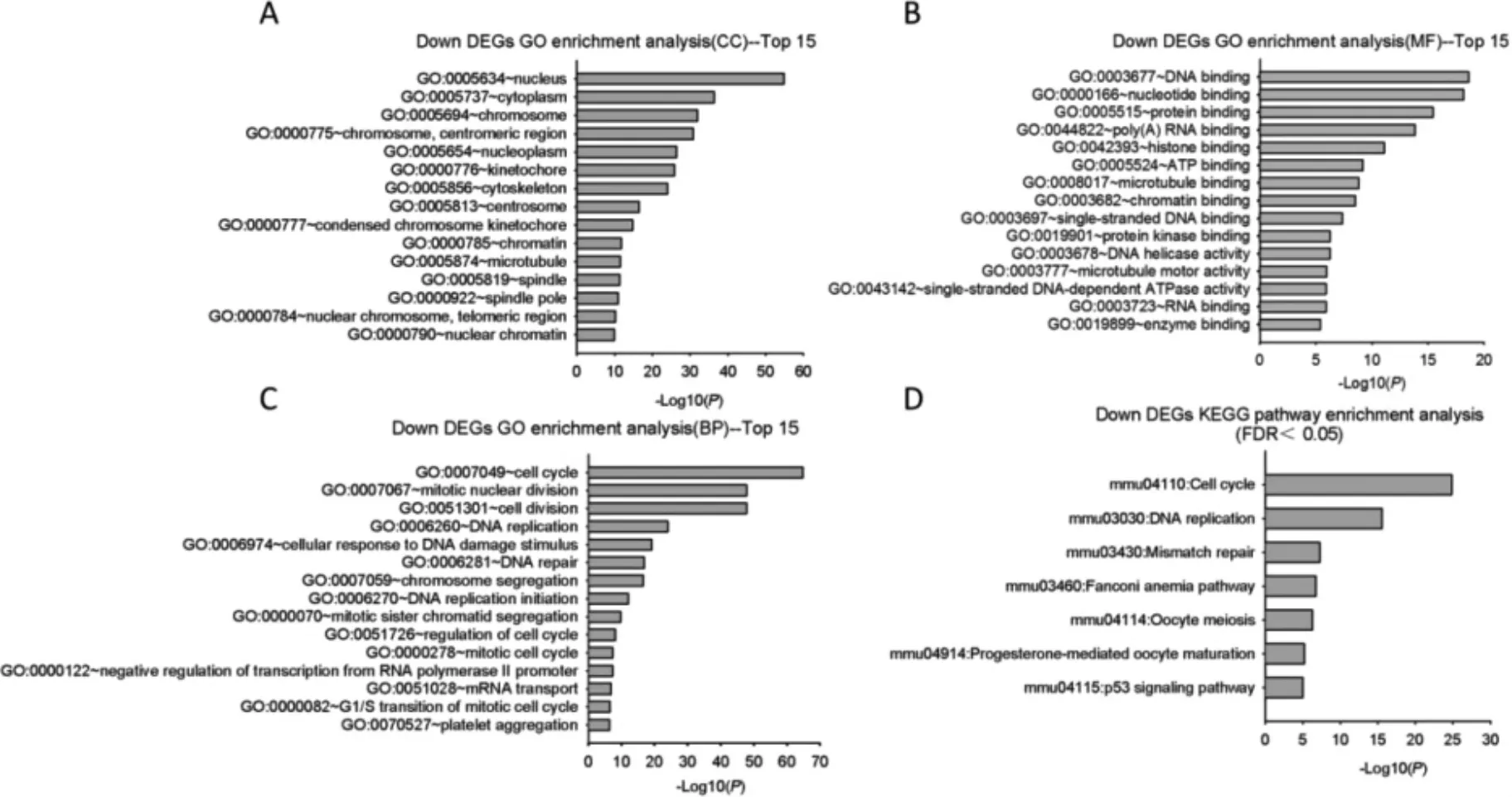
图3 下调DEGs GO 与KEGG 信号通路富集分析(展示前15 个条目)
模块一(图4A,见封三)全部为下调基因主要富集于与细胞周期、细胞衰老相关的信号通路。功能上亦富集于与细胞周期、分裂相关的细胞组分、生物过程及细胞器。模块二(图4B,见封三)主要与补体系统、胆固醇代谢及PARP 信号通路有关。模块三(图4C,见封三)主要与视黄醇代谢、甾体激素合成等代谢有关。
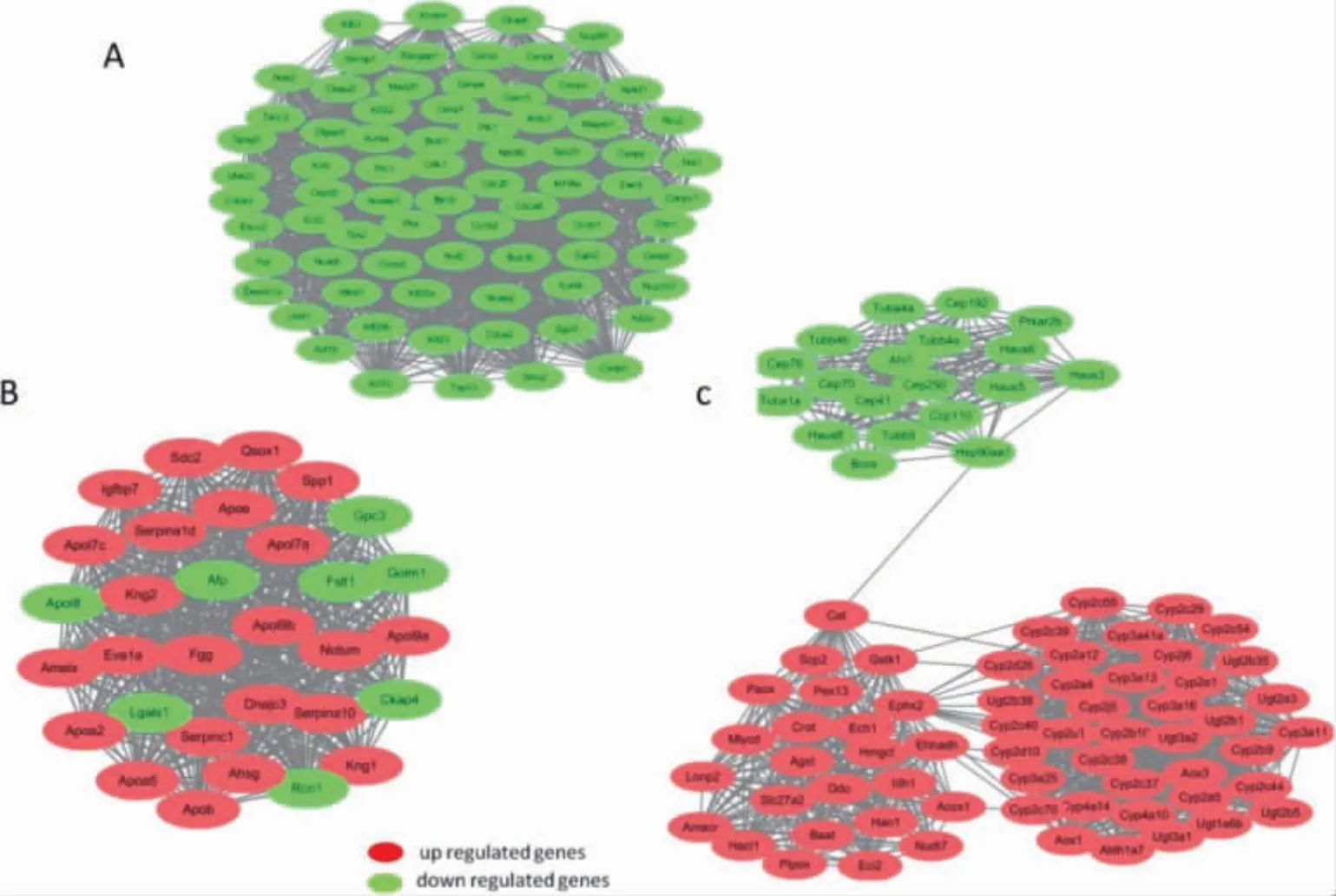
图4 PPI 网络中前3 位显著富集的基因模块
2.4 枢纽基因筛选结果
共筛选出16 个枢纽基因,其中14 个表达下调,包 括:Cdk1、Ccnb1、Cdc20、Plk1、Aurkb、Aurka、Birc5、Cdca8、Ube2i、Hsp90aa1、Mad2l1、Bub1b、Bub1 与Ndc80。2 个上调基因分别为Egfr 与Apob。
如图5A 所示,所有下调基因之间构成复杂调控网络。上调基因Egfr 与5 个下调基因(Ccnb1、Cdk1、Aurka、Hsp90aa1、Birc5)之间构成复杂调控关系。GO 与KEGG 分析(图5B)结果提示这些枢纽基因主要与卵母细胞减数分裂、孕激素介导的卵母细胞成熟、细胞周期等相关。功能上则与信号通路相呼应。
3 讨论

图5 枢纽基因PPI 网络图与功能分析
肝脏发育具有时间与空间特异性,本研究将胚胎期与成熟期肝脏表达谱芯片结果进行分析比较,发现这两个阶段肝脏表达基因具有显著差异,且上调差异基因群明显表现为肝脏功能相关基因,而下调基因群则与细胞增值分裂显著相关。这与Jochheim 等[3]的芯片结果一致,该研究比较了胚胎不同时期(E7.5、E11.5、E13.5)与成年期(2~7 月)小鼠肝脏基因表达差异,与本研究一致,成年期小鼠肝脏DGEs 主要与肝脏代谢功能成熟相关。这提示肝脏的生长发育及功能成熟受到不同基因群的精细调控,并且这种调控具有时间与空间特性。
在本研究中,上调与下调差异基因有明显的变化,功能变化尤其显著,体现了肝脏从发育阶段转换成功能发挥阶段。如上调基因在细胞中富集的细胞器成分包括细胞器膜、线粒体、过氧化物酶体等均为代谢密集发生地,这些场所分布着调控肝代谢的关键基因,维持着机体代谢稳态。若这些细胞器发生异常,则可出现代谢紊乱包括血脂异常、高胆固醇血症等[4]。而了解正常基因表达水平的变化是发现异常基因表达及其功能异常的基础。因此,这些差异基因是机体功能维持正常的根本,若基因发生异常如富集于过氧化物酶体相关基因ACOX2、ACOX1 缺陷则可出现脂肪酸代谢异常[5]。研究发现在上调基因中,上调倍数排在前三的主要尿蛋白:Mup6(10.7 倍)、Mup5(9.5 倍)、Mup1(9.4 倍)为脂质运载蛋白家族的成员。目前研究认为其主要表达于肝脏[6],在其他器官亦有表达,作为信息素及载体,可维持嗅神经电位稳定[7],与多种活动有关[8],但是这些基因表达缺失或者异常是否与肝脏代谢异常尚无相关研究,值得进一步探讨。
而下调基因群则主要为细胞增殖分裂相关基因。胚胎期肝脏处于快速发育期,一旦发育成熟,相关基因表达将下调,以达到维持肝脏功能转换的目的。这些基因的表达水平维持在一个平衡状态。如平衡被打破,下调基因表达上调,则提示肝脏可能出现异常增生。如下调倍数最多的基因Hemgn(Hemogen)(7.2 倍),与小鼠肝脏血窦发育密切相关,在人类对应的同源基因(embryonic develop-associated gene 1,EDAG-1)则可能与血液系统肿瘤、甲状腺癌有关[9-10],肿瘤患者放疗后亦出现该基因表达上调[11],但是否与肝脏肿瘤相关,尚无相关研究。值得注意的是,在下调基因富集的信号通路中,两条与卵母细胞减数分裂、成熟相关的通路亦下调,提示机体不同器官之间可能存在类似的调控机制,从而达到能量节省的目的,使机体更加协调一致。
PPI 网络通常在检查蛋白质网络结构和功能之间的关联以及识别新的蛋白质功能方面发挥重要作用[12-14]。在本研究中,PPI 网络分析发现排在首位的模块(MCODE 评分54.329)包含的基因均为下调基因,通过GO 及KEGG 分析发现这些基因主要富集于与细胞周期、细胞衰老相关类别。这提示肝脏成熟后,与细胞增殖相关基因被严格调控,从而对细胞内资源进行合理分配,更多资源分配于合成肝脏代谢相关蛋白,体现在排在第二(MCODE 评分31)及第三位(MCODE 评分23)模块主要向代谢相关基因富集。这进一步提示在肝脏功能转换过程中,基因表达模块亦出现相应调整,更加有利于功能的发挥。
在枢纽基因中,14 个下调基因主要与细胞周期相关。正常情况这些枢纽基因处于“沉睡状态”,而在异常情况下“沉睡状态”可能被唤醒。当处于胚胎期时,肝脏处于形成状态,因此表达丰度较高,肝脏成熟后,则其表达需相应下调。成熟期肝脏如出现表达上调,则提示肝脏可能出现异常。如肝部分切除后肝脏出现再生时,下述基因如Cdk1、Plk1、Cdc20、Aurka 上调,这与本研究结果相符合,当肝脏被切除部分后,再生机制被激活,因此细胞周期相关基因表达上调[15]。而当肝脏出现异常增生时,即肝脏出现肿瘤时,亦可能出现上述枢纽基因表达的上调。Yang 等[16]通过生物信息学分析发现,肿瘤组织中过表达枢纽基因如CDK1、CDC20、BUB1、BUB1B、MAD2L1 等预示肝细胞癌患者预后较差。此外,数个生信分析结果得出相似结果[17-19]。Hsp90aa1 作为其中枢纽基因之一,亦被证实与周围正常肝组织比较,癌组织表达丰度更高[20]。另有研究认为其可作为肝脏预后及监测指标[21]。Bracht 等[22]研究发现Birc5 基因缺陷的小鼠,肝脏再生受损,而Chaudhary 等[23]的研究则提示Birc5 可作为肝癌指标。上述研究结果表明相关枢纽基因可能与早期肝癌的诊断及预后密切相关。预示着这些枢纽基因可作为肝癌患者早期诊断及判断预后的指标。
上调枢纽基因为Egfr 与Apob。Egfr 与肝脏功能的发挥紧密相连,该受体参与肝脏的各项功能,肝脏疾病的发生亦与此基因相关[24]。Apob 则因与肝脏脂代谢密切相关,如出现异常,可出现高胆固醇血症等代谢疾病[25]。
综上,肝脏成熟期与胚胎期基因表达谱有显著差异,肝脏的发育及成熟在不同时间与空间受到特定基因群调控,在成熟期肝脏,以代谢相关基因为主,在胚胎期则主要富集于细胞增殖分裂相关基因。筛选出来的枢纽基因尤其是下调基因可能作为肝脏异常如肝癌等疾病的早期诊断与判断预后的指标,具有重要临床意义。
