两个番茄品种叶绿体超微结构及光合生理对弱光胁迫的响应
2021-03-26孟宪敏季延海孙旺旺武占会储昭胜刘明池
孟宪敏,季延海,2,孙旺旺,武占会,2,储昭胜,刘明池,2
两个番茄品种叶绿体超微结构及光合生理对弱光胁迫的响应
孟宪敏1,季延海1,2,孙旺旺3,武占会1,2,储昭胜1,刘明池1,2
1北京市农林科学院蔬菜研究中心,北京 100097;2农业农村部都市农业(华北)重点实验室,北京 100097;3北京市农林科学院北京农业生物技术研究中心,北京 100097
【】研究弱光下两个番茄品种叶绿体超微结构及光合生理特性,揭示不同番茄品种对弱光响应的差异,挖掘番茄耐弱光潜力。以本课题组筛选出的荷兰耐弱光品种‘佳西娜’和国内不耐弱光品种‘京丹1号’为试材,设置正常光照(CK,光强300—350 μmol·m-2·s-1),50%正常光照(弱光,光强70—80 μmol·m-2·s-1)处理15 d,观测植株叶绿素荧光成像,测定叶片叶绿素荧光参数和光合参数,并通过扫描电镜和透射电镜观察叶片气孔形态和叶绿体结构。与对照相比,弱光使2个番茄品种叶片的净光合速率(n)、光化学淬灭系数(P_Lss)、叶绿素(a+b)含量(chl.(a+b))、超氧化物歧化酶(SOD)活性、气孔密度和气孔规则分布的空间尺度降低,还导致植株干重与壮苗指数降低,叶片光稳态非化学荧光淬灭(_Lss)、丙二醛(MDA)含量与植株株高、最大节间距提高,而‘京丹1号’的变化幅度显著大于‘佳西娜’,且‘佳西娜’的实际光量子效率(_Lss)、实际光化学效率(即PSⅡ)及叶绿体结构基本没有改变,其叶片n显著高于‘京丹1号’。另外,弱光下,‘佳西娜’通过降低气孔间L(d)值来改善气孔的规则分布,并提高了叶绿素b(chl.b)含量,降低了chl.a/b,而‘京丹1号’chl.b含量却有所降低,chl.a/b提高,气孔规则分布的空间尺度与规则程度降低,叶片受弱光影响较严重。综上,‘佳西娜’捕光能力较强于‘京丹1号’,并将光合色素吸收的较多光能用于光化学传递,减少热耗散且提高了PSⅡ实际光化学速率及光能转化率,以维持其光合系统的运转,光合能力及产出比‘京丹1号’稍高,耐弱光能力强。2个番茄品种对弱光的响应差异主要表现在chl.b含量、气孔空间分布格局、叶绿体结构、SOD活性与光合荧光特性不同,使得荷兰耐弱光品种‘佳西娜’在弱光下能维持高效率的光合作用。
番茄;弱光;光合荧光特性;气孔;叶绿体
0 引言
【研究意义】番茄(L.)喜温喜光,是全世界设施栽培中的主要作物之一,冬春季广泛栽培于中国北方的单坡日光温室[1]。但日光温室内由于墙体、骨架或保温被等遮挡易形成弱光及低温环境,成为冬春茬产量和品质降低的阻碍[2-3]。研究认为秋冬季番茄开花结果期,对自然环境光强要求约为2 160 μmol·m-2·s-1,日光温室内植株冠层上方平均日辐射量860 μmol·m-2·s-1,光照时长也低于室外,远不能满足番茄正常生长需求[4]。然而荷兰全年光照严重不足,尤其冬至前后最短光照时长仅为5—6 h,一天光照累积量最低为150—200 J·cm-2[5],但荷兰番茄、黄瓜产量分别可达800和1 000 t·hm-2,是中国平均水平的3—4倍[6]。经过笔者对国内外番茄品种的多年研究和生产实践表明,除先进的补光技术外,品种的耐弱光差异是荷兰番茄高产的重要因素之一。因此,深入研究我国与荷兰番茄品种在弱光下的响应差异,对指导中国日光温室番茄品种选择具有重要意义。【前人研究进展】研究表明,弱光环境导致植株株高增加,可能出现徒长趋势,影响叶绿体结构发育[7-8],叶片净光合速率n[9-12]、叶绿素含量和PSⅡ实际量子效率(PSⅡ)下降[3],光合产物合成和输出减少[13-14],而膜脂过氧化程度较高,最终导致产量和品质降低,但因品种耐受性不同导致降低幅度有显著差异[3]。研究表明,叶片气体交换参数不仅与气孔密度及大小有关,也与气孔的空间分布格局有关[15]。Zheng等[16]发现气孔在叶片上空间分布规则时,最小邻域距离L(d)值较小,这一分析结果是通过Ripley’s K函数将叶片上可利用所有单点距离的二阶矩阵,来探究这些点在不同尺度上二维分布格局[17]。气孔在叶片上空间分布的规律在小尺度范围内呈规则分布,而大尺度范围内随机分布。【本研究切入点】前人对弱光的研究多采用白炽灯、日光灯或农艺钠灯等,此类光源能效大、成效低,也并不完全符合植物生长的最佳光谱成分,而日渐兴起的发光二极管(LED)作为日光温室的重要补光光源之一,正在发挥更大优势[18-19]。目前,针对品种耐弱光差异机理的研究较少,而且对不同基因型品种间光合生理特征及气孔、叶绿体结构的系统性研究较薄弱,也少见关于弱光下番茄叶片气孔分布的报道。【拟解决的关键问题】本试验采用LED灯作为光源进行弱光模拟试验,通过对番茄幼苗生长、叶片光合特性、气孔特征及分布、叶绿体超微结构等的研究,探明中国和荷兰品种间耐弱光性差异的机理。
1 材料与方法
试验于2018年在北京市农林科学院蔬菜研究中心人工气候室(LPH-1-CT)进行。
1.1 试验材料
以北京市农林科学院蔬菜研究中心选育的不耐弱光樱桃番茄品种‘京丹1号’和荷兰瑞克斯旺公司选育的较耐弱光温室品种‘佳西娜’为试材。
1.2 试验设计
采用72孔穴盘于2018年2月播种,所用基质为草炭﹕蛭石=2﹕1,于3叶一心时,挑选长势一致的健壮番茄植株随机分组,移至人工气候室开始试验。2个品种均设对照与弱光处理。以LED灯(PHILIPS)为光源,光质为红蓝光2﹕1[20],以正常光强300—350 μmol·m-2·s-1为对照,50%正常光照下光强70—80 μmol·m-2·s-1为弱光。共4个处理,各设3次重复,每个重复50株。光周期12 h,昼夜温度25℃/15℃,空气相对湿度60%—70%。苗期统一水肥管理,营养液采用北京市农林科学院蔬菜研究中心地下水改良番茄专用配方:5 mmol∙L-1KNO3、5 mmol∙L-1Ca(NO3)2·4H2O、2 mmol∙L-1MgSO4、1 mmol∙L-1KH2PO4、50 μmol∙L-1EDTA- NaFe、50 μmol∙L-1H3BO3、10 μmol∙L-1MnSO4·4H2O、0.8 μmol∙L-1ZnSO4·7H2O、0.4 μmol∙L-1CuSO4·5H2O、0.02 μmol∙L-1(NH4)6Mo7O24·4H2O)[21-22],85%磷酸调节营养液EC值(2.0±0.2)mS·cm-1,pH 6.5。为保证植株生长条件和胁迫程度的一致性,同一光强处理的架子上分别放置2个品种的番茄幼苗。处理12 h观测荧光成像,处理15 d测定生长、光合生理指标,观察叶片气孔、叶绿体超微结构。各指标均重复测定3次,取平均值。
1.3 测定项目及方法
1.3.1 生长指标 每处理选取代表性植株12株,用钢尺测定株高、最大节间距;游标卡尺测定茎粗;直尺测定叶长、叶宽,并计算叶面积;烘干称重法测定植株干重,计算壮苗指数。
1.3.2 酶活性 参考李合生[23]的方法测定超氧化物歧化酶(SOD)活性;参照Cakmak等[24]的方法测定丙二醛(MDA)含量。
1.3.3 叶片气体交换参数和光合色素含量 于8:30 —11:00采用LI-6400XT光合仪(美国LI-COR)测定第3功能叶片的净光合速率(n)、气孔导度(s)、胞间CO2浓度(i)及蒸腾速率(r)。采用6400-02B红蓝光源,对照光强800 µmol·m-2·s-1,弱光处理光强为100 µmol·m-2·s-1,CO2浓度(400±2)µmol·mol-1。将已测定光合参数的叶片摘下,参考Arnon[25]的95%乙醇浸提法测定并计算总叶绿素chl.(a+b)、叶绿素a、叶绿素b含量及叶绿素a/叶绿素b(chl.a/b)。
1.3.4 叶绿体超微结构 于上午8:30取第3功能叶片中部靠叶脉处附近2 mm×2 mm小块,用2.5%戊二醛固定,pH 7.2磷酸缓冲液冲洗,1%锇酸固定,乙醇-丙醇梯度脱水,Epon-812环氧树脂包埋,LKB-5型超薄切片机切片,醋酸铀-柠檬酸铅双重染色,透射电镜选取15—20个视野并拍照。
1.3.5 气孔特征及空间分布格局分析 取样方式同1.3.4,经冲洗及梯度脱水,CO2临界点干燥。把叶片粘到扫描样品台上,离子溅射仪喷涂镀膜,扫描电镜观测15—20个视野并拍照。Auto CAD 2009测量单个气孔的长度和宽度,计算周长(P)、面积(A)及形状指数(S)。S是通过计算单一气孔形状与相同面积圆之间的偏离程度来测量其形状的复杂程度[26]。
假定每个气孔都是叶片表面上分布的单点,气孔最中间位置为该单点的位置。取叶片远轴面中部,采用透明指甲油印迹法制作临时装片,于LEICA CTR 4000下观察,随机选5个视野,各拍3张照片。各处理选5张照片,计算气孔密度。利用Arc GIS 10.2将照片于相同的地理坐标、投影坐标系下进行数字化处理,再运用多距离空间聚类分析工具(Ripley’s K函数)对表征气孔分布状况的点进行空间分析[16-17],为了确定95%的可信任区间,采用蒙特卡洛算法模拟随机分布点1 000次,分析结果用L(d)值表示。

式中,L(d)表示最小邻域距离,K(d)为任何个体在一定空间尺度内对其他个体的期望值,d为空间尺度。
1.3.6 荧光参数及成像 处理12 h,采用Fluor Cam开放式叶绿素荧光成像系统(北京Eco Tech)测定第3功能叶片叶绿素荧光参数,以颜色的形式对参数大小进行注释,相应数据可直接从Report窗口导出。待测叶片经暗适应20 min,设定快门Shutter=1,敏感度Sensitivity=2.8,光照Act2=19,Super=20,采用protocols程序测定叶绿素荧光参数。
1.4 数据分析
用Microsoft Excel 2010及SPSS17.0软件进行数据处理与分析。
2 结果
2.1 番茄叶片叶绿体结构对弱光的响应
图1显示,正常光照下,2个番茄品种叶片的叶绿体结构良好,呈长椭圆形或梭形,基粒片层垛叠紧致,基质片层结构清晰,叶绿体被膜清晰、完整,有少量嗜锇颗粒。弱光下,‘佳西娜’的叶绿体有轻微膨胀,基粒片层垛叠整齐有序,结构清晰,只有少数叶绿体内含淀粉粒;‘京丹1号’的叶绿体趋于圆形或短粗形,发生严重肿胀,叶绿体膜严重溶解,片层结构数量减少并且变得混乱,基粒片层部分解体,模糊不清,叶绿体与细胞壁脱离而游离分布在细胞内,产生淀粉粒较多并有嗜锇颗粒积累。
2.2 番茄叶片气孔特征及空间分布格局对弱光的响应
弱光显著降低了气孔密度及宽度(表1)。‘佳西娜’和‘京丹1号’的气孔密度分别比其对照降低47.39%、51.24%(<0.05),气孔宽度分别比其对照降低19.77%、40.33%;弱光下,‘京丹1号’的气孔面积、周长、长度及形状指数最低(>0.05)(图2、表1)。
对叶片上单个气孔的空间分布格局分析,结果如图3。气孔在小尺度范围内呈规则分布,在大尺度范围内随机分布。2个品种的叶片气孔空间分布格局与单个气孔间L(d)值对弱光响应有差异,即对照叶片的气孔由规则分布转变为随机的空间尺度约为300 μm,而弱光下空间尺度减小为250 μm。弱光下‘京丹1号’叶片单个气孔间L(d)比其对照提高5.95%,‘佳西娜’的L(d)值最小,比其对照降低34.78%,说明弱光下‘佳西娜’的气孔在叶片上呈现更规则的空间分布格局。

图1 弱光对叶绿体超微结构的影响
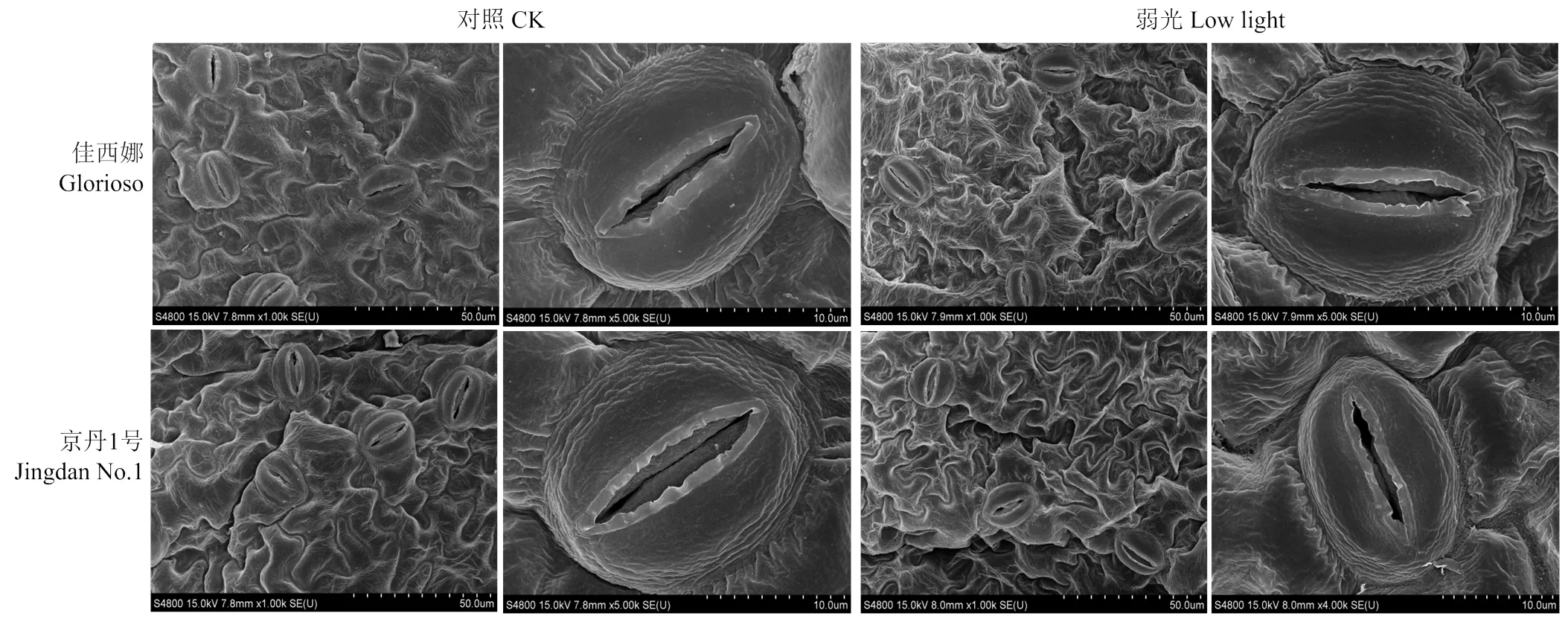
图2 叶片单个气孔的扫描电子显微镜照片

表1 弱光对叶片气孔特征的影响
不同小写字母表示处理间差异显著(<0.05)。下同
Different lower-case letters indicate significant differences among treatments (<0.05). The same as below

A、B分别为‘佳西娜’的对照和弱光处理,C、D分别为‘京丹1号’的对照和弱光处理。图中上下两条虚线代表95%置信区间的上下边界,红线代表K(d)值,绿线代表叶片上气孔分布由规则变为随机时,所对应的空间尺度和L(d)值。L(d)表示最小邻域距离,当L(d)值小于95%置信区间时,气孔在该尺度为规则分布,且L(d)的最小值越小,则气孔空间分布越规则
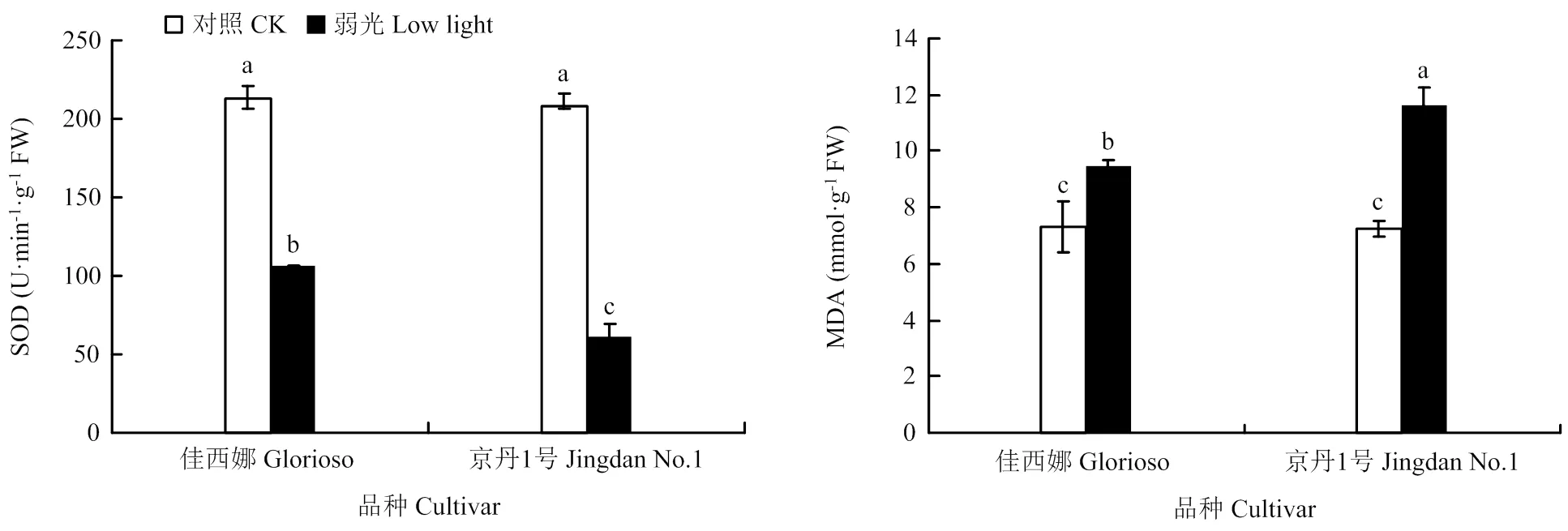
2.3 番茄叶片SOD活性及MDA含量对弱光的响应
由图4看出,弱光下2个番茄品种叶片SOD活性均显著低于同期对照处理,2个品种正常光照处理下(CK)差异不显著,弱光处理下‘佳西娜’SOD含量显著高于‘京丹1号’。弱光下2个番茄品种MDA含量显著上升,均显著高于正常光照处理。弱光下,‘佳西娜’和‘京丹1号’MDA分别较正常光照下显著提高28.88%和60.69%。
2.4 番茄叶片叶绿素含量及气体交换参数对弱光的响应
弱光处理后,‘佳西娜’番茄叶片Chl.a、Chl.(a+b)含量和Chl.a/b均显著低于对照植株,分别降低37.81%、27.38%和43.47%;Chl.b含量高于对照植株,但与对照差异并未达显著性水平。‘京丹1号’的Chl.a、Chl.(a+b)含量均高于对照植株,但均不显著。弱光处理下,‘佳西娜’的Chl.b含量比‘京丹1号’显著增加37.50%,Chl.a/b比‘京丹1号’显著降低25.47%(表2)。
由表3可知,弱光下,2个番茄品种的净光合速率(n)、气孔导度(s)、蒸腾速率(r)均低于对照。弱光处理下,‘佳西娜’的s、r与对照差异不显著,而‘京丹1号’分别比其对照显著降低40.00%和27.64%。弱光下,‘佳西娜’和‘京丹1号’的n分别比其对照显著降低33.65%、60.91%。弱光下,‘佳西娜’的胞间CO2浓度(i)较其对照提高7.94%,但未达到显著性差异,而‘京丹1号’较其对照显著降低8.52%。
不同小写字母表示处理间差异显著(P<0.05)。下同
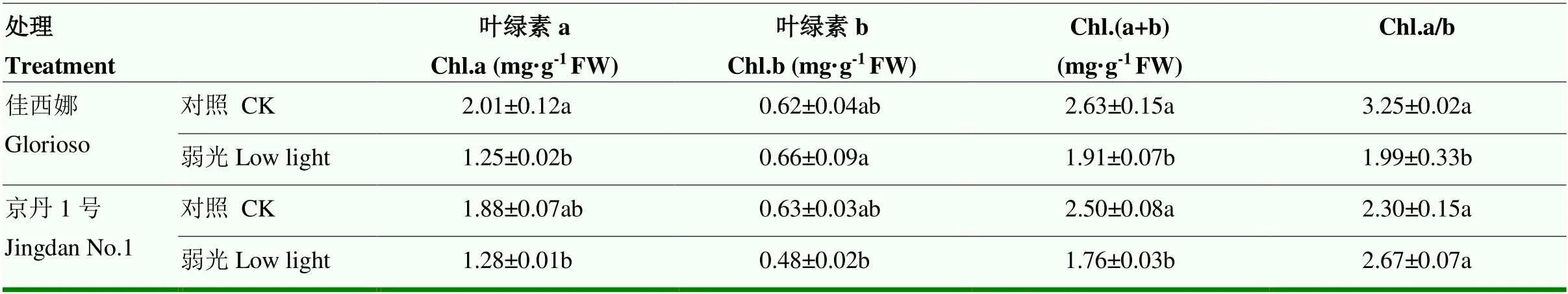
表2 弱光对叶片光合色素含量的影响

表3 弱光对叶片光合参数的影响
2.5 番茄叶片叶绿素荧光参数与荧光成像对弱光的响应
光照对暗适应过程PSⅡ最大光量子效率_max(即v/m)影响不显著(图5-A,B)。弱光下,相比对照植株,从光适应下实际光量子效率_Ln到光稳态下实际光量子效率_Lss,‘佳西娜’的_Ln值降低幅度逐渐减小,而‘京丹1号’的_Ln一直在其对照曲线内侧,降低幅度显著高于‘佳西娜’。弱光下,‘佳西娜’的_Lss和暗弛豫过程中PSⅡ实际光量子效率_Dn基本没有变化,而‘京丹1号’的_Lss比其对照降低14.29%。
弱光下,2个番茄品种的升高,‘佳西娜’升高幅度小于‘京丹1号’(图5-C,D),尤其是光适应下非光化荧光淬灭_Ln至光稳态非光化荧光淬灭_Lss。弱光下,‘京丹1号’曲线均位于雷达图最外侧,上升幅度较高;‘佳西娜’和‘京丹1号’的_Lss分别比其对照提高43.90%、55.73%,而光稳态光化学淬灭系数P_Lss分别比其对照降低9.33%、17.77%。光适应下,光化学淬灭P_Ln到暗弛豫过程中,光化学淬灭P_Dn均以‘京丹1号’降低幅度大。

蓝、红色线分别表示对照和弱光处理。A、C为‘佳西娜’,B、D为‘京丹1号’;A、B为光量子产量参数,C、D为荧光淬灭参数
弱光处理后,番茄叶片PSⅡ最大的光量子效率v/m、实际光化学效率(即PSⅡ)与叶绿素荧光成像见图6。v/m成像图显示,弱光下2个品种叶片边缘有较少蓝色或绿色,但整体与对照基本一致,证明叶片PSⅡ光系统未受到严重破坏;图看出,弱光下‘京丹1号’叶片颜色变化较明显,范围较大,而‘佳西娜’受伤害面积较少且主要集中于叶片边缘。图中,弱光下番茄叶片表面出现少量橘黄色和浅绿色部分,‘京丹1号’面积大于‘佳西娜’,且集中于叶片表面和边缘,说明弱光下‘京丹1号’叶片受影响程度较高。

图6 叶片叶绿素荧光成像图
2.6 番茄幼苗生长对弱光的响应
弱光下,2个品种的株高、叶面积与最大节间距显著提高,茎粗、壮苗指数和单株干重均降低(表4)。其中,相比各自对照处理,‘佳西娜’和‘京丹1号’的株高分别显著提高94.82%、105.58%(<0.05),壮苗指数分别显著降低56.25%、72.73%(<0.05),单株干重分别降低8.33%(>0.05)、45.00%(<0.05)。图7可见,弱光下‘京丹1号’变化幅度较大,其受弱光的影响更大。
3 讨论
3.1 弱光影响番茄叶片叶绿素含量与叶绿体超微结构
Ren等[27]发现弱光使玉米叶片叶绿体结构遭到破坏,叶绿素合成减少。而叶绿素b可以利用弱光下占比较高的蓝紫光,提高叶片捕光能力,以维持光系统稳定[28];其含量减少会导致激发能在光系统与电子传递间的分配不平衡,导致PSⅠ、PSⅡ间不稳定,一般直接表现为对逆境的耐受度降低[29]。有研究表明,弱光下,不结球白菜通过增加Chl.b含量以提高光合作用[2];Meng等[30]对弱光下番茄的研究表明叶片通过降低Chl.a/b,在一定程度上减轻对PSⅠ、PSⅡ的抑制。本试验中,弱光下2个番茄品种叶片总叶绿素含量均降低,但‘佳西娜’降低幅度小于‘京丹1号’,且‘佳西娜’的Chl.b含量较其对照提高6.48%。‘佳西娜’Chl.a/b比值降低,与ALA促进Chl.a向Chl.b转化有关[31],这一现象是‘佳西娜’适应逆境的表现[32]。说明弱光下,荷兰品种‘佳西娜’捕光能力强于‘京丹1号’,这是2个番茄品种弱光耐受性差异的原因之一。
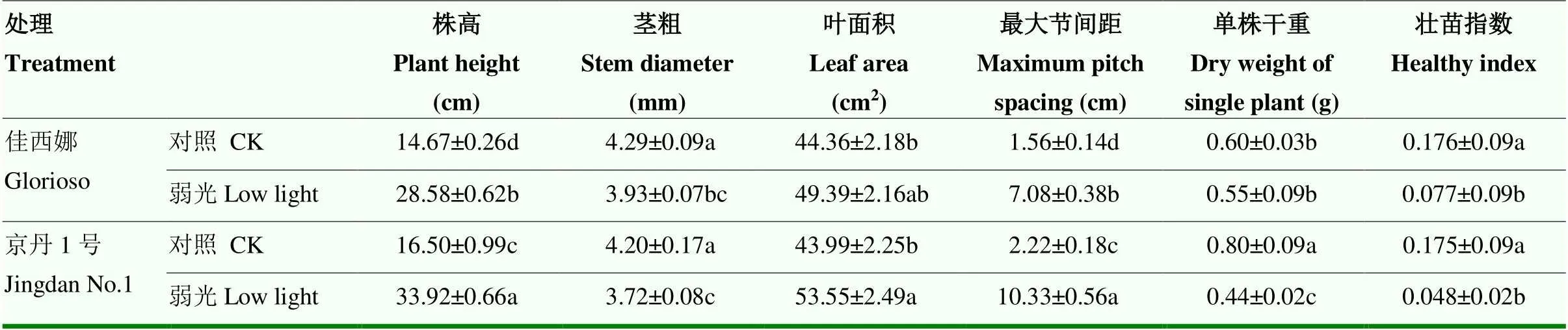
表4 弱光对番茄生长指标的影响
研究表明弱光会导致叶绿体结构发生不同程度的变化[10,29]。秦玉芝等[14]认为随着马铃薯对弱光环境的适应,其光合产物运输逐渐协调,叶绿体内淀粉粒积累减少。也有研究表明,相对于中度弱光胁迫,严重弱光会导致花生叶片叶绿体结构发生较大变化,淀粉粒数增多[33]。本试验中,弱光下的‘佳西娜’叶绿体基粒片层增多,垛叠整齐有序,结构清晰,少数叶绿体内含淀粉粒;而‘京丹1号’的基粒片层部分解体、模糊不清,大量淀粉粒积累。推测‘京丹1号’因n下降较多影响其无机磷供应,蔗糖在细胞质内外运输受阻,无机磷释放也随之减少,磷酸丙糖将主要用于叶绿体内储存淀粉。大量淀粉粒积累会对类囊体造成一定的机械损伤,并吸附部分碳同化相关酶,降低其酶活性[34]。意味着弱光下荷兰品种‘佳西娜’的光能利用率与环境适应性高于‘京丹1号’。
3.2 弱光影响番茄叶片气孔空间分布与光合气体交换参数
气孔是植株与外界环境进行H2O和CO2交换的重要介质,当植株遭受非生物胁迫后,叶片会通过调整气孔密度、开度或形状来缓解伤害[17,35]。本试验发现,弱光下2个番茄品种叶片的气孔密度及宽度均显著减小,‘佳西娜’比‘京丹1号’下降幅度少,可见‘佳西娜’自我调节能力较强。另外,弱光使2个番茄品种叶片气孔规则分布空间的尺度减小,‘佳西娜’的单个气孔间最小邻域距离L(d)略有降低,但‘京丹1号’的L(d)较其对照提高,说明弱光下‘佳西娜’的气孔空间分布比‘京丹1号’更规则;且n、s降低的同时i升高,CO2气体更易通过气孔扩散进入组织内部,影响光合作用的最大反应速率[36-37]。这是荷兰品种‘佳西娜’比‘京丹1号’耐弱光能力强的一个主要原因。
3.3 弱光影响番茄叶片叶绿素荧光参数与荧光成像
_max(即vm)反映了暗适应下PSⅡ反应中心光能转化效率,可作为判断植物对逆境耐受程度的指标[38]。(即PSⅡ)为PSⅡ反应中心电荷分离实际量子效率,反映PSⅡ吸收的光能不用于光化学反应,而以热能耗散掉的部分[39]。本研究发现光照对_max影响不大,与荧光显示结果一致,说明叶片PSⅡ没有受到严重破坏。弱光下2个番茄品种的_Ln、P_Ls、P_Ln与P_Dn下降,_Lss、_Ln和_Dn升高,表明弱光下植株通过热耗散消耗光合色素吸收的光能增多[40],光合中心有所损伤[41],可能会对RuBP再生产生抑制,但‘佳西娜’变化幅度显著低于‘京丹1号’。因此,弱光下相比‘京丹1号’,‘佳西娜’的天线色素吸收的激发能用于光化学传递的份额较多,热耗散比例少,反应中心开放比例和实际光化学速率较高,与其Chl.b含量高于‘京丹1号’的结果一致。通过叶绿素荧光成像图,发现‘佳西娜’叶片光合系统遭受损害主要位于叶片边缘,‘京丹1号’则于叶片表面大面积受影响,因此‘京丹1号’光合活性降低更多。这是荷兰品种‘佳西娜’对弱光抵御能力与适应能力较强的重要原因之一。
3.4 弱光影响番茄幼苗生长状况与SOD活性、MDA含量
植物处于逆境下,体内ROS增多,植物膜透性增大,膜脂肪酸中的不饱和键形成MDA[11];SOD可将ROS转化成H2O2,通过酶促系统减轻膜伤害,以保护植株[42]。本试验中,弱光下‘佳西娜’叶片的SOD活性降低较少,MDA含量低,膜脂过氧化程度较轻,而‘京丹1号’叶片过氧化程度严重。说明‘佳西娜’以提高SOD活性,来减轻叶绿体膜过氧化程度,提高逆境适应能力,这使荷兰品种‘佳西娜’对弱光耐受性强于‘京丹1号’。程亚娇等[43]认为弱光下,植株通过抑制茎横向生长,增加株高并将更多的光合同化产物转移至茎杆,以保证其营养供应,导致植株徒长。本试验中,弱光下2个番茄品种株也出现徒长现象,‘京丹1号’光合产出能力也低于‘佳西娜’。
4 结论
弱光下,‘佳西娜’植株变化幅度显著小于‘京丹1号’,其适应弱光环境的能力较强。主要表现在‘佳西娜’叶片Chl.b含量、气孔空间规则分布程度、_Lss、P_Lss与SOD活性高于‘京丹1号’,而_Lss、叶片受伤害面积及程度低于‘京丹1号’。因此,‘佳西娜’叶片的捕光能力较高,用于光化学传递的份额多,提高了实际光化学效率,保证了光合产物的输出平衡;且‘佳西娜’的叶绿体基粒片层垛叠整齐,光能转化效率较高,植株干重显著高于‘京丹1号’。
[1] SHU S, TANG Y Y, YUAN Y H, SUN J, ZHONG M, GUO S R. The role of 24-epibrassinolide in the regulation of photosynthetic characteristics and nitrogen metabolism of tomato seedlings under a combined low temperature and weak light stress. Plant Physiology and Biochemistry, 2016, 107: 344-353.
[2] ZHU H F, LI X F, ZHAI W, LIU Y, GAO Q Q, LIU J P, REN L, CHEN H Y, Zhu Y Y. Effects of low light on photosynthetic properties, antioxidant enzyme activity, and anthocyanin accumulation in purple pak-choi (ssp.Makino). PLoS ONE, 2017, 12(6), e0179305.
[3] 孙建磊, 王崇启, 肖守华, 高超, 李利斌, 曹齐卫, 王晓, 董玉梅, 焦自高. 弱光对黄瓜幼苗光合特性及Rubisco酶的影响. 核农学报, 2017, 31(6): 1200-1209.
SUN J L, WANG C Q, XIAO S H, GAO C, LI L B, CAO Q W, WANG X, DONG Y M, JIAO Z G. Effect of low light on photosynthesis and Rubisco of cucumber seedlings. Journal of Nuclear Agricultural Sciences, 2017, 31(6): 1200-1209. (in Chinese)
[4] 闫文凯. 日光温室人工补光对番茄光合作用及生长的影响[D]. 北京: 中国农业科学院, 2018.
YAN W K. Effects of artificial lighting on photosynthesis and growth of tomato in Chinese solar greenhouse [D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. (in Chinese)
[5] 刘铭, 张英杰, 吕英民. 荷兰设施园艺的发展现状. 农业工程技术(温室园艺), 2010(8): 24-33.
LIU M, ZHANG Y J, Lü Y M. The development and present situation of Dutch horticulture.Agriculture Engineering Technology (Greenhouse & Horticulture), 2010(8): 24-33. (in Chinese)
[6] 蒋卫杰, 邓杰, 余宏军. 设施园艺发展概况、存在问题与产业发展建议. 中国农业科学, 2015, 48(17): 3515-3523.
JIANG W J, DENG J, YU H J. Development situation, problems and suggestions on industrial development of protected horticulture. Scientia Agricultura Sinica, 2015, 48(17): 3515-3523. (in Chinese)
[7] Aliferis K A, Chrysayi-Tokousbalides M, Fasseas C. Physiological and ultrastructural changes in “green islands” onleaves caused by (8, 16) - (–) -pyrenophorin. Plant Physiology and Biochemistry, 2006, 44(11/12): 851-856.
[8] 艾希珍, 郭延奎, 马兴庄, 邢禹贤. 弱光条件下日光温室黄瓜需光特性及叶绿体超微结构. 中国农业科学, 2004, 37(2): 268-273.
AI X Z, GUO Y K, MA X Z, XING Y X. Photosynthetic Characteristics and ultrastructure of chloroplast of cucumber under low light intensity in solar greenhouse. Scientia Agricultura Sinica, 2004, 37(2): 268-273. (in Chinese)
[9] Murchie E H, Hubbart S, Peng S, Horton P. Acclimation of photosynthesis to high irradiance in rice: gene expression and interactions with leaf development. Journal of Experimental Botany, 2005, 56(411): 449-460.
[10] 王学文, 王玉珏, 付秋实, 赵冰, 郭仰东. 弱光逆境对番茄幼苗形态、生理特征及叶片超微结构的影响. 华北农学报, 2009, 24(5): 144-149.
WANG X W, WANG Y J, FU Q S, ZHAO B, GUO Y D. Effects of low light stress on morphological trait, physiological characters and leaf ultrastructure of tomato (L.) seedlings. Acta Agriculturae Boreali-Sinica, 2009, 24(5): 144-149. (in Chinese)
[11] Kanazawa S, Sano S, Koshiba T, Ushimaru T. Changes in antioxidative enzymes in cucumber cotyledons during natural senescence: comparison with those during dark-induced senescence. Physiologia Plantarum, 2010, 109(2): 211-216.
[12] 李翔, 桑勤勤, 束胜, 孙锦, 郭世荣. 外源油菜素内酯对弱光下番茄幼苗光合碳同化关键酶及其基因的影响. 园艺学报, 2016, 43(10): 2012-2020.
LI X, SANG Q Q, SHU S, SUN J, GUO S R. Effects of epibrassinolide on the activities and gene expression of photosynthetic enzymes in tomato seedlings under low light. Acta Horticulturae Sinica, 2016, 43(10): 2012-2020. (in Chinese)
[13] 杨柳燕, 陈菁菁, 陈年来. 甜瓜叶片光合产物输出能力对弱光的响应. 中国农业科学, 2018, 51(13): 2561-2569.
YANG L Y, CHEN J J, CHEN N L. Responses of leaf assimilate export to lowlight stress in melon. Scientia Agricultura Sinica, 2018, 51(13): 2561-2569. (in Chinese)
[14] 秦玉芝, 邢铮, 邹剑锋, 何长征, 李炎林, 熊兴耀. 持续弱光胁迫对马铃薯苗期生长和光合特性的影响. 中国农业科学, 2014, 47(3): 537-545.
QIN Y Z, XING Z, ZOU J F, HE C Z, LI Y L, XIONG X Y. Effects of sustained weak light on seedling growth and photosynthetic characteristics of potato seedlings. Scientia Agricultura Sinica, 2014, 47(3): 537-545. (in Chinese)
[15] Apple M E, Olszyk D M, Ormrod D P, Lewis J, Southworth D, Tingey D T. Morphology and stomatal function of douglas fir needles exposed to climate change: Elevated CO2and temperature. International Journal of Plant Sciences, 2000, 161(1): 127-132.
[16] Zheng Y P, Xu M, Hou R X, Shen R C, Qiu S, Ouyang Z. Effects of experimental warming on stomatal traits in leaves of maize (L.).Ecology and Evolution, 2013, 3(9): 3095-3111.
[17] 郭丽丽, 郝立华, 贾慧慧, 李菲, 张茜茜, 曹旭, 徐明, 郑云普. NaCl胁迫对两种番茄气孔特征、气体交换参数和生物量的影响. 应用生态学报, 2018, 29(12): 3949-3958.
GUO L L, HAO L H, JIA H H, LI F, ZHANG Q Q, CAO X, XU M, ZHENG Y P. Effects of NaCl stress on stomatal traits, leaf gas exchange parameters, and biomass of two tomato cultivars. Chinese Journal of Applied Ecology, 2018, 29(12): 3949-3958. (in Chinese)
[18] Wang Y W, Zhang B, Kai C. Design and development of intelligent LED plant light supplement system based on solar - powered for facility agriculture. Applied Mechanics and Materials, 2014(672/674): 26-29.
[19] Davis P A, Burns C. Photobiology in protected horticulture. Food and Energy Security, 2016, 5(4): 223-238.
[20] LIU X Y, GUO S R, XU Z G, JIAO X L, Takafumi T. Regulation of chloroplast ultrastructure, cross-section anatomy of leaves and morphology of stomata of cherry tomato by different light irradiations of LEDs. Hortscience, 2011, 46(2): 217-221.
[21] 刘增鑫. 特种蔬菜无土栽培. 北京: 中国农业出版社. 2000.
Liu Z X. Soilless Cultivation of Special Vegetables. Beijing: China Agriculture Press, 2000. (in Chinese)
[22] 郭世荣. 无土栽培学. 北京: 中国农业出版社. 2011.
Guo S R. Soilless Culture. Beijing: China Agriculture Press. 2011. (in Chinese)
[23] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 1998.
LI H S. Principle and Technology of Plant Physiology and Biochemistry Experiment. Beijing: Higher Education Press, 1998. (in Chinese)
[24] Cakmak I, Marschner H. Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase, and glutathione reductase in bean leaves. Plant Physiology, 1992, 98: 1222-1227.
[25] Arnon D L. Copper enzymes in isolated chloroplasts, polyphenol oxidase in.Plant Physiology, 1949, 24(1): 1-15.
[26] 黄磊, 孙耀清, 郝立华, 党承华, 朱玉, 王贺新, 程东娟, 张运鑫, 郑云普. 高温对北高丛越橘叶片结构和生理代谢的影响. 园艺学报, 2016, 43(6): 1044-1056.
HUANG L, SUN Y Q, HAO L H, DANG C H, ZHU Y, WANG H X, CHENG D J, ZHANG Y X, ZHENG Y P. Effects of high temperatures on leaf structures and physiological metabolism of north highbush blueberry. Acta Horticulturae Sinica, 2016, 43(6): 1044-1056. (in Chinese)
[27] Ren B Z, Zhang J W, Dong S T, Liu P, Zhao B. Effects of waterlogging on leaf mesophyll cell ultrastructure and photosynthetic characteristics of summer maize. PLoS ONE, 2016, 11(9): e0161424.
[28] Cornah J E, TERRY M J, SMITH A G. Green or red: What stops the traffic in the tetrapyrrole pathway? Trends in Plant Science, 2003, 8(5): 224-230.
[29] Chu H A, Nguyen A P, Debus R J. Site-directed photosystem II mutants with perturbed oxygen-evolving properties. 1. instability or inefficient assembly of the manganese cluster. Biochemistry, 1994, 33(20): 6150-6157.
[30] Meng Z J, Lu T, Zhang G X, Qi M F, Tang W, Li L L, Liu Y F, Li T L. Photosystem inhibition and protection in tomato leaves under low light. Scientia Horticulturae, 2017, 217: 145-155.
[31] 安玉艳, 张丽颖, 冯新新, 田凡, 李洁, 汪良驹. 5-氨基乙酰丙酸对苹果叶片耐弱光能力的影响. 西北植物学报, 2016, 36(5): 987-995.
AN Y Y, ZHANG L Y, FENG X X, TIAN F, LI J, WANG L J. Effects of 5-aminolevulinic acid on low light tolerance of apple leaves. Acta Botanica Boreali-Occidentalia Sinica, 2016, 36(5): 987-995. (in Chinese)
[32] Rüdiger W. Biosynthesis of chlorophyll, and the chlorophyll cycle. Photosynthesis Research, 2002, 74(2): 187-193.
[33] 吴正锋, 孙学武, 王才斌, 郑亚萍, 万书波, 刘俊华, 郑永美, 吴菊香, 冯昊, 于天一. 弱光胁迫对花生功能叶片RuBP羧化酶活性及叶绿体超微结构的影响. 植物生态学报, 2014, 38(7): 740-748.
WU Z F, SUN X W, WANG C B, ZHENG Y P, WAN S B, LIU J H, ZHENG Y M, WU J X, FENG H, YU T Y. Effects of low light stress on rubisco activity and the ultrastructure of chloroplast in functional leaves of peanut. Acta Phytoecologica Sinica, 2014, 38(7): 740-748. (in Chinese)
[34] 姚允聪, 王绍辉, 孔云. 弱光条件下桃叶片结构及光合特性与叶绿体超微结构变化. 中国农业科学, 2007, 40(4): 855-863.
YAO Y C, WANG S H, KONG Y. Characteristics of photosynthesis machinism in different peach species under low light intensity. Scientia Agricultura Sinica, 2007, 40(4): 855-863. (in Chinese)
[35] Casson S, Gray J E. Influence of environmental factors on stomatal development. New Phytologist, 2008, 178(1): 9-23.
[36] 朱玉, 黄磊, 党承华, 王贺新, 姜国斌, 李根柱, 张自川, 娄鑫, 郑云普. 高温对蓝莓叶片气孔特征和气体交换参数的影响. 农业工程学报, 2016, 32(1): 218-225.
ZHU Y, HUANG L, DANG C H, WANG H X, JIANG G B, LI G Z, ZHANG Z C, LOU X, ZHENG Y P. Effects of high temperature on leaf stomatal traits and gas exchange parameters of blueberry. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(1): 218-225. (in Chinese)
[37] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33: 317-345.
[38] 张守仁. 叶绿素荧光动力学参数的意义及讨论. 植物学通报, 1999, 16(4): 444-448.
ZHANG S R. A discussion on chlorophyll fluorescence kinetics parameters and their significance. Chinese Bulletin of Botany, 1999, 16(4): 444-448. (in Chinese)
[39] Genty B, Briantais J M, Baker N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence.Biochimica et Biophysica Acta (BBA)-General Subjects, 1989, 990(1): 87-92.
[40] 艾希珍, 王秀峰, 崔志峰, 王振林. 钙对弱光亚适温下黄瓜光合作用的影响. 中国农业科学, 2006, 39(9): 1865-1871.
AI X Z, WANG X F, CUI Z F, WANG Z L. Effect of calcium on photosynthesis of cucumber under low light intensity and sub-optimal temperature. Scientia Agricultura Sinica, 2006, 39(9): 1865-1871. (in Chinese)
[41] 孙德智, 韩晓日, 彭靖, 范富, 张庆国. 外源NO对Ca(NO3)2胁迫下番茄幼苗PSII功能及光能分配利用的影响. 核农学报, 2016, 30(12): 2451-2459.
SUN D Z, HAN X R, PENG J, FAN F, ZHANG Q G. Effect of exogenous nitric oxide on PSII function and distribution and utilization of luminous energy in tomato seedlings under stress of Ca(NO3)2. Journal of Nuclear Agricultural Sciences, 2016, 30(12): 2451-2459. (in Chinese)
[42] Kornyeyev D, Logan B A, Payton P, Allen R D, Holaday A S. Enhanced photochemical light utilization and decreased chilling-induced photoinhibition of photosystem II in cotton overexpressing genes encoding chloroplast-targeted antioxidant enzymes. Physiologia Plantarum, 2001, 113(3): 323-331.
[43] 程亚娇, 谌俊旭, 王仲林, 范元芳, 陈思宇, 李泽林, 刘沁林, 李中川, 杨峰, 杨文钰. 光强和光质对大豆幼苗形态及光合特性的影响. 中国农业科学, 2018, 51(14): 2655-2663.
CHENG Y J, SHEN J X, WANG Z L, FAN Y F, CHEN S Y, LI Z L, LIU Q L, LI Z C, YANG F, YANG W Y. Effects of light intensity and light quality on morphological and photosynthetic characteristics of soybean seedlings. Scientia Agricultura Sinica, 2018, 51(14): 2655-2663. (in Chinese)
Response of Chloroplast Ultrastructure and Photosynthetic Physiology of Two Tomato Varieties to Low Light Stress
MENG XianMin1, JI YanHai1,2, SUN WangWang3, WU ZhanHui1,2, CHU ZhaoSheng1, LIU MingChi1,2
1Vegetable Research Center, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100097;2Key Laboratory of North China Urban Agriculture, Ministry of Agriculture and Rural Affairs, Beijing 100097;3Beijing Agro-Biotechnology Research Center, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100097
【】 The chloroplast ultrastructure and photosynthetic physiological characteristics of two tomato cultivars under low light were studied to reveal the difference of the response of different tomato cultivars to low light and explore the potential oftolerance to low light. 【】The Dutch low-light tolerance cultivar Glorioso and the Chinese low-light sensitive cultivar Jingdan No. 1 were selected as experimental materials, they exposed to normal light (CK, light intensity 300-350 μmol·m-2·s-1) and 50% normal light (low light, light intensity 70-80 μmol·m-2·s-1) for fifteen days. The plant chlorophyll fluorescence imaging, chlorophyll fluorescence and photosynthetic parameters of leaves were detected. We also observed stomatal morphology and chloroplast ultrastructure of leaves after treatment by the scanning electron microscopy (SEM) and transmission electron microscopy (TEM). 【】 Compared with the control, then,P_Lss, the content of chl. (a+b), SOD activity, stomatal density and spatial scale of regular stomatal distribution of the two cultivars leaves were decreased, which also led to the decrease of dry weight and healthy index, the leaves_Lss, MDA content increased with plant height and maximum internode spacing. The variation range of Jingdan No. 1 was significantly larger than Glorioso, the_Lss,(PSⅡ) and chloroplast structure of Glorioso remained unchanged, itsnin leaves was significantly higher than Jingdan No. 1. In addition, the Glorioso improved the regular distribution of stomata by reducing the value of L(d) between stomata, chl.b content increased and chl.a/b decreased under low light. While the chl.b content of Jingdan No. 1 decreased, chl.a/b increased, the spatial scale and regularity of stomatal regular distribution reduced and the leaves were seriously affected by low light. To sum up, Glorioso has stronger light-harvesting ability than Jingdan No. 1 under low light, and uses more light energy absorbed by photosynthetic pigments for photochemistry transfer, reduced heat dissipation and improves the actual photochemistry rate, light energy conversion rate of PSII, so as to maintain operation of photosynthetic system under low light, which photosynthetic capacity and output are slightly higher than Jingdan No. 1, and has strong low light tolerance.【】 The differences of response to low light between the two tomato cultivars were mainly reflected in chl.b content, stomatal spatial distribution pattern, chloroplast structure, SOD activity and photosynthetic fluorescence characteristics, which made the Dutch cultivar Glorioso maintain high photosynthesis efficiency under low light.
tomato; low light; photosynthetic fluorescence characteristics; stomata; chloroplast

10.3864/j.issn.0578-1752.2021.05.013
2020-05-21;
2020-08-18
国家大宗蔬菜产业技术体系北京综合试验站(CARS-23-G-06)、青海省科技计划(2018-NK-103)、北京市农林科学院科技创新能力建设专项(KJCX20180705)
孟宪敏,E-mail:1475102978@qq.com。通信作者刘明池,E-mail:liumingchi@nercv.org
(责任编辑 赵伶俐)
