TRIM11 对骨肉瘤细胞增殖、凋亡的影响及其机制研究
2021-03-26王兆丰许晓波唐文潇朱有才胡继超张新根
王兆丰,许晓波,唐文潇,朱有才,胡继超,张新根
骨肉瘤是一种侵袭性的原始骨间充质肿瘤[1]。近年来尽管预后有所改善,但转移性或复发性骨肉瘤的临床治疗仍然具有挑战性,在过去的三十年里,治疗基本上没有改变[2]。目前的治疗方法主要包括手术切除和全身化疗(如阿霉素和顺铂)。然而,患者很快就会产生耐药性并复发。据报道,药物流入/流出蛋白的过度表达、DNA修复的增强和致癌信号转导通路的激活是骨肉瘤化疗耐药的原因[3]。因此,通过研究特异性致癌信号通路和致癌基因改善骨肉瘤的治疗与预后受到了广泛的关注。TRIM11 是TRIM家族的重要成员之一,研究表明TRIM家族的多个成员可通过Wnt/ -catenin、IFN、p53 等信号通路直接参与肿瘤的调控[4-5]。本研究旨在探讨TRIM11 基因对骨肉瘤细胞增殖与凋亡的影响,为骨肉瘤的治疗与预后提供新的依据。
1 资料与方法
1.1 材料与试剂 人骨肉瘤细胞株MG63、HOS、U2OS、Saos-2、143B 购自上海细胞库;TRIM11-SiRNA 骨肉瘤细胞株Saos-2 购自源井生物科技公司;胎牛血清(FBS)、DMEM 培养基、青链霉素购自Solarbio 公司;TRIM11 一抗、GAPDH 一抗、辣根过氧化物酶标记羊抗兔IgG 购自Proteintech 公司;Q-PCR试剂盒、ECL发光液、RIPA蛋白裂解液、CCK8 试剂盒购自上海碧云天公司;流式细胞仪、实时荧光定量PCR 仪、化学发光凝胶成像仪购自美国Bio-Rad 公司;超净工作台、大小型高速冷冻离心机购自常州诺基仪器有限公司。
1.2 方法
1.2.1 细胞培养 采用含10%FBS、1%青链霉素的DMEM培养液培养成骨细胞和骨肉瘤细胞MG63、HOS、U2OS、Saos-2及143B。置于37℃5%CO2饱和湿度下对细胞进行培养,0.25%胰蛋白酶进行消化、传代,取对数生长期的细胞进行实验。
1.2.2 分析TRIM11 在骨肉瘤细胞和正常成骨细胞中的表达 取骨肉瘤细胞及正常成骨细胞,按照RNA提取试剂盒说明书要求操作提取各细胞RNA定量,逆转录合成cDNA,按照q-PCR 试剂盒说明书操作进行检测TRIM11 基因的表达。采用RIPA 提取各组细胞蛋白,采用BCA 法蛋白定量后,取蛋白样品15 g进行电泳,转膜、封闭、加入TRIM11 抗体孵育。洗涤之后加入辣根过氧化酶标记的二抗,孵育,洗涤后用ECL 化学发光试剂反应,曝光后扫描。
1.2.3 基因芯片数据集信息分析 通过GEO(编号E-MEXP-3628)数据库(http://www.ncbi.nlm.nih.gov/geo/)下载高通量数据集GSE16102 和GSE39055 分析TRIM11 基因高表达与骨肉瘤患者预后不良的关系。
1.2.4 细胞株筛选 取对数增长期的五种骨肉瘤细胞,采用Q-PCR 和Western blot检测(操作步骤同1.2.2)五种细胞株中TRIM11 基因和蛋白的表达。
1.2.5 CCK8 实验 细胞分组正常骨肉瘤细胞Saos-2、SiRNA-NC 骨肉瘤细胞Saos-2、Trim11-SiRNA 骨肉瘤细胞Saos-2,按照CCK8 试剂盒说明书要求检测3 组细胞0、12、24、48 及72h 的细胞增殖情况,采用流式细胞仪检测三组细胞的凋亡情况。
1.2.6 基因集富集分析 采用GSEA 2.2.1 版本软件对E-MEXP-3628 数据库中的骨肉瘤表达谱芯片GSE16102 和GSE39055数据集进行分析,参照基因集由GSEA 网站MisgDB 数据库中的生物信号传导相关的基因集,利用缺省加权富集统计的方法进行富集分析,设置随机组合次数1 000 次。
1.3 统计方法 采用Graph Pad Prism6.0 软件进行数据分析,计量资料用均数±标准差表示,采用 检验。<0.05为差异有统计学意义。
2 结果
2.1 TRIM11 基因和蛋白在骨肉瘤细胞和正常骨成骨细胞中的表达 相对于正常成骨细胞,骨肉瘤细胞中TRIM11 的基因和蛋白明显上调(均<0.05)。见封二彩图2。

图2 TRIM11 基因和蛋白在骨肉瘤细胞和正常骨细胞的表达
2.2 TRIM11 基因高表达与骨肉瘤患者预后不良的关系 相对于正常组,骨肉瘤组TRIM11 基因表达明显上调(<0.05);TRIM11 表达上调与骨肉瘤患者预后不良呈正相关(<0.05)。见封二彩图3~4。
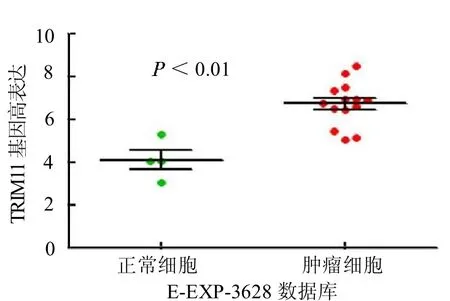
图3 TRIM11 基因在骨肉瘤和正常组织中的表达

图4 TRIM11 高表达与预后不良的影响
2.3 TRIM11 在5 种骨肉瘤细胞株的表达情况 相对于其他细胞株,HOS 细胞株中TRIM11 基因与蛋白表达量最低,而Saos-2 细胞株中TRIM11 表达量较高。因此本研究选择Saos-2 细胞株作为目标骨肉瘤细胞株开展细胞功能试验。见封二彩图5。

图5 A:TRIM11 基因在五种骨肉瘤细胞中的表达;B:TRIM11 蛋白在五种骨肉瘤细胞中的表达
2.4 TRIM11基因干扰后对Saos-2细胞增殖和凋亡的影响 相对于对照组,NC组细胞增殖活性无明显变化(>0.05);与NC 组比较,Trim11-SiRNA 细胞增殖活性明显降低(<0.05)。与对照组比较,NC 组细胞凋亡情况无明显变化(>0.05);与NC 组比较,Trim11-SiRNA细胞凋亡明显增多(<0.05)。见封二彩图6 ~7。
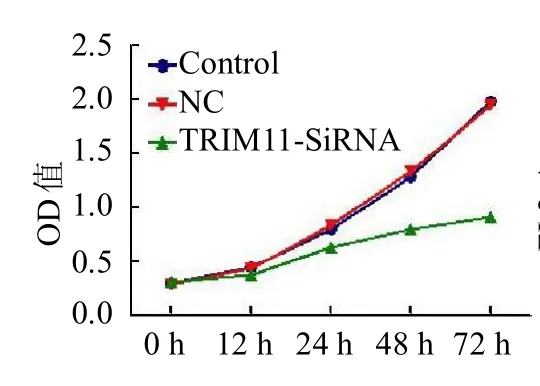
图6 TRIM11 基因干扰后对骨肉瘤细胞Saos-2 增殖的影响
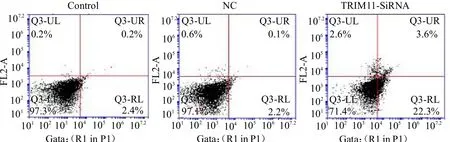
图7 TRIM11 基因干扰后对Saos-2 细胞凋亡的影响
2.5 TRIM11 基因表达对Cell cycle 和MAPK 信号通路的影响 骨肉瘤中TRIM11 基因表达上调会激活Cell cycle和MAPK 信号通路,骨肉瘤中TRIM11基因表达下调会抑制 Cell cycle 和MAPK 信号通路。见封三彩图1 ~2。
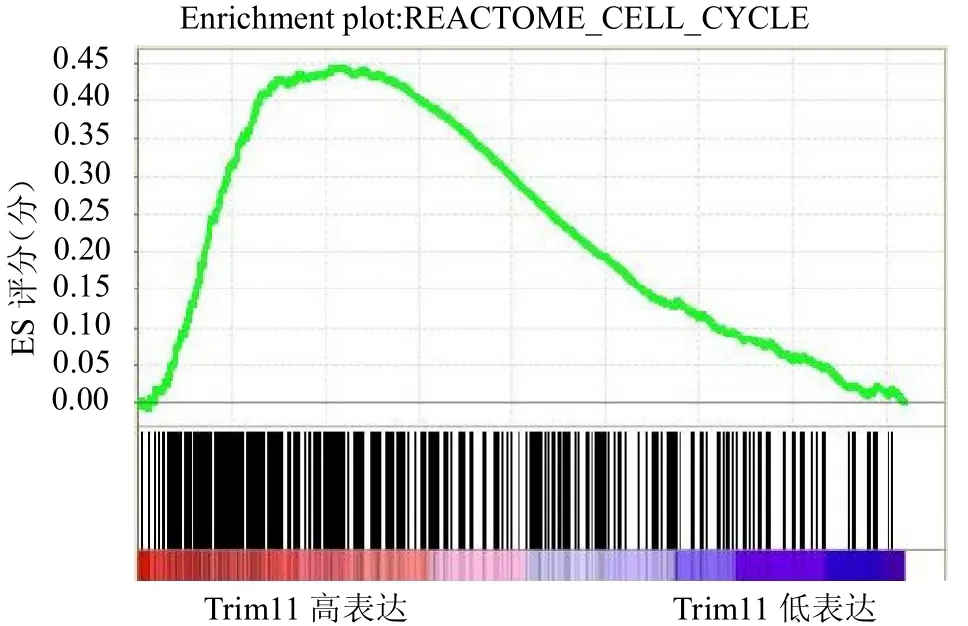
图1 骨肉瘤中TRIM11 基因表达对Cell cycle 信号通路的影响

图2 骨肉瘤中TRIM11 基因表达对MAPK 信号通路的影响
3 讨论
目前针对骨肉瘤的治疗主要以手术联合化疗为主,虽然该策略使骨肉瘤患者预后得到改善,但依然大量患者出现复发转移、化疗耐药等问题。因此对致癌基因和致癌信号通路的研究,对骨肉瘤患者的治疗与预后具有重要意义。
近年来,越来越多的研究表明TRIM基因在人类癌症发生与发展中具有重要作用。本研究以TRIM11 为研究基因,观察TRIM11 的表达对骨肉瘤增殖和凋亡的影响。结果显示相对于正常成骨细胞,骨肉瘤细胞TRIM11 基因和蛋白的表达明显上调,且TRIM11 基因与骨肉瘤预后不良呈正相关。通过构建TRIM11-SiRNA 骨肉瘤细胞株Saos-2,观察TRIM11 基因干扰后对骨肉瘤细胞Saos-2 增殖和凋亡的影响,结果发现下调TRIM11 表达可显著抑制骨肉瘤细胞的增殖,促进细胞凋亡,而TRIM11 过表达则起到相反的作用。以上结果说明,TRIM11 可能是骨肉瘤中的癌基因,通过促进细胞增殖和细胞周期发挥作用。研究证明,Cell cycle 和MAPK 信号通路的激活在骨肉瘤的发生发展中具有重要作用[6-7],通过基因富集分析,发现在骨肉瘤中TRIM11 基因表达上调会激活Cell cycle和MAPK 信号通路,而TRIM11 表达下调则相反,这说明了TRIM11 表达上调激活Cell cycle 和MAPK 信号通路可能是骨肉瘤发生发展的潜在机制。
综上所述,TRIM11可以促进骨肉瘤的增殖,延长细胞周期,其机制可能与Cell cycle 和MAPK 信号通路的激活有关,TRIM11有望为骨肉瘤的治疗与预后提供了新的途径。
