一个水稻斑马叶突变体的遗传分析和基因定位
2021-03-25陈海元朱晓妹张所兵张云辉方先文
陈海元 朱晓妹 张所兵 张云辉 方先文


摘要: 通过甲基磺酸乙酯(EMS)诱变,获得了1个可以稳定遗传的水稻斑马叶突变体zebra2-2。与野生型相比,突变体从苗期开始表现出黄绿相间的斑马叶表型,而且不同叶位叶片的表型存在差异,新叶较老叶的表型更加明显。30 ℃条件下可恢复为绿-淡黄相间表型。此外,突变体的抽穗期延迟,株高、穗长、每穗粒数和籽粒大小均显著降低。遗传分析结果表明,突变体的突变表型受1对隐性基因控制。图位克隆结果表明,突变体ZEBRA2基因的第3 342位碱基由G突变为A,使得编码的氨基酸由甘氨酸突变成天冬氨酸,导致突变体呈现斑马叶表型。
关键词: 水稻;斑马叶;遗传分析;基因定位
中图分类号: S511.035.2 文献标识码: A 文章编号: 1000-4440(2021)01-0001-07
Genetic analysis and gene mapping of a zebra leaf mutant in rice
CHEN Hai-yuan, ZHU Xiao-mei, ZHANG Suo-bing, ZHANG Yun-hui, FANG Xian-wen
(Institute of Germplasm Resources and Biotechnology, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract: A zebra leaf mutant zebra2-2 with stable inheritance was identified through ethyl methanesulfonate (EMS) mutagenesis. Compared with the wild type, the mutant displayed yellow and green zebra leaf phenotype since seeding stage, and leaves at different positions showed variable mutant phenotypes, new leaves showed more significant zebra leaf phenotype than the older leaves. Seedlings at 30 ℃ could recover the yellow and green zebra leaf phenotype. In addition, the heading date of mutant was delayed, and the plant height, panicle length, spikelet number per panicle and kernel size were significantly reduced. Genetic analysis demonstrated that the mutant phenotype was controlled by a single recessive nuclear gene. Map-based cloning results revealed that a single base G to A substitution at the 3 342 position from ATG start codon, caused a Gly-to-Asp substitution of ZEBRA2 gene in zebra2-2, which resulting in the zebra leaf phenotype of zebra2-2.
Key words: rice;zebra leaf;genetic analysis;gene mapping
類胡萝卜素在植物中具有多种功能[1]。除了作为光系统中的捕光色素外,类胡萝卜素还能保护光合元件免受活性氧(ROS)的伤害[2-3]。类胡萝卜素还是合成脱落酸(ABA)的前体物质,ABA是植物中一类重要的激素,调节植物种子成熟及萌发和对外界胁迫的响应[4]。因此类胡萝卜素合成的缺陷可能会导致ABA的缺失,引起种子不休眠或者提前发芽的表型[5-7]。类胡萝卜素异构酶(CRTISO)是类胡萝卜素生物合成过程中的关键酶[8-9]。绿色组织中,其活性可被光照(比如光异构化)部分替代[10-11]。拟南芥CRTISO突变体ccr2的光形态建成中,由于前片层体的缺失导致叶绿素积累的延迟[12]。
根据肉眼可见的表型,叶色突变体可被分为淡绿叶(Virescent)、条纹(Stripe)、白化(Albino)、黄叶(Yellow)和斑马叶(Zebra)等类型。其中virescent1- virescent3突变体是温敏型叶色突变体[13-15]。LCM6-LCM8突变体对温度不敏感[16]。斑马叶突变体因叶片上黄绿(或黄白)相间的表型而得名,水稻、玉米和高粱等单子叶植物中已经鉴定出了很多斑马叶突变体[17-20]。斑马叶的表型很大程度上依赖于温度、光照以及发育时期等环境因子[19-20]。水稻、玉米和狼尾草(Pearl millet)中一些斑马叶突变体只在发育的早期出现,随后逐渐消失[19-20]。水稻斑马叶突变体1103s对温度敏感,只有在高温(30 ℃)-低温(20.0~23.1 ℃)-高温(26 ℃或更高)的温度循环诱导下才表现出斑马叶的表型[21]。水稻zebra-necrosis(zn)突变体在光照/黑暗或高温/低温改变条件下,叶片不同部位叶绿体的形成受到不平衡损伤,导致斑马叶表型的出现[22]。目前水稻中鉴定的16个非等位斑马叶突变体中,ZEBRA-NECROSIS (ZN)、β-OsLCY、ZEBRA2和ZL16 4个基因已经被克隆[22-28]。ZN基因编码类囊体绑定蛋白,参与类囊体蛋白复合体的组装,保护正在发育的叶绿体[22]。β-OsLCY基因编码番茄红素β-环化酶,可能通过保护叶绿体免受光氧化损伤维持叶绿体的发育[23-24]。ZEBRA2基因编码类胡萝卜素异构酶,参与水稻的光保护[23,25-27]。ZL16 编码一个羟酰ACP脱水酶,参与脂肪酸的从头合成[28]。
本研究对一个通过甲基磺酸乙酯(EMS)诱变获得的水稻斑马叶突变体,从表型、遗传等方面明确其遗传特性,并对突变基因进行定位、测序与突变位点分析。
1 材料与方法
1.1 试验材料
通过EMS诱变粳稻品种南粳46,获得了1份水稻斑马叶突变体zebra2-2。经过多代自交后,zebra2-2突变体斑马叶的性状稳定遗传。
1.2 叶绿素含量测定
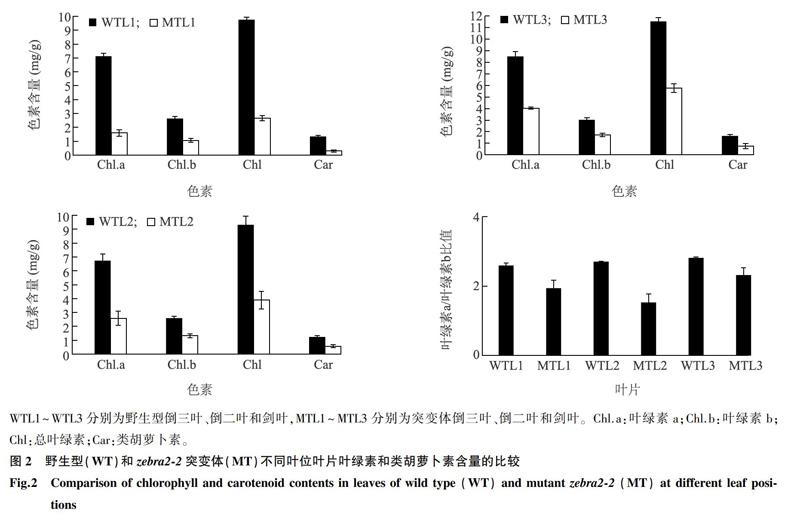
于抽穗期取野生型(WT)和突变体的剑叶、倒二叶和倒三叶叶片各0.2 g,浸于2 ml 80%丙酮中,室温避光浸提24 h,期间多次混匀。浸提液于5 000 r/min离心10 min,用分光光度计分别测定上清液在663 nm、645 nm和470 nm处的吸光值。参照Lichtenthaler[29]的方法, 测定和计算叶片单位质量叶绿素a (Chl.a)、叶绿素b (Chl.b)和类胡萝卜素(Car)的含量。
1.3 温度敏感性试验
野生型和突变体种子于32 ℃ 条件下催芽2 d,将萌发的种子分别播种于22 ℃和30 ℃的光照培养箱中(14 h光照/10 h黑暗),光照度为180 μmol/(m2·s)。每隔1 d观察幼苗叶片表型的变化。
1.4 农艺性状考察
2018年5月中旬,将野生型和zebra2-2播种,1个月后移栽于大田,期间考察苗期性状。正常水肥条件下生长至黄熟期,随机选取野生型和zebra2-2突变体各10株,考察株高、分蘖数、剑叶长宽、一次枝梗数、二次枝梗数、每穗粒数、结实率、粒长、粒宽和粒厚等农艺性状。
1.5 遗传分析与基因定位
2017年在南京试点正季以zebra2-2突变体为母本,分别与野生型、粳稻品种中花11(ZH11)和籼稻品种Dular杂交获得F1代种子。随后在海南试点加代繁殖,获得用于遗传分析和基因定位的F2群体的种子,F2群体于2018年南京正季种植。统计zebra2-2与野生型、ZH11及Dular杂交构建的F2群体斑马叶植株和叶片正常植株的比率,并用卡方测验分析统计结果。在zebra2-2与Dualr杂交构建的F2群体中,筛选隐性极端个体545个,用于连锁分析与基因定位。首先选取10个极端个体,用均匀分布在水稻12条染色体上的zebra2-2和Dular之间多态性好的SSR标记进行连锁分析,对突变基因进行初定位。在初定位区间内,寻找其他有多态的SSR或者InDel标记,分析其他极端个体,完成突变基因的定位。
1.6 突变基因的鉴定与验证
通过水稻基因组注释计划(Rice Genome Annotation Project, https://rapdb.dna.affrc.go.jp)对定位区间内的基因进行预测,发现区间内存在一个已经报道的叶片发育相关基因ZEBRA2。对zebra2-2突变体进行ZEBRA2基因的基因组(包含启动子和基因编码区)测序,与野生型序列比对,并在定位群体中随机挑选10个隐性极端个体对突变位点进行验证。
2 结果与分析
2.1 zebra2-2突变体的表型分析
与野生型相比,zebra2-2突变体叶片从苗期开始就表现出黄绿相间的斑马叶表型,新叶较老叶表型更加明显(图1A)。发育至抽穗期时,突变体的剑叶依然表现出明显的斑马叶表型,而老叶的表型部分恢复,最终呈现出淡黄叶的表型(图1B、图1C)。对抽穗期时不同叶位叶片的叶绿素含量进行测定,发现突变体剑叶、倒二叶和倒三叶的叶绿素a和叶绿素b的含量均比野生型显著降低,而且叶绿素a/叶绿素b的比值也显著下降;突变体剑叶(倒一叶)、倒二叶和倒三叶的叶绿素含量逐渐升高,表明后发育叶片的叶绿素合成逐渐恢复(图2)。
2.2 zebra2-2突变体的低温敏感性
对野生型和突变体进行不同温度处理。zebra2-2突变体在22 ℃条件下生长14 d后,叶片呈现出黄-淡黄相间的表型;而30℃条件下生长14 d后,突变体的叶片呈现出绿-淡黄相间的表型,与野生型的差异已经不明显(图3)。以上结果表明zebra2-2苗期斑马叶表型与生长温度密切相关,对低温更加敏感。
2.3 野生型和zebra2-2突变体农艺性状的比较
突变体的抽穗期比野生型显著延迟,成熟期时突变体的株高较野生型也显著降低(图1B)。为了进一步分析突变体株高降低的原因,我们对野生型和突变体各个节间的长度进行了测量,发现突变体倒1和倒2节间长度比野生型显著降低,倒3和倒4节间没有显著差异,倒5和倒6节间增加(图4)。
此外,我们对野生型和突变体的其他农艺性状进行比较,发现突變体的剑叶长、剑叶宽、每穗粒数、一次枝梗数、二次枝梗数、粒宽较野生型均显著下降,而有效穗数、结实率和粒长没有显著差异(图5)。
2.4 zebra2-2突变体的遗传分析
将zebra2-2分别与野生型、粳稻品种ZH11和籼稻品种Dular杂交,其F1的叶片发育正常。zebra2-2/WT、zebra2-2/ZH11和zebra2-2/Dular的F2群体中,正常植株与斑马叶植株的比例符合3∶1的分离比(表1),表明斑马叶的表型受1对隐性基因控制。
2.5 zebra2-2突变基因连锁分析与基因定位
用zebra2-2和Dular作为DNA模板,用463对SSR引物进行多态性分析,得到155对多态性较好的引物,多态性频率为33.48%。用这些引物对zebra2-2/Dular F2群体中随机挑选的10个与突变体表型相似的极端个体进行连锁分析,发现突变基因与水稻第11染色体长臂上的2个分子标记RM1355和RM27154紧密连锁。根据已经公布的日本晴和9311的DNA序列,在此区间内又开发了3个多态性好的标记RM26938、RM206和RM26998(表2)。利用这些标记对zebra2-2/Dular F2群体中的576个极端个体进行分析,最终将突变基因限定在分子标记RM26938和RM206之间,物理距离约为1 421 kb(图6)。
2.6 zebra2-2突变体的候选基因分析
对定位区间内的基因进行分析,发现ZEBRA2基因的突变表型与zebra2-2相似,因此对zebra2-2突变体中的ZEBRA2基因进行测序。结果显示,突变体中ZEBRA2基因的第3 342位碱基由G突变为A,使得编码的氨基酸由甘氨酸突变成天冬氨酸。从zebra2-2/Dular F2群体中随机挑选的10个极端个体进行混池测序,结果表明10个极端个体的ZEBRA2基因具有与zebra2-2相同的突变位点,表明zebra2-2中突变基因与ZEBRA2是一对等位基因。
3 讨论
有研究者在筛选穗发芽突变体时发现OsCRTISO/ZEBRA2对穗发芽和叶片发育都具有重要作用,ZEBRA2突变体中ABA 含量显著减少,而ROS显著增加,叶片表现出斑马叶的表型[23]。ZEBRA2是催化顺式番茄红素转化为全反式番茄红素的关键酶,主要在光合作用活跃的成熟叶片叶肉细胞中表达,ZEBRA2(z2)突变体在高光照度下表现出更明显的斑马叶表型,表明突变体斑马叶的表型可能与光氧化损伤有关[25]。z2突变体的突变表型在持续光照条件下被完全抑制,光合色素含量和叶绿体的发育都恢复正常,而短日照条件下(10 h 光照/14 h 黑暗)z2突变体的活性氧积累显著增加,持续光照条件下与野生型相当[26]。此外,持续光照和短日照条件下,z2突变体的2种类胡萝卜素Utein 和 Zeaxanthin含量都显著下降,表明这2种类胡萝卜素的缺失与斑马叶表型无关。突变体CRTISO底物Tetra-cis-lycopene及活性氧在短日照条件下积累,是导致突变体斑马叶表型的主要原因[26]。zl2是z2的一个等位突变体,其突变性状比z2更加严重,两个突变体的突变类型相似,都是在外显子和内含子交界处发生单碱基的替换、cDNA的错误剪切[27]。
本研究鉴定的斑马叶突变体zebra2-2是z2和zl2的等位突变体。与zl2突变体相似,zebra2-2从苗期开始出现斑马叶的表型,而z2的斑马叶表型在分蘖早期开始出现。zebra2-2的株高、剑叶长宽、每穗粒数等农艺性状比野生型都显著下降。此外,zebra2-2在低温条件下(22 ℃)的斑马叶表型更加严重,高温可恢复为绿-淡黄相间表型(30 ℃),表明zebra2-2是一个低温敏感突变体。与z2和zl2突变体不同的是,zebra2-2的结实率与野生型没有显著下降。这些表型上的差異,可能是zebra2-2突变体的突变位点不同造成的。突变体中ZEBRA2基因的第3 342位碱基由G突变为A,使得编码的氨基酸由甘氨酸突变成天冬氨酸,表明该位置的氨基酸对于基因的功能具有重要作用。本研究结果对于研究ZEBRA2基因功能及探索水稻叶片发育分子机制具有重要意义。
参考文献:
[1] CUNNINGHAM F X, GANTT E. Genes and enzymes of carotenoid biosynthesis in plants[J]. Annu Rev Plant Physiol Plant Mol Biol, 1998, 49:557-583.
[2] BARTLEY G E, SCOLNIK P A. Plant carotenoids: pigments for photoprotection, visual attraction, and human health[J]. Plant Cell, 1995, 7:1027-1038.
[3] NIYOGI K K. Photoprotection revisited: genetic and molecular approache[J]. Annu Rev Plant Physiol Plant Mol Biol, 1999, 50:333-359.
[4] GIRAUDAT J, PARCY F, BERTAUCHE N, et al. Current advances in abscisic acid action and signalling[J]. Plant Mol Biol, 1994, 26:1557-1577.
[5] FONG F, SMITH J D, KOEHLER D E. Early events in maize seed development: 1-methyl-3- phenyl-5-(3-[trifluoromethyl]phenyl)-4-(1H)-pyridinone induction of vivipary[J]. Plant Physiol, 1983, 73:899-901.
[6] GROOT S, KARSSEN C. Dormancy and germination of abscisic acid-deficient tomato seeds: studies with the sitiens mutant[J]. Plant Physiol, 1992, 99:952-958.
[7] LEON-KLOOSTERZIEL K M, GIL M A, RUIJS G J, et al. Isolation and characterization of abscisic acid-deficient Arabidopsis mutants at two new loci[J]. Plant J, 1996, 10:655-661.
[8] BREITENBACH J, VIOQUE A, SANDMANN G. Gene sll0033 from Synechocystis 6803 encodes a carotene isomerase involved in the biosynthesis of all-E lycopene[J]. Z Naturforsch, 2001, 56:915-917.
[9] MASAMOTO K, WADA H, KANEKO T, et al. Identification of a gene required for cis-to-trans carotene isomerization in carotenogenesis of the cyanobacterium Synechocystis sp. PCC 6803[J]. Plant Cell Physiol, 2001, 42:1398-1402.
[10]ISAACSON T, RONEN G, ZAMIR D, et al. Cloning of tangerine from tomato reveals a carotenoid isomerase essential for the production of beta- -carotene and xanthophylls in plants[J]. Plant Cell, 2002, 14:333-342.
[11]PARK H, KREUNEN S S, CUTTRISS A J, et al. Identification of the carotenoid isomerase provides insight into carotenoid biosynthesis, prolamellar body formation, and photomorphogenesis[J]. Plant Cell, 2002, 14:321-332.
[12]MASAMOTO K, HISATOMI S, SAKURAI I, et al. Requirement of carotene isomerization for the assembly of photosystem II in Synechocystis sp[J]. Plant Cell Physiol, 2004, 45:1325-1329.
[13]IBA K, TAKAMIYA K I, TOH Y, et al. Formation of functionally active chloroplasts is determined at a limited stage of leaf development in virescent mutants of rice[J]. Dev Genet, 1991, 12:342-348.
[14]KUSUMI K, MIZUTANI A, NISHIMURA M, et al. A virescent gene V1 determines the expression timing of plastid genes for transcription/translation apparatus during early leaf development in rice[J]. Plant J, 1997, 12: 1241-1250.
[15]SUGIMOTO H, KUSUMI K, TOZAWA Y, et al. The virescent-2 mutation inhibits translation of plastid transcripts for the plastid genetic system at an early stage of chloroplast differentiation[J]. Plant Cell Physiol, 2004, 45: 985-996.
[16]WU D, SHU Q, XIA Y, et al. Analysis of variation in thermo-sensitive genic male sterile leaf color mutant lines induced from Indica rice (Oryza sativa L.) by 60Co irradiation[J]. Acta Agron Sin, 1999, 25: 64-69.
[17]WERNER B K, BURTON G W. Dominant zebra mutant in pearl millet[J]. J Hered, 1991, 82: 68-69.
[18]OKI S, GU X, KOFOID K D, et al. A light-intensity sensitive chlorophyll mutant in sorghum[J]. Hereditas, 1997, 126:239-245.
[19]KUSUMI K, KOMORI H, SATOH H, et al. Characterization of a zebra mutant of rice with increased susceptibility to light stress[J]. Plant Cell Physiol, 2000, 41:158-64.
[20]HE R, DING Y, YU J, et al. The changes of chlorophyll content and several enzyme activities in zebra-leaf rice[J]. J Wuhan Univ, 2000, 46: 761-765.
[21]何瑞鋒,丁 毅,余金洪,等. 水稻“斑马叶”叶绿素含量及几种酶活性的变化[J].武汉大学学报,2000,46(6):761-765.
[22]LI J, PANDEYA D, NATH K, et al. ZEBRA-NECROSIS, a thylakoid-bound protein, is critical for the photoprotection of developing chloroplasts during early leaf development[J]. Plant J, 2010, 62: 713-725.
[23]FANG J, CHAI C L, QIAN Q, et al. Mutations of genes in synthesis of the carotenoid precursors of ABA lead to pre-harvest sprouting and photo-oxidation in rice[J]. The Plant Journal, 2008, 54:177-189.
[24]李燕群,钟 萍,高志艳,等. 水稻斑马叶突变体 zebra524 的表型鉴定及候选基因分析[J].中国农业科学,2014,47(15):2907-2915.
[25]CHAI C L, FANG J, LIU Y, et al. ZEBRA2, encoding a carotenoid isomerase, is involved in photoprotection in rice[J]. Plant Mol Biol, 2011, 75:211-221.
[26]HAN S H, SAKURABA Y, KOH H J, et al. Leaf variegation in the rice ZEBRA2 mutant is caused by photoperiodic accumulation of tetra-cis-lycopene and singlet oxygen[J]. Mol Cells, 2012, 33:87-97,
[27]刘 胜,魏祥进,邵高能,等.一个水稻“斑马叶”叶色突变体基因 zebra leaf 2(zl2)的图位克隆[J]. 中国水稻科学,2013,27(3):231-239.
[28]LIU Z W, WANG Z Y, GU H, et al. Identification and phenotypic characterization of ZEBRA LEAF16 encoding a β-hydroxyacyl-ACP dehydratase in rice[J]. Front Plant Sci, 2018, 9: 782.
[29]LICHTENTHALER H K. Chlorophylls and carotenoids: Pigments of photosynthetic biomenbranes[J]. Meth Enzymol, 1987, 148:350-382.
(責任编辑:张震林)
收稿日期:2020-04-09
基金项目:江苏省自然科学基金项目(BK20180309)
作者简介:陈海元(1988-),男,江苏徐州人,博士,助理研究员,主要从事水稻基因功能解析及分子设计育种研究。(Tel)025-84390321;(E-mail)15150530179@163.com
通讯作者:方先文,(E-mail)2431240491@qq.com
