白花蛇舌草多糖对肾癌荷瘤小鼠肿瘤生长及免疫调节作用的影响
2021-03-25张林超
张林超
(河南省中医院泌尿外科,河南 郑州 450002)
白花蛇舌草Hedyotis diffusaWilld 属茜草科耳草属植物,别名尖刀草、白花十字草、二叶葎等,始载于《广西中药志》,具有利尿除湿、消痛散结及清热解毒之功效。现代药学研究[1]发现,白花蛇舌草具有抗肿瘤、抗氧化、抗病毒、抗感染及免疫调节等作用,其活性成分包括黄酮类、蒽醌类、挥发油类、烷烃类、甾体类、萜类及多糖类。白花蛇舌草多糖为白花蛇舌草的活性成分之一,具有抗肿瘤、免疫调节及抗氧化等多种生物活性[2]。白花蛇舌草多糖对肝癌、宫颈癌、非小细胞肺癌及胃癌等的增殖均有抑制作用,对肾癌的研究报道较少[3-5]。同时,鉴于白花蛇舌草多糖具有较好的增强免疫能力[6],而肾癌又被公认为免疫原性肿瘤,对免疫治疗较敏感[7]。因此,本研究通过皮下接种Renca 细胞建立肾癌荷瘤小鼠模型,主要探讨白花蛇舌草多糖对肾癌荷瘤小鼠肿瘤生长及免疫调节作用的影响,为其进一步的临床应用奠定基础。
1 材料
1.1 动物与细胞株 昆明种小鼠,雄性,SPF 级,体质量(20±2) g,购于斯贝福实验动物公司,动物生产许可证号SCXK (京) 2016-0002。小鼠肾癌Renca 细胞,购于中科院上海细胞库。
1.2 药物与试剂 白花蛇舌草多糖(纯度>80%),批号20180216,西安天瑞生物技术有限公司;黄芪多糖(纯度>85%),批号20181125,陕西昂盛生物科技有限公司;RPMI1640 培养液及胎牛血清,美国Hyclone 公司;刀豆蛋白A (ConA) 及噻唑蓝(MTT) 检测试剂盒,美国Sigma 公司;CD4、CD8 抗体,上海瑞齐生物技术有限公司;干扰素-γ (IFN-γ) 和白细胞介素-2 (IL-2) 酶联免疫吸附法(ELISA) 检测试剂盒,上海迪奥生物技术公司。
1.3 仪器 MCO-20AIC 型CO2培养箱,日本三洋公司;Fh1004N 电子天平,上海民桥精密仪器公司;TDZ6B-WS离心机,上海卢湘仪器公司;RT-6000 酶标仪,深圳雷杜生物科学公司;FV1000 显微镜,日本Olympus 公司;Facscalibur 流式细胞仪,美国BD 公司。
2 方法
2.1 肾癌荷瘤小鼠模型建立 小鼠肾癌Renca 细胞用RPMI1640 (10%胎牛血清+100 U/mL 青霉素+100 U/mL 链霉素) 培养液,于5% CO2、37 ℃条件下在恒温培养箱中培养。待细胞生长至对数生长期时,收获细胞,加适量磷酸盐缓冲液(PBS) 调整细胞浓度为1×107/mL。于小鼠右后肢外侧皮下处接种250 μL,每日观察小鼠肿瘤生长情况,7 d 后注射处见约5 mm 的肿瘤结节视为肾癌荷瘤小鼠模型建立成功。
2.2 分组及给药 将荷瘤小鼠随机分为荷瘤模型组、黄芪多糖组及白花蛇舌草多糖高、低剂量组,每组12 只;另随机选取未造模小鼠12 只作为正常组。正常组及荷瘤模型组小鼠灌胃等体积的蒸馏水,黄芪多糖组及白花蛇舌草多糖高、低剂量组分别灌胃100 mg/kg 黄芪多糖和200、100 mg/kg白花蛇舌草多糖,1 次/d,持续给药14 d。
2.3 瘤质量、抑瘤率及免疫器官指数测定 末次给药结束后24 h,颈椎脱臼法处死小鼠,剥离瘤体后,分别称瘤质量及体质量,经75%乙醇消毒后,取免疫器官(脾脏及胸腺),称重。抑瘤率=[(荷瘤模型组平均瘤质量-药物处理组平均瘤质量)/荷瘤模型组平均瘤质量]×100%,免疫器官指数=免疫器官(脾脏或胸腺) 质量/体质量。
2.4 淋巴细胞转化及CTL 杀伤活性测定 将无菌分离的小鼠脾脏置于200 目尼龙网上,轻轻碾压挤碎,制备单个脾细胞悬液,加入Tris-NH4Cl 溶液(0.01%) 使红细胞溶解,PBS 漂洗后,调整细胞浓度为5×106/mL。取100 μL脾细胞悬液置于96 孔细胞培养板中,加入终浓度5 μg/mL的ConA,常规条件培养72 h 后,采用MTT 法测570 nm 处光密度(OD)。小鼠脾细胞悬液(5×106/mL) 为效应细胞,取对数生长期小鼠肾癌Renca 细胞(1×105/mL) 为靶细胞,等比例混合后常规条件培养24 h,采用MTT 法测490 nm 处OD,计算CTL 杀伤活性。CTL 杀伤活性=[1-(OD实验孔-OD效应细胞对照孔)/OD靶细胞对照孔] ×100%
2.5 外周血T 淋巴CD4+和CD8+细胞亚群测定 小鼠在处死前摘眼球取血,取100 μL 放于EP 管中,分别加入抗CD4+及CD48+抗体各10 μL,冰水浴上避光放置30 min。加入100 μL 红细胞裂解液,完全混匀,继续避光放置10 min裂解红细胞,离心(1 000 r/min) 5 min,弃掉上清液,沉淀用500 μL PBS 溶液重悬后,于流式细胞仪中检测。
2.6 血清IFN-γ 和IL-2 水平测定 剩余小鼠眼球血加肝素钠抗凝后,离心(3 000 r/min) 5 min,分装上层血清于-20 ℃冰箱中备用。采用ELISA 法,按照对应试剂盒说明书中的操作步骤测定血清IFN-γ 和IL-2 水平。
2.7 数据处理 采用SPSS18.0 软件进行处理,符合正态分布的计量资料以() 表示,各组小鼠体质量、瘤质量、免疫器官指数、淋巴细胞转化及CTL 杀伤活性、CD4+和CD8+细胞亚群比例,血清IFN-γ 和IL-2 水平对比采用独立样本t检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 白花蛇舌草多糖对肾癌荷瘤小鼠体质量及肿瘤生长的影响 与正常组比较,荷瘤模型组小鼠体质量下降(P<0.05);与荷瘤模型组比较,黄芪多糖及白花蛇舌草多糖高、低剂量组小鼠体质量均有不同程度的增加,其中黄芪多糖及白花蛇舌草多糖高剂量组体质量增加(P<0.05)。此外,与荷瘤模型组比较,黄芪多糖及白花蛇舌草多糖高、低剂量组小鼠瘤质量均下降(P<0.05),各组的抑瘤率分别为35.61%、31.81%、21.97%。以上结果提示,白花蛇舌草多糖对肾癌荷瘤小鼠的肿瘤生长具有抑制作用。见表1。
表1 白花蛇舌草多糖对肾癌荷瘤小鼠体质量及肿瘤生长的影响(, n=12)
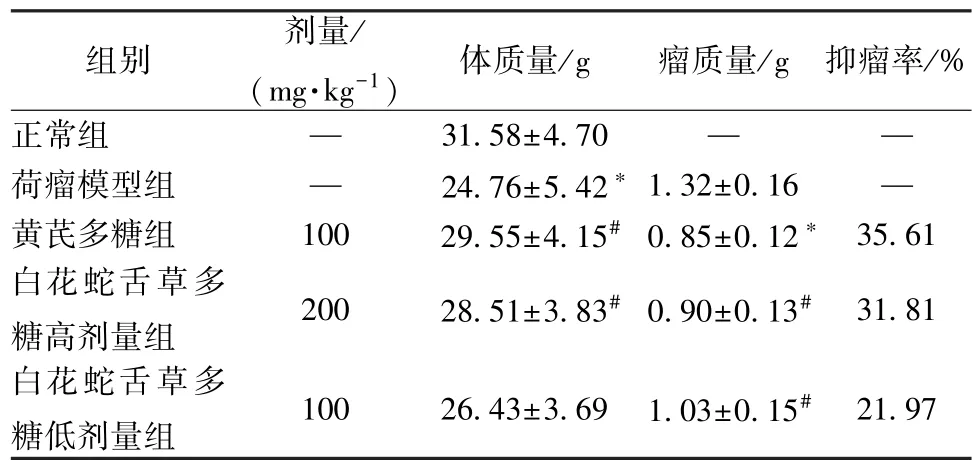
表1 白花蛇舌草多糖对肾癌荷瘤小鼠体质量及肿瘤生长的影响(, n=12)
注:与正常组比较,*P<0.05;与荷瘤模型组比较,#P<0.05。
3.2 白花蛇舌草多糖对肾癌荷瘤小鼠免疫器官指数的影响 与正常组比较,荷瘤模型组小鼠脾脏指数及胸腺指数均降低(P<0.05);与荷瘤模型组比较,黄芪多糖及白花蛇舌草多糖高、低剂量组小鼠脾脏指数及胸腺指数均增加(P<0.05)。以上结果提示,白花蛇舌草多糖可以改善荷瘤小鼠免疫能力。见表2。
表2 白花蛇舌草多糖对肾癌荷瘤小鼠免疫器官指数的影响(, n=12)
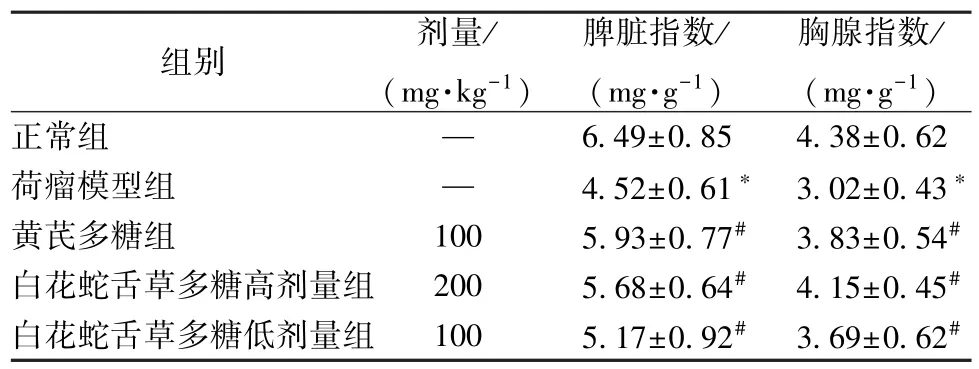
表2 白花蛇舌草多糖对肾癌荷瘤小鼠免疫器官指数的影响(, n=12)
注:与正常组比较,*P<0.05;与荷瘤模型组比较,#P<0.05。
3.3 白花蛇舌草多糖对肾癌荷瘤小鼠淋巴细胞转化及CTL杀伤活性的影响 与正常组比较,荷瘤模型组小鼠淋巴细胞转化程度及CTL 杀伤活性均降低(P<0.05);与荷瘤模型组比较,黄芪多糖及白花蛇舌草多糖高、低剂量组小鼠淋巴细胞转化程度及CTL 杀伤活性均升高(P<0.05)。以上结果提示,白花蛇舌草多糖可以通过提高小鼠淋巴细胞转化程度及增强小鼠CTL 杀伤活性来促进荷瘤小鼠免疫功能的提高。见表3。
表3 白花蛇舌草多糖对肾癌荷瘤小鼠淋巴细胞转化及CTL 杀伤活性的影响(, n=12)
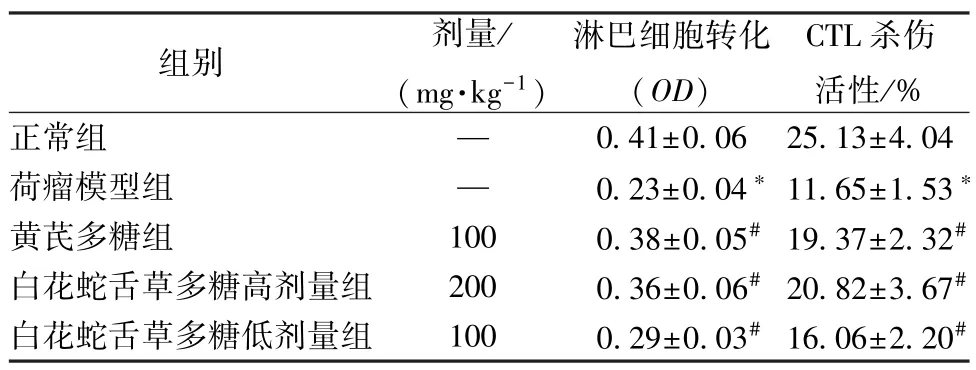
表3 白花蛇舌草多糖对肾癌荷瘤小鼠淋巴细胞转化及CTL 杀伤活性的影响(, n=12)
注:与正常组比较,*P<0.05;与荷瘤模型组比较,#P<0.05。
3.4 白花蛇舌草多糖对肾癌荷瘤小鼠外周血T 淋巴CD4+和CD8+细胞亚群的影响 与正常组比较,荷瘤模型组小鼠外周血T 淋巴CD4+细胞百分比及CD4+/CD8+比值降低,而CD8+细胞百分比增加(P<0.05);与荷瘤模型组比较,黄芪多糖及白花蛇舌草多糖高、低剂量组小鼠外周血T 淋巴CD4+细胞百分比及CD4+/CD8+比值增加,而CD8+细胞百分比降低(P<0.05)。见表4、图1。
表4 白花蛇舌草多糖对肾癌荷瘤小鼠外周血T 淋巴CD4+和CD8+细胞亚群的影响(, n=12)
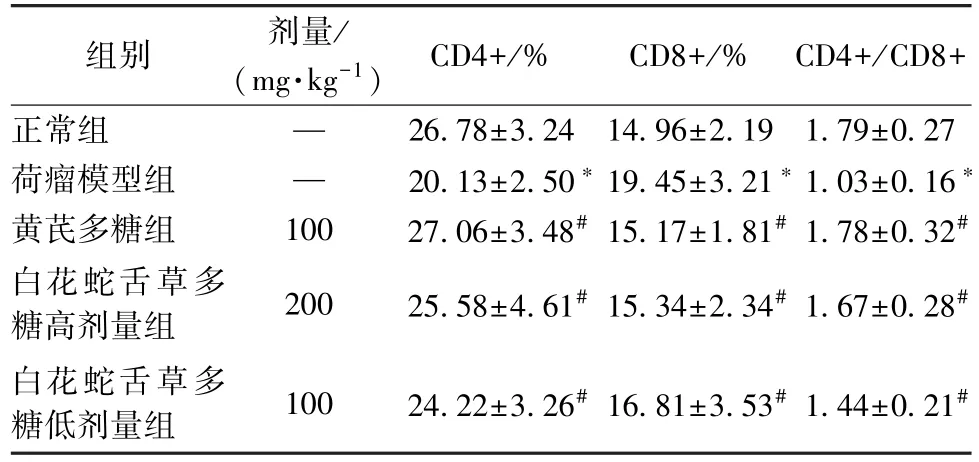
表4 白花蛇舌草多糖对肾癌荷瘤小鼠外周血T 淋巴CD4+和CD8+细胞亚群的影响(, n=12)
注:与正常组比较,*P<0.05;与荷瘤模型组比较,#P<0.05。

图1 白花蛇舌草多糖对肾癌荷瘤小鼠外周血T 淋巴CD4+和CD8+细胞亚群的影响
3.5 白花蛇舌草多糖对肾癌荷瘤小鼠血清IFN-γ 和IL-2 水平的影响 与正常组比较,荷瘤模型组小鼠血清IFN-γ 和IL-2 水平均降低(P<0.05);与荷瘤模型组比较,黄芪多糖及白花蛇舌草多糖高、低剂量组小鼠血清IFN-γ 和IL-2水平均增加(P<0.05)。以上结果提示,提高荷瘤小鼠血清IFN-γ 和IL-2 水平可能是白花蛇舌草多糖抑制肿瘤生长的潜在机制。见表5。
4 讨论
白花舌草多糖对多种肿瘤均有抑制作用。研究发现,其可以抑制人肺腺癌A549 细胞的转移[8],该作用与下调组织金属蛋白酶表达及阻断EGFR/Akt/ERK 信号通路有关。Wu 等[9]证实,白花舌草多糖对人喉鳞癌Hep2 细胞的增殖具有时间和剂量依赖性的抑制作用。体内抑瘤实验也发现,白花蛇舌草多糖对肝癌H22 和骨肉瘤S180 荷瘤小鼠的肿瘤生长均有抑制作用[10]。本研究通过皮下接种Renca细胞建立肾癌荷瘤小鼠模型,给予模型小鼠高、低剂量的白花蛇舌草多糖14 d 后,发现不同剂量的白花蛇舌草多糖均可以降低模型小鼠的瘤质量,抑瘤率分别为31.81% 和21.97%,表明HDP 对肾癌荷瘤小鼠的肿瘤生长同样具有抑制作用。
表5 白花蛇舌草多糖对肾癌荷瘤小鼠血清IFN-γ 和IL-2水平的影响(, n=12)

表5 白花蛇舌草多糖对肾癌荷瘤小鼠血清IFN-γ 和IL-2水平的影响(, n=12)
注:与正常组比较,*P<0.05;与荷瘤模型组比较,#P<0.05。
免疫器官是机体内发生免疫应答的重要场所,免疫器官指数可以客观的反映免疫器官的免疫水平和发育功能[11]。本研究结果发现,与荷瘤模型组比较,白花蛇舌草多糖高、低剂量组小鼠脾脏指数及胸腺指数均明显增加。淋巴细胞体外转化是评价淋巴细胞功能强弱的重要指标,检测小鼠淋巴细胞体外转化可以有效反映小鼠细胞免疫能力的高低[12]。细胞介导免疫反应的主要效应细胞为CTL 细胞,测定CTL 杀伤活性是评价机体细胞免疫功能的重要手段,同时也是评价药物对免疫系统影响的重要方法[13]。瞿俊勇等人研究发现[14],白花蛇舌草多糖可以调节免疫抑制小鼠的免疫功能。本研究结果同样发现,与荷瘤模型组比较,白花蛇舌草多糖高、低剂量组小鼠淋巴细胞转化程度及CTL 杀伤活性均显著升高。以上结果表明,白花蛇舌草多糖可以通过增加免疫器官重量、提高小鼠淋巴细胞转化程度及增强小鼠CTL 杀伤活性来促进荷瘤小鼠免疫功能的提高。
在机体抗肿瘤免疫反应过程中,T 细胞亚群发挥重要调节作用[15]。在生理条件下,机体内各T 淋巴细胞亚群之间相互作用,保持动态的平衡以维持机体正常免疫功能;当动态平衡被打破,不同淋巴细胞亚群功能和数量发生异常时,可引起免疫功能下降并导致病理性改变[16]。在成熟T 淋巴细胞表面,CD4、CD8 不能同时表达,因而成熟的T淋巴细胞分为CD4+T 淋巴细胞亚群和CD8+T 淋巴细胞亚群。T 淋巴细胞亚群的检测对恶性肿瘤的诊断、治疗及预后均有重要意义,其中CD4+T 淋巴细胞数目增加会提升免疫能力,CD8+T 淋巴细胞数目减少会抑制肿瘤生长,CD4+/CD8+比值降低被公认为是肿瘤细胞免疫功能处于抑制状态的表现[17]。本研究结果发现,与荷瘤模型组比较,HDP 高、低剂量组小鼠外周血T 淋巴CD4+细胞百分比及CD4+/CD8+比值增加,而CD8+细胞百分比降低,表明白花蛇舌草多糖可以通过调节T 细胞亚群比例发挥抑制肾癌荷瘤小鼠肿瘤生长的作用。
IFN-γ 和IL-2 等细胞因子与肿瘤的发生、发展、转移及预后存在着紧密联系,在肿瘤免疫治疗中发挥重要作用[18]。IFN-γ 也称调节免疫型干扰素,可通过免疫调节作用、抑制肿瘤细胞增殖、影响肿瘤细胞周期、抗血管生成等发挥抗肿瘤作用[19]。研究发现,在恶性肿瘤患者体内IL-2 表达明显降低,其含量高低与肿瘤的发生及进展密切相关;IL-2 含量的提高,可以促进T 细胞对肿瘤抗原的敏感性,增强机体抗肿瘤免疫作用[20]。陈培丰等[21]发现,龙葵提取物可以抑制Lewis 肺癌移植瘤的生长,该作用与升高荷瘤小鼠血清IFN-γ、IL-2 水平有关。本研究同样发现,与荷瘤模型组比较,白花蛇舌草多糖高、低剂量组小鼠血清IFN-γ 和IL-2 水平均显著增加,表明提高荷瘤小鼠血清细胞因子水平可能是白花蛇舌草多糖抑制肾癌荷瘤小鼠肿瘤生长的潜在机制。
综上所述,白花蛇舌草多糖对肾癌荷瘤小鼠肿瘤生长具有抑制作用,该作用与免疫调节作用有关。