川乌药理作用、毒性、质量控制方法研究进展
2021-03-25陈良妮程雪梅王长虹
陈良妮,程雪梅,陈 勇,王长虹*
(1.广西中医药大学药学院,广西 南宁 530000;2.上海中医药大学中药研究所,中药标准化教育部重点实验室,上海市复方中药重点实验室,上海中药标准化研究中心,上海 201203)
川乌是毛茛科植物乌头Aconitum carmichaeliiDebx.的干燥母根,分布于四川、陕西、云南、湖北、湖南、河南等地,以四川江油产者最优[1],其性热,味苦、辛,略有麻舌感,主归心、肝、肾、脾经,具有祛风除湿,温经止痛的功效,常用于治疗风寒湿痹、关节疼痛、寒疝作痛等[2]。现代药理研究表明,该药材具有抗炎、镇痛、抗肿瘤、保护心血管等作用,但同时也有着心脏毒性、神经毒性、肝毒性等。其化学成分主要为二萜生物碱类、季铵盐类、阿朴啡类、吡咯类等生物碱,以及黄酮、皂苷、神经酰胺、多糖等非生物碱[3],其中二萜生物碱是主要药效物质基础,既是主要有效成分,也是毒性物质,而吡咯类、季铵盐类、阿朴啡类等非二萜类生物碱及其他非生物碱成分在强心、抗炎方面具有较强的生理活性[3]。
为达到减毒存效的目的,川乌使用前一般需加工炮制,使其中毒性最大的双酯型生物碱乌头碱、新乌头碱、次乌头碱等热水解C8位的乙酰基生成毒性较弱的单酯型生物碱,如苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱等,或进一步热水解C14位的benzoyl 而生成几乎无毒性的醇胺型生物碱乌头原碱、新乌头原碱、次乌头原碱等[4]。据报道,小鼠静脉注射乌头碱、新乌头碱、次乌头碱后,LD50分别为0.12、0.10、0.47 mg/kg,给予苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱后分别为23、21、23 mg/kg,给予乌头原碱后为120 mg/kg[5]。2015 版《中国药典》 收录了18 副含制川乌的内服制剂,在有给药剂量的12 副中,其剂量范围为0.019~1.99 g;文献[6] 报道,成人(60 kg) 口服制川乌提取物后,出现心率减慢的日用限量为1 619.55 mg,可见该药材临床治疗窗范围较窄,易产生严重不良反应,甚至中毒死亡。本文对川乌药理、毒性、质量控制方法的文献进行综述,以期为该药材深入研究提供参考。
1 药理作用
川乌主要生物活性为抗炎、镇痛,临床主要用于治疗风寒湿痹、关节疼痛等,相关研究集中在乌头碱、新乌头碱、次乌头碱、苯甲酰乌头原碱、乌头原碱等成分,2015年版《中国药典》 收录了32 副含川乌或制川乌的复方制剂(包含内服和外用),其中29 副用于治疗风湿疼痛。另外,该成分还具有保护心血管、抗肿瘤等药理作用。
1.1 抗炎 川乌作为临床常用抗风湿药,用于治疗膝关节骨性关节炎等疾病,主要通过抗炎来发挥作用。有学者用0.44 g/kg 剂量川乌总碱在致炎前48、24、1 h 处理大鼠,发现该成分可明显减少角叉菜引起的炎症渗出物中PGE 水平,并且对组胺、五羟色胺引起的足肿胀和毛细血管通透性增强,二甲苯致耳水肿、巴豆油致气囊肿渗出,以及可逆性被动Arthus 反应、佐剂关节炎等类风湿关节炎也有明显抑制作用[7],其机制可能与参与类风湿关节炎的信号转导过程有关,苯甲酰乌头原碱可抑制患者血清TNF-α、IL-1β 分泌,降低VEGF 水平,上调滑膜Nrf2、HO-1、NQO1表达[8]。Hikino 等[9]给模型小鼠脑室内注射40、80 ng新乌头碱,发现该成分对角叉菜胶引起的足肿胀,醋酸、琼脂促使的血管通透性均产生剂量依赖性抗炎作用,并通过吗啡、新乌头碱对角叉菜胶所致足肿胀大鼠进行治疗,证明其抗炎机制涉及中枢神经系统。
近年来,从分子水平研究川乌抗炎机制取得了一定进展。有学者以川乌中乌头碱、次乌头碱、新乌头碱为代表建立蛋白互作网络,发现该药材通过影响前列腺素代谢过程中趋化因子介导的白细胞趋化来发挥抗炎作用[10]。Yu等[11]在IL-1β (10 ng/mL) 刺激人滑膜SW982 细胞前,分别用0、5、10 μmol/L 苯甲酰乌头原碱孵育SW982 细胞,发现IL-6、IL-8 mRNA 和蛋白表达被5、10 μmol/L 苯甲酰乌头原碱抑制,丝裂原活化蛋白激酶的活化和Akt 的磷酸化明显下降,κB 抑制剂(I-κB) -α 的降解和p65 蛋白的磷酸化和核转位也被抑制,表明苯甲酰乌头原碱通过丝裂原活化蛋白激酶、AKT 和核因子-κB (NF-κB) 途径来发挥抗炎作用,并且在实验前采用MTT 法检测该成分对SW982 细胞的潜在细胞毒性,发现其浓度达到50 μmol/L 时也无毒性。
1.2 镇痛 川乌对慢性炎症性疼痛、神经病理性疼痛、急性疼痛、癌症疼痛有良好的抑制作用,而且不易耐受。Wang 等[12]给雄性ICR 小鼠灌胃制川乌水煎液 (0.34、0.68、1.35 g/kg),每天1 次,连续7 d,发现可呈剂量依赖性地减弱慢性炎症疼痛,并且无耐受性,其机制可能是增加脊髓内强啡肽释放,激活κ-阿片受体,抑制瞬时感受器电位香草酸受体1TRPV1 离子通道。Li 等[13]分别给大鼠鞘内注射乌头碱(1、3、10、30、100 ng)、苯甲酰乌头原碱(0.3、1、3、10 μg)、乌头原碱(100、300 μg),发现乌头碱、苯甲酰乌头原碱可显著减轻脊髓神经结扎所致神经病变的机械性痛觉过敏和热痛觉过敏,但乌头原碱无此作用,其机制可能是刺激脊髓小胶质细胞强啡肽A 表达。王华灵等[14]用乌头碱注射液治疗168 例中晚期癌性疼痛患者,发现总有效率为79.76% (134/168),而且对消化系统癌痛效果最优。孙虎等[15]给小鼠耳外涂抹22.50、18.75、15.00 mg/kg 的乌头碱药液,每天1 次,连续3 d,再腹腔注射0.2 mL 冰醋酸,发现小鼠潜伏期延长,扭体次数减少,其镇痛作用呈剂量依赖性增加,并且当剂量达到18.75 mg/kg 时出现“平台期”。
1.3 保护心血管 川乌可通过抑制血管内皮细胞凋亡和心肌肥大因子来保护心血管。Bai 等[16]评估了乌头碱、新乌头碱、次乌头碱、苯甲酰乌头原碱对氧化型低密度脂蛋白oxLDL 诱导的内皮细胞损伤的影响,发现只有次乌头碱能抑制oxLDL 诱导内的皮细胞凋亡,其机制可能是在剂量24~90 μmol/L 下可促进HDAC3 表达,减少HMGB1 胞质迁移和胞外释放。Wang 等[17]采用Western blot 法、实时荧光定量PCR 技术(qRT-PCR)、荧光标记,发现乌头碱能通过抑制血管紧张素Ⅱ(AngⅡ) 所引起的心肌肥大因子ANP、BNP、β-MHC 和F-actin 上调来缓解心肌肥大和保护心血管,并且在实验前通过MTT 法发现其浓度在5~20 nmol/L时无明显细胞死亡毒性。
1.4 抗肿瘤 川乌可从抑制肿瘤细胞的增殖、侵袭及转移、诱导肿瘤细胞凋亡等多个方面发挥抗肿瘤作用,具体见表1。

表1 川乌及其主要化学成分的抗肿瘤作用
1.5 其他 乌头碱可通过降低原先升高的白细胞数、血清抗双链DNA 抗体水平和PGE2、IL-17a、IL-6 水平,以及减少IgG 在肾小球组织中的沉积,从而改善肾组织病理损害,最终达到缓解系统性红斑狼疮的病理损害的作用[22],并能通过激活P-gp 在LS174T、Caco-2 细胞中的转运活性来降低化疗药物对细胞的毒性[23]。次乌头碱可能通过影响大鼠纤溶系统以及VCAM-1、ICAM-1 表达,改善脑梗死的神经功能缺损状态[24]。苯甲酰乌头原碱可增加心肌、肝脏、肌肉中线粒体DNA 拷贝数和OXPHOS 相关蛋白表达,激活AMPK 信号转导通路,可能对某些与线粒体功能障碍相关的疾病有治疗作用[25]。
2 毒性
双酯型二萜生物碱是川乌主要毒性成分,而单酯型二萜生物碱毒性相对较小(为乌头碱的1/500~1/50),并具有较好的活性,醇胺型二萜生物碱毒性最低(为乌头碱的1/4 000~1/2 000),但活性也相对较弱[4]。该类成分毒性作用有心脏毒性、神经毒性、肝毒性、生殖毒性等,其中心脏毒性为研究热点。
2.1 心脏毒性 心脏毒性是川乌最主要的毒性,可导致严重的心功能紊乱,部分学者认为引起离子通道紊乱是其重要机制之一,并利用人心肌细胞、斑马鱼、犬等模型对其进行研究。Wu 等[26]报道,0.3~3.0 μmol/L 乌头碱可呈浓度依赖性地缩短人诱导多能干细胞来源的心肌细胞的[Ca2+]i瞬变时间和幅度,使搏动频率增加60%以上,并能显著降低L 型钙通道电流(Ica,L),并伴随激活的正移和失活的负移,表明L 型钙通道抑制是乌头碱致人心肌细胞心律失常的机制。Li 等[27]通过研究斑马鱼胚胎和H9c2 细胞发现,乌头碱参与钙信号通路的调节,1.5~4.5 μmol/L剂量下能引起细胞内钙离子振荡,增加细胞凋亡率,抑制TNT、Bcl-2 蛋白表达,促进caspase3、Bax 蛋白表达。Xie等[28]给清醒Beagle 犬口服50、150、450 μg/kg 乌头碱,发现QTcV 延长23%以上,2 h 后出现最大值,并与次乌头碱血药浓度呈正相关,同时进行HEK293 细胞实验,发现该成分可呈浓度依赖性地抑制KCNH2 电流,IC50为8.1 nmol/L,可能是通过抑制KCNH2 (HERG) 钾通道来介导清醒犬的QT 延长[29]。另外,对心脏毒性机制的研究除了离子通道外,在细胞酶学、离子信号变化、DNA 损伤等方面也取得了一定的进展,具体见表2。

表2 川乌及其主要化学成分的心脏毒性机制
2.2 神经毒性 乌头碱、苯甲酰乌头原碱、乌头原碱均有神经毒性,能引起运动阻滞相关的弛缓性麻痹和死亡,其中乌头碱TD50、LD50分别为0.3、0.4 μg,苯甲酰乌头原碱分别为117、142 μg,乌头原碱分别为757、862 μg[13]。有学者采用hCMEC/D3 细胞、小鼠脑灌注模型研究影响川乌生物碱血脑屏障转运的机制,发现乌头碱、新乌头碱、次乌头碱的摄取是由质膜上表达的一种质子偶联逆向转运蛋白转运的,并呈温度、时间、浓度依赖性,同时通过RNA干扰分析实验证明,该逆向转运蛋白不是OCTN1,OCTN2、PMAT 这些已知的有机阳离子转运载体,还需进一步对该逆向转运蛋白进行探究[33]。
2.3 其他
2.3.1 遗传毒性 饶朝龙等[34]发现,乌头碱促进bcl-2 基因的表达是其损伤细胞DNA 的重要因素。
2.3.2 肝毒性 Yang 等[35]发现,乌头碱可抑制p-PI3K、p-Akt、p-mTOR 的磷酸化,mTOR 下游的 p-p70S6K、p-4EBP1同时降低,最终诱导小鼠肝脏自噬。
2.3.3 生殖毒性 乌头碱可通过下调SCA1、Hsd3b1、CYP17a1、Hsd17b3 的表达来阻断雄激素的合成,其浓度在50 μmol/L 时还能诱导间质细胞产生ROS,增加细胞凋亡率[36]。
3 质量控制方法
3.1 川乌 2015 年版《中国药典》 采用HPLC 法,以乌头碱、新乌头碱和、次乌头碱3 种双酯型二萜生物碱的总含量作为指标用于川乌质量控制[2]。根据现有文献报道,用于川乌药材饮片质量控制的方法可分为色谱技术、光谱技术、数据分析技术、其他技术,具体如下。
3.1.1 色谱技术 色谱技术在中医药研究中的应用十分广泛,兼备分离和定量的双重功能,是中药质量控制的有效手段。目前,已有文献报道用于川乌质量控制的色谱技术有毛细管电泳(CE)、高效液相色谱(HPLC)、薄层扫描(TLCS)、液相-质谱联用(LC-MS)、实时直接分析质谱(DART-MS)、UHPLC-MS/MS 等,其中HPLC、HPLC-MS较常用,前者可用于常量双酯型和单酯型二萜生物碱测定,而后者可用于微量成分、体内成分及无紫外吸收的醇氨型二萜生物碱的测定。
CE 兼具电泳和色谱技术的双重优点,并具有进样体积小、分离快速、效率高、成本低等特点。韩乐等[37]以40 mmol/L乙酸钠-60 mmol/L 乙酸铵-80 mmol/L tris 试剂-25%甲醇(pH 8.3) 为缓冲液,在未涂渍标准熔融石英毛细管(75 μm×64.5 cm,有效长度56 cm) 上分离检测经盐酸-甲醇超声处理的川乌中乌头碱、新乌头碱、次乌头碱、苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱含量,发现6 种生物碱质量度与峰面积的线性关系良好(r>0.999 7),并且该方法简单、准确、高效,可用于该药材的定量检测。
HPLC 是近年来川乌分析中应用较广泛的检测方法,具有灵敏度、准确度、精密度、自动化程序高,重复性好的特点。马奋刚等[38]以0.1 mol/L 乙酸铵-[乙腈-四氢呋喃(25 ∶15)] 为流动相,测定经过氨试液浸润后用异丙醇-乙酸乙酯(1 ∶1) 超声处理的12 批生川乌中6 种二萜生物碱含量,发现单酯型、双酯性二萜生物碱含量分别为0.031 4%~0.072 4%、0.039 6%~0.190 5%,并且该方法重复性好,结果准确,可简便、快速地对该药材指标性成分定量分析。
LC-MS 是将成分分离与定量分析或定性鉴别相结合,对复杂样品进行分析的技术,具有高选择性、高通量、高灵敏度的特点,广泛用于微量成分和体内成分的质量控制。Liu 等[5]采用高效液相色谱-飞行时间质谱(HPLC-TOF/MS)、多元模式识别方法,对按2015 年版《中国药典》 方法炮制前后川乌块茎中双酯型二萜生物碱、单酯型二萜生物碱、醇胺型二萜生物碱进行了鉴定和比较,发现炮制后川乌双酯型二萜生物碱含量降低,单酯二萜生物碱、醇胺二萜生物碱含量升高,可揭示这3 类二萜生物碱之间的转变传递变化。
实时直接分析质谱(DART-MS) 技术是一种能直接电离没有预处理的复杂基质样品的开放式直接离子化技术,让质谱的进样方式变得更简便,不需要复杂的样品制备和色谱分离步骤,可缩短样品分析周期,大幅提高分析通量[39]。Zhu 等[40]将DART-MS 法与多变量数据分析相结合,采用LTQ 离子阱质谱仪,碰撞能量25~40 eV,在正离子模式下可快速识别鉴定川乌加工过程中合格品、不合格的化学标志物单酯二萜生物碱、双酯二萜生物碱,严格控制和评价药材炮制程度,为中药快速质量控制和潜在化学标志物的鉴定提供了可靠的方法。
中药材指纹图谱是以整体信息和药效指标为依据,采用一定的分析手段将中药特征性、有效成分以图谱的形式描绘出来后建立的多指标综合评价体系,具有重复性、系统性、特征性等特点。Zhu 等[41]建立川乌炮制品超高效液相色谱-电喷雾电离/质谱(UPLC-ESI/MS) 指纹图谱,共鉴定出39 个特征性TIC 峰和34 个共有模式UV 色谱峰,9 批样品的相关系数和一致系数均大于0.96。该方法与化学计量学相结合,可为川乌炮制品的质量评价提供了一种灵活可靠的方法。
3.1.2 光谱技术 以紫外光谱 (UV)、近红外光谱(NIR) 为代表的光谱技术具有简便、快速、无损分析等优势,已有报道应用于川乌的质量控制中。
紫外分光光度法仪器设备简单,操作简便,应用广泛,适用于鉴别、杂质检查、定量测定。吕定刚等[42]在碱性条件下用乙醇提取制川乌总生物碱,不经分离直接采用一阶导数紫外分光光度法在239、241 nm 波长下进行一阶导数光谱计算,测得其质量分数为0.367%~0.382%,可实现对制川乌总生物碱的快速定量分析。
近红外光谱法(NIR) 是近年兴起的一种绿色分析技术,具有低消耗、无污染、非破坏性、高效简便等特点,目前已较广泛应用于中药质量控制中[43]。涂瑶生等[44]采用NIR 技术,在8 cm-1分辨率的积分球漫反射和10 000~4 000 cm-1的光谱采集范围内测定放在石英样品杯中的119 批制川乌粉末双酯型、单酯型二萜生物碱、水分含量,发现可准确测定。而且,该方法具有分析速度快、不破坏样品、预测结果准确等优点,可用于制川乌中双酯型、单酯型二萜生物碱和水分含量的预测。
3.1.3 数据分析技术 一测多评法(QAMS) 是一种对中药及其相关产品质量评价的新方法,它利用样品中化学成分的比例关系,在只测定1 种成分的情况下实现对多种成分含量的测定,适用于参比物质不稳定、成本高、制备困难的中药多组分质量控制,可显著降低实验成本和检测时间[45]。陈洪岩等[46]采用高效液相色谱四级杆飞行时间串联质谱(HPLC-QTOF-MS) 法,以甲醇-水(含0.1%甲酸、2.5 mmol/L 醋酸铵溶液) 为流动相,测定制川乌中乌头碱含量,并以其为内标计算新乌头碱、次乌头碱、苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱、乌头原碱、新乌头原碱、次乌头原碱的含量,发现结果与内标法无明显差异,表明方法对川乌的定量测定准确可行,并且操作成本低。
多元统计分析是对中药质量控制研究中存在一定相关性的多指标、多变量数据进行分析,找出隐藏的规律或数据之间的关系,可为决策服务,从而实现中药质量的有效评价,适用于中药资源的质量评价、真伪鉴别、成分解析等[47]。杨正明等[48]利用UHPLC 法测定0.05 mol/mL 盐酸超声提取的川乌中的生物碱含量,并以乌头碱、新乌头碱、次乌头碱、苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱为评价指标,采用差异显著性分析、毒性成分指数分析、效/毒值分析、主成分分析、聚类热图分析、相关性分析、TOPSIS 分析进行数据处理,评价出品质最优的样品。
3.1.4 其他 酶联免疫吸附测定法(ELISA) 是一种定性定量检测技术,其原理是将抗原、抗体的特异性反应与其他显色反应相结合,可对微量甚至痕量的成分定量检测,具有高灵敏度、特异性强、仪器依赖性低、检测快速等优点[49]。Liu 等[50]利用苯甲酰乌头原碱免疫原衍生的抗体,可选择性地与具有酯键(14-苯甲酰基-) 的苯甲酰乌头原碱型生物碱结合,建立测定单酯型二萜生物碱含量的酶联免疫吸附分析方法,可为该类成分提供快速、准确的特异性检测手段。
延迟发光(DL) 是指受光照射后的长期超微弱光子发射衰减现象,它在一定条件下的衰变动力学是反映生物系统内部结构和化学/生理状态的灵敏指标,广泛应用于中药质量控制中[51]。Sun 等[52]报 道,高压灭菌 (127 ℃,60 min) 后川乌粉(150 μm) DL 急剧减少,同时炮制品其他参数与生样品相比有显著差异(P<0.05),表明DL 和化学分析相结合的方法可用于川乌及其炮制品的质量控制。
3.2 含川乌复方制剂 2015 年版《中国药典》 中32 副含川乌复方制剂有14 副对川乌进行了质量控制,具体见表3。
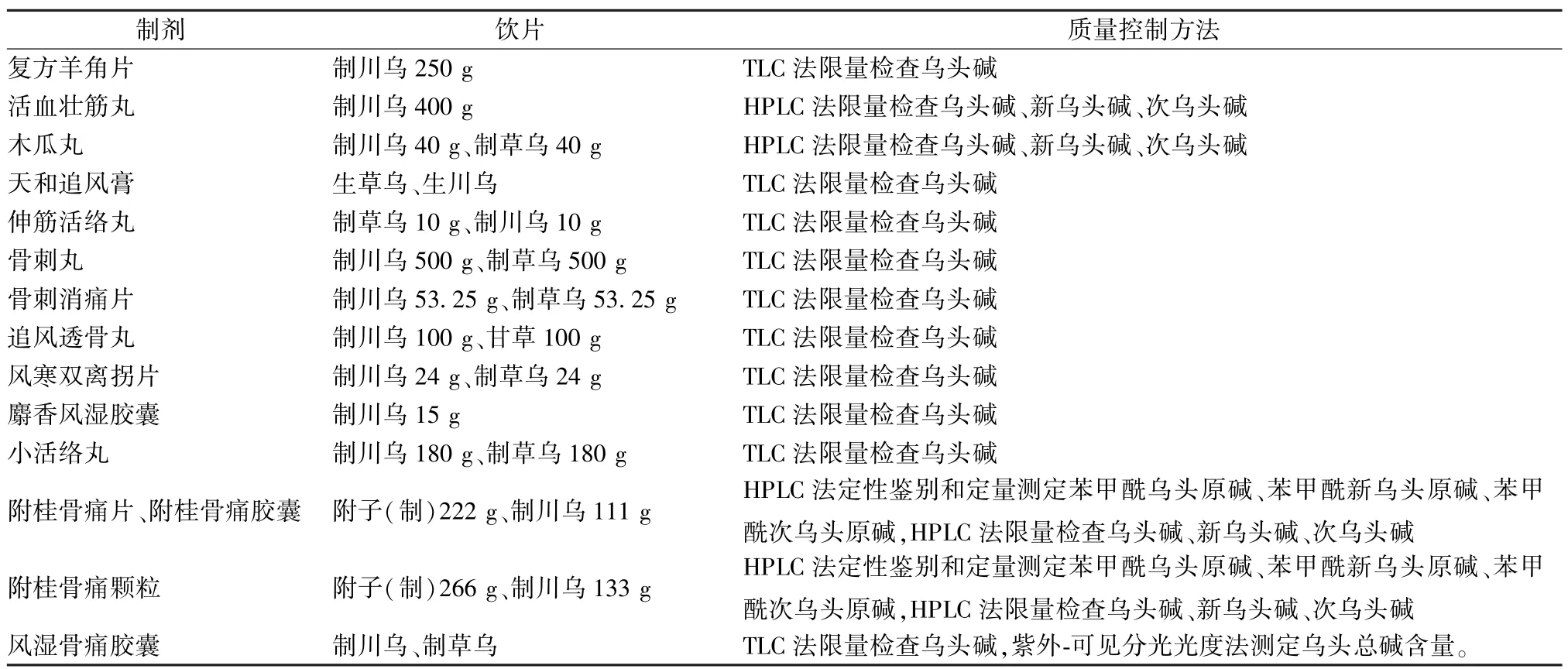
表3 含川乌复方制剂中川乌的质量控制方法。
张剑等[53]利用CE 放大富集技术对小活络丸中乌头碱进行限量检测,以60 mmol/L 磷酸二氢钠(pH=6.0) -乙腈(8 ∶2) 为缓冲液,在非涂渍石英毛细管 (50 μm×43 cm,有效长度35 cm) 分离通道上实现分离和检测,可将该成分检测灵敏度提高了400 倍。郑来丽等[54]根据乌头类总生物碱与溴甲酚绿在柠檬酸-磷酸氢二钠缓冲液(pH=3.5) 中形成络合物的光谱特征,采用分光光度法,在412.5 nm 波长处测定附桂骨痛复方中乌头类总生物碱含量,发现在10.12~22.77 μg/mL 范围内线性关系良好(r=0.999 6),平均加样回收率(n=6) 为99.27%,该方法简便易行,专属性强。有学者采用HPLC-MS 技术,以甲醇-水(90 ∶10) 为流动相,在电喷雾电离源、正离子模式下测定经浓氨试液浸润、乙醚超声处理后附桂骨痛胶囊中乌头碱、新乌头碱、次乌头碱含量,发现三者分别在0.464~3.944 μg/mL(r=0.999 6)、81.6~816 ng/mL(r=0.999 4)、0.482~6.748 μg/mL (r=0.999 7) 范围内线性关系良好,平均加样回收率(n=6) 分别为98.8%、98.1%、98.4%,可快速、灵敏、准确地实现该制剂的质量评价[55]。张小龙等[56]采用HPLC-QTOF-MS 技术,以甲醇-水(含0.1% 甲酸、2.5 mmol/L 醋酸铵) 为流动相,在电喷雾电离源、正离子模式下测定经浓氨试液浸润、乙醚超声处理后风湿骨痛胶囊中双酯型乌头碱、新乌头碱、次乌头碱;单酯型苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱;醇胺型乌头原碱、新乌头原碱、次乌头原碱含量,通过一级质谱定量,二级质谱确认成分,测得r均>0.999 7,加样回收率在98.1%~101.8%之间。巩晓宇等[57]采用固相萃取小柱(SPE) 纯化经甲醇超声提取后的木瓜丸,在0.1%醋酸铵溶液(冰醋酸调pH 至3.5) -乙腈(75 ∶25) 流动相中通过HPLC 法测定木瓜丸中的乌头碱、新乌头碱、次乌头碱含量,发现三者分别在3.10~31.0、1.25~12.5、3.24~32.4 μg/mL 范围内线性关系良好,平均加样回收率(n=6) 为98.01%,该方法经过SPE 柱纯化,能更好地表征该制剂中的微量毒性乌头类生物碱。
3.3 含乌头类生物碱生物样品 研究生物样品可直观得到乌头类生物碱的体内暴露量,能更准确地对川乌进行质量控制。Xu 等[58]采用UHPLC-MS/MS 技术测定分别灌胃人参皂苷Rg1 配伍的乌头碱、苯甲酰乌头原碱、乌头原碱的大鼠血药浓度,发现苯甲酰乌头原碱峰浓度、峰面积显著增加(P<0.05),而乌头碱两者明显降低(P<0.05),而乌头原碱无明显变化(P>0.05),该方法可快速准确地检测出人参皂苷Rg1,可增加苯甲酰乌头原碱暴露量,减少乌头碱暴露,而对乌头原碱暴露量无明显影响。Li 等[59]通过UHPLC-HRMS 技术测定经过分散微固相萃取技术(DMSPE) 处理后人尿液样品中乌头碱、苯甲酰乌头原碱、乌头原碱含量,测得检出限为0.08~0.1 μg/L,定量限为0.2~0.3 μg/L,表明MSPE 与UHPLC-HRMS 结合应用时可使3 种成分获得足够的检测水平。Zhang 等[60]采用超高效液相色谱-三重四极杆质谱(UHPLC-QQQ-MS) 技术结合动态多反应监测(MRM) 模式,测定口服乌头提取物后大鼠血液中18 种生物碱(包括8 种醇胺型、4 种单酯型、6 种双酯型二萜生物碱) 含量,发现乌头碱、新乌头碱、苯甲酰新乌头碱、10-OH-乌头碱生物利用度较低,同时各生物碱在肝、肾中血药浓度较高,而在脑中仅检测到松果碱、新诺啉、苯甲酰脱氧乌头碱,该方法可以准确测定该类成分的体内暴露和分布情况。
4 结语
川乌传统功效为祛风除湿、温经止痛,主要药理作用是抗炎镇痛,同时越来越多学者关注到该药材抗肿瘤作用,可见其药理活性广泛,具有很高的药用价值。但它又是大毒中药,具有心脏毒性、神经毒性、肝毒性等,并且治疗窗口窄,故要对其及相关制剂进行严格有效的质量控制。
2015 年版《中国药典》 收录了32 副含川乌或制川乌的复方制剂(包括内服和外用),其中22 副以制川乌入药。川乌经过炮制后,双酯型二萜生物碱含量降低,单酯二萜生物碱、醇胺二萜生物碱含量升高,但醇胺型生物碱无紫外吸收,故单一质量控制方法无法达到全面有效控制该药材安全性和有效性的。由此建议,应建立能体现川乌多组分、多靶点、多途径协调作用特点的整体质量控制方法,以便于规范指导该药材及其相关制剂的临床应用。
