白术多糖通过调控TLR4/NF-κB 信号通路对重症急性胰腺炎大鼠肠黏膜免疫屏障的影响
2021-03-25朱大侠刘礼剑
江 勇,朱大侠,刘礼剑
(南华大学附属南华医院急诊科,湖南 衡阳 421002)
重症急性胰腺炎 (severe acute pancreatitis,SAP) 是一种临床常见的急危重症,其发病快、病变复杂、并发症多且死亡率高,严重威胁着人类健康[1]。肠道是SAP 发生应激反应的中心器官,SAP 发生时大量炎症因子释放,使肠道出现微循环障碍,并伴随免疫细胞大量凋亡,导致肠道免疫功能被抑制,肠屏障受损,肠道内细菌和内毒素移位,最终造成胰腺坏死继发腹腔感染,甚至诱发腹腔室隔综合征和多器官衰竭综合征,使胰腺炎病情加重[2-3]。
白术多糖是白术的重要组成成分,具有改善胃肠道功能[4]、调节免疫生物活性[5]、抗肿瘤[6]等作用,但有关白术多糖在重症急性胰腺炎致肠黏膜免疫屏障损伤中的作用,还未曾报道。TLR4 (Toll样受体) 是一类天然免疫模式识别受体,可活化NF-κB (核因子-κB) 并促进其下游相关炎性因子的表达。在正常生理条件下TLR4/NF-κB 通路的活化可激活机体免疫应答,然而在炎性病理条件下该通路的活化可引起炎症级联反应。有研究显示[7],TLR4/NF-κB 通路在SAP 介导的肠黏膜屏障功能障碍中可作为炎症反应的“阀门”,介导炎性介质的释放并引起SAP 各器官损伤。白术多糖是否通过TLR4/NF-κB 信号通路参与SAP 肠黏膜免疫屏障的调控,目前鲜有报道。为此,本研究拟通过胰胆管逆行注射牛磺胆酸钠法建立SAP 大鼠模型,旨在探讨白术多糖对急性胰腺炎大鼠肠黏膜免疫屏障的保护作用及其对TLR4/NF-κB 信号通路的影响,为其新药研发提供理论依据。
1 材料与方法
1.1 动物 无特定病原体(SPF) 级雄性SD 大鼠60 只,鼠龄6~7 周,体质量(250±20) g,由湖南省动物实验中心提供,动物生产许可证号SCXK(湘) 2019-0023。饲养条件为温度(23±2)℃,相对湿度50%~70%,12 h/12 h 明暗交替,自由饮食摄水。
1.2 试剂与仪器 白术多糖(多糖质量分数≥95%,批号ZL180112133) 购于南京泽朗生物科技有限公司。注射用乌司他丁(批号C0018021) 购于广东天普生化医药有限公司;牛胆酸钠(批号20190203006)、苏木素-伊红 (HE) 染色试剂盒(批号C233029) 购于上海碧云天生物技术有限公司;白介素-1β (IL-1β,S009591)、白介素-6(IL-6,S006040)、肿瘤坏死因子-α (TNF-α,S004441) ELISA 试剂盒购于美国R&D 公司;大鼠分泌性免疫球蛋白A (sIgA) 放射免疫分析药盒(批号S00569) 购于北京原子高科股份有限公司;TLR-4 (批 号 GR109440-1)、MyD88 (批 号GR133612-2)、p-NF-κB p65 (Ser536) (批 号GR117656-1)、NF-κB p65 (批 号GR129871-4)、GAPDH 抗体购于英国Abcam 公司;荧光抗体APCCD3e (L40095)、CD4-PE (批号L10535)、CD8a-PE (批号L11306) 购于美国Biolegend 公司;石蜡切片机购于德国Leitz 公司;酶标仪购于美国Thermo Fisher Science 公司;荧光倒置显微镜购于日本Olympus公司;流式细胞仪购于美国BD 公司。
1.3 方法
1.3.1 造模及分组 60 只大鼠适应性饲养1 周后,随机分成5 组,假手术组、SAP 模型组、阳性药物乌司他丁组、白术多糖低剂量组和白术多糖高剂量组,每组12 只。所有大鼠腹腔注射3%戊巴比妥钠麻醉后,采用逆行胆胰管注射5%牛磺胆酸钠溶液(0.1 mL/100 g,体积流量0.2 mL/min) 建立SAP 模型[8],注射10 min 后可观察到胰管走形区域的胰腺组织出现充血、水肿,且随着时间延长红肿面积逐渐扩大,表明SAP 模型制作成功,即可逐层缝合并关闭腹腔。假手术组大鼠仅行腹部切口,不注射牛磺胆酸钠,在闭合腹部前稍微翻动胰腺组织数次。造模成功后立即进行药物干预,乌司他丁组大鼠通过腹腔注射2×104U/kg 乌司他丁,白术多糖低剂量组和白术多糖高剂量组大鼠分别通过腹腔注射200 mg/kg 和400 mg/kg 白术多糖,而假手术组和SAP 模型组大鼠注射等量生理盐水,每天1 次,给药48 h 后处死大鼠取材。
1.3.2 血清淀粉酶及炎症因子水平检测 腹主动脉采血并分离血清,采用碘比色法检测血清淀粉酶活性;采用ELISA 法检测血清TNF-α、IL-1β 和IL-6 水平。
1.3.3 HE 染色观察胰腺和小肠组织病理变化取胰腺组织和小肠组织,洗净后用10% 福尔马林固定,石蜡包埋后将石蜡块4 μm 切片并行苏木素-伊红(HE) 染色,于显微镜下观察病理改变,并采用Schmidt 评分标准[9]对胰腺进行病理评分,采用Chui’ s 评分法[10]对小肠组织进行病理评分。
1.3.4 流式细胞术检测小肠肠黏膜中T 细胞亚群比例 取小肠组织,生理盐水洗净剪碎后加入消化酶,于恒温水浴振荡器中消化30 min 后经滤网过滤,加入淋巴细胞分离液分离淋巴细胞。取500 μL调整好浓度的细胞悬液于流式检测管中,加入APC-CD3e、PE-CD4 和PE-CD8a 抗体,室温下避光孵育20 min,1 000 r/min 离心10 min,弃上清,加入PBS 缓冲液重悬细胞,上流式细胞仪检测。以CD3e+CD4+双阳性细胞亚群百分比表示CD4+T 细胞所占比例,以CD3e+CD8+双阳性细胞亚群表示CD8+T 细胞所占比例,并计算CD4+/CD8+T 细胞比值。
1.3.5 放射免疫法检测小肠黏膜中sIgA 水平 取小肠组织,生理盐水清洗后,以10% 醋酸溶液冲洗肠腔并收集灌洗液,4 ℃条件下20 000 r/min 离心30 min,收集上清液,按照试剂盒说明书进行操作,采用放射免疫分析法检测slgA 水平。
1.3.6 Western blot 检测小肠组织中TLR-4/NF-κB通路相关蛋白表达 收集各组大鼠小肠组织置于组织匀浆器内,加入蛋白裂解液和蛋白酶抑制剂于冰上碾磨匀浆,12 000 r/min,4 ℃离心20 min,取上清。采用考马斯亮蓝法测定蛋白浓度,取25 μg蛋白进行SDS-PAGE 电泳分离蛋白,并将蛋白转移至PVDF 膜上,5%脱脂牛奶室温封闭1 h,分别加入TLR-4、MyD88、p-NF-κB p65、NF-κB p65 和GAPDH 抗体,4 ℃孵育过夜,次日加入相应二抗,室温孵育1 h,ECL 试剂曝光显影,在全自动凝胶成像系统中曝光显影。目的蛋白相对表达量=目的蛋白灰度值/GAPDH 灰度值。
1.4 统计学分析 所有数据均采用SPSS 22.0 统计学软件进行统计学分析,计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t 检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 白术多糖对SAP 大鼠血清淀粉酶及炎症因子水平的影响 如表1 所示,与假手术组比较,SAP模型组大鼠血清中淀粉酶活性以及TNF-α、IL-1β、IL-6 水平增加(P<0.01);与SAP 模型组比较,白术多糖高剂量组和乌司他丁组血清中淀粉酶活性及TNF-α、IL-1β、IL-6 水平降低(P<0.01),而白术多糖低剂量组无明显差异(P>0.05)。
2.2 白术多糖对SAP 大鼠胰腺及小肠组织病理学的影响 如图1 所示,假手术组大鼠胰腺结构正常,无水肿,无炎性细胞浸润;SAP 模型组和白术多糖低剂量组大鼠胰腺结构严重破坏,间质水肿,大量炎症细胞浸润;白术多糖高剂量组和乌司他丁组大鼠胰腺病理特征较SAP 模型组明显改善,可观察到胰腺组织炎症浸润水平降低,间质水肿程度减轻,胰腺结构相对较完整。如图2 所示,假手术组大鼠小肠黏膜绒毛排布规整,刷状缘光整平滑,未见明显损伤;SAP 模型组和白术多糖低剂量组大鼠小肠黏膜破损严重,小肠黏膜绒毛水肿、萎缩变形、排列紊乱,局部灶性坏死;白术多糖高剂量组和乌司他丁组大鼠小肠绒毛形态较SAP 模型组相对完整,各层结构相对清晰完整。如表2 所示,与假手术组比较,SAP 模型组大鼠胰腺组织Schmidt 评分和小 肠组织Chui’s 评分增加 (P<0.01);与SAP 模型组比较,白术多糖高剂量组和乌司他丁组大鼠胰腺组织Schmidt 评分和小肠组织Chui’s 评分降低(P<0.01),而白术多糖低剂量组无明显差异(P>0.05)。
表1 各组大鼠血清淀粉酶及炎症因子水平比较(, n=12)Tab.1 Comparison of serum levels of amylase and inflammatory factors in rats among various groups (, n=12)

表1 各组大鼠血清淀粉酶及炎症因子水平比较(, n=12)Tab.1 Comparison of serum levels of amylase and inflammatory factors in rats among various groups (, n=12)
注:与假手术组比较,**P<0.01;与SAP 模型组比较,##P<0.01。

图1 各组大鼠胰腺组织切片病理变化(HE 染色,×200)Fig.1 Pathological changes of pancreas tissue sections of rats in various groups (HE staining,×200)
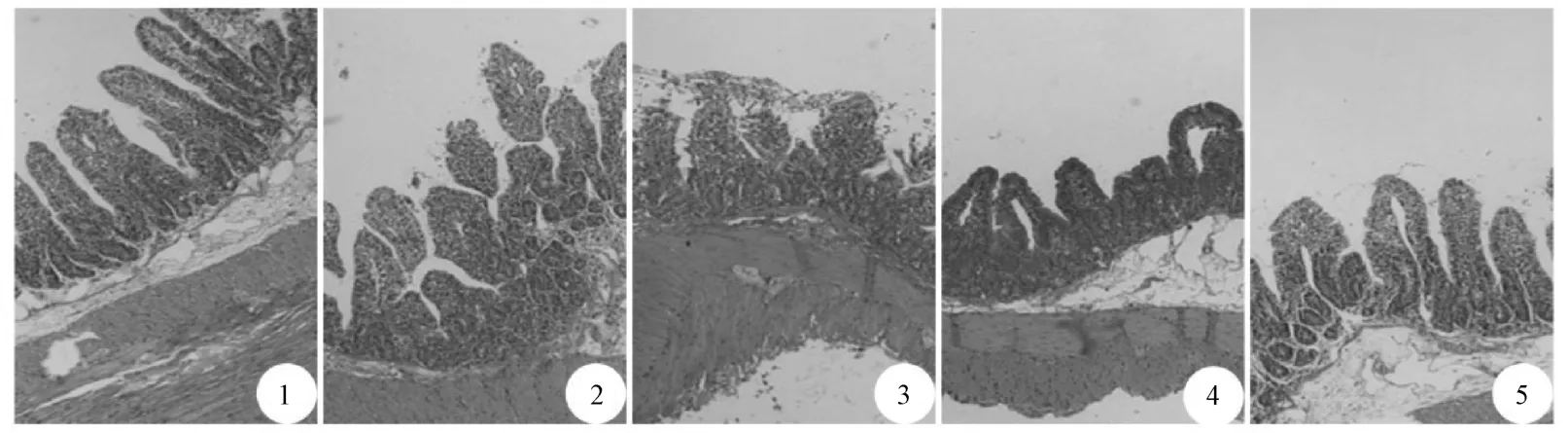
图2 各组大鼠小肠组织切片病理观察(HE 染色,×200)Fig.2 Pathological changes of small intestine tissue sections in rats in various groups (HE staining,×200)
表2 各组大鼠胰腺和小肠组织病理学评分(, n=12)Tab.2 Pathological scores of small intestine tissue and pancreas of rats in various groups (, n=12)
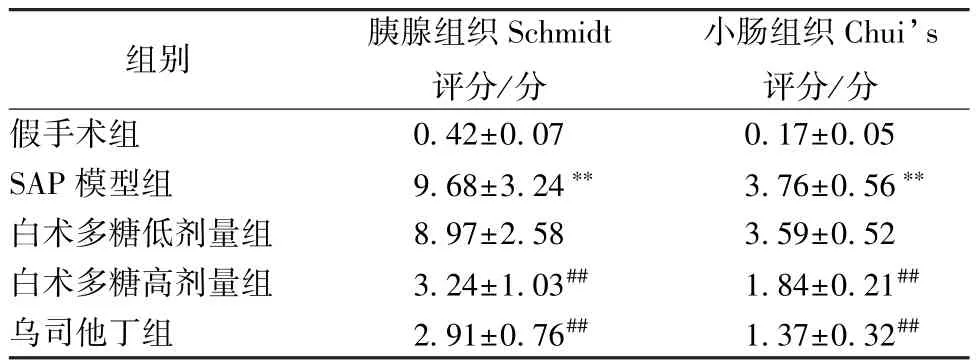
表2 各组大鼠胰腺和小肠组织病理学评分(, n=12)Tab.2 Pathological scores of small intestine tissue and pancreas of rats in various groups (, n=12)
注:与假手术组比较,** P <0.01;与SAP 模型组比较,##P<0.01。
2.3 白术多糖对SAP 模型大鼠小肠黏膜中T 细胞亚群比例及sIgA 水平的影响 如表3 所示,与假手术组比较,SAP 模型组大鼠小肠黏膜中CD4+T细胞亚群比例及CD4+/CD8+比值和sIgA 水平降低(P<0.01),而CD8+T 细胞亚群比例升高 (P<0.01);与SAP 模型组比较,白术多糖高剂量组和乌司他丁组大鼠小肠黏膜CD4+T 细胞亚群比例及CD4+/CD8+比 值、sIgA 水平增加 (P<0.01),CD8+T 细胞亚群比例降低(P<0.01);白术多糖低剂量组无明显差异(P>0.05)。
表3 各组大鼠肠黏膜中T 细胞亚群比例及sIgA 水平比较(, n=12)Tab.3 Comparison of T cell subsets and sIgA levels in intestinal mucosa of rats among various groups (, n=12)

表3 各组大鼠肠黏膜中T 细胞亚群比例及sIgA 水平比较(, n=12)Tab.3 Comparison of T cell subsets and sIgA levels in intestinal mucosa of rats among various groups (, n=12)
注:与假手术组比较,**P<0.01;与SAP 模型组比较,##P<0.01。
2.4 白术多糖对SAP 大鼠小肠组织中TLR-4/NFκB 信号通路蛋白表达的影响 如图3 所示,与假手术组比较,SAP 模型组大鼠小肠组织中MyD88、TLR-4 蛋白及p-NF-κB p65 水平升高(P<0.01),而NF-κB p65 蛋白表达无明显变化(P>0.05);与SAP 模型组比较,白术多糖高剂量组和乌司他丁组大鼠小肠组织中MyD88、TLR-4 蛋白及p-NF-κB p65 水平降低(P<0.01),NF-κB p65 蛋白表达无明显变化(P>0.05),而白术多糖低剂量组与SAP模型组比较以上蛋白表达水平无明显差异(P>0.05)。

图3 各组大鼠小肠组织TLR-4、MyD88、NF-κB p65、p-NF-κB p65 (Ser536) 蛋白表达Fig.3 Protein expressions of TLR-4,MyD88,NF-κB p65 and p-NF-κB p65 (Ser536) in small intestine of rats in various groups
3 讨论
在SAP 的发病过程中,胰腺细胞释放大量炎症介质和细胞因子如TNF-α、IL-6 和IL-1β 等,这些炎症因子之间相互作用,导致促炎与抗炎细胞因子系统失衡,引发全身炎症反应[11]。免疫球蛋白sIgA 主要存在于黏膜上层的黏液中,是黏膜局部免疫反应的主要抗体,sIgA 水平下降表示局部免疫功能下降,而sIgA 分泌减少可降低肠道抵御细菌和毒素入侵的能力,且易激活细胞炎性因子,产生过度炎性反应,进一步损害肠黏膜[12]。血清淀粉酶是SAP 诊断中最常用的生化标志物。姚金锋[13]等人研究显示,SAP 大鼠胰腺组织出现严重炎症反应,肠黏膜组织受到破坏,血清淀粉酶活性明显上升,同时小肠黏膜sIgA 水平显著下调。本研究结果显示,高剂量白术多糖可降低SAP 大鼠血清中淀粉酶活性以及炎症因子TNF-α、IL-6 和IL-1β 水平,下调肠黏膜中sIgA 水平,说明白术多糖可以通过降低肠道黏膜通透性、改善肠道免疫屏障功能起到保护SAP 大鼠肠道黏膜的作用。
CD4+T、CD8+T 淋巴细胞和CD4+T/CD8+T 值的改变代表机体免疫功能的改变,一定程度上也是反映SAP 损伤严重程度的敏感指标[14]。Liu 等[15]人在对76 名SAP 患者的研究中发现,患者外周血中CD4+T 细胞比例和CD4+/CD8+比值较正常人明显下调;Wang[16]研究SAP 大鼠肠道免疫功能的变化发现,SAP 发生后CD4+T、CD4+T/CD8+T 比值明显下降,CD8+T 细胞比例上调,说明大鼠早期即发现肠黏膜免疫功能明显下降。本研究结果显示,与假手术组比较,SAP 模型组大鼠小肠黏膜中CD4+T 细胞亚群比例和CD4+/CD8+比值降低,而CD8+T 细胞亚群比例显著升高,与前人研究一致,而高剂量白术多糖治疗组大鼠肠黏膜中CD4+T细胞亚群比例、CD4+/CD8+比值明显回升,而CD8+T 细胞亚群比例明显下调,说明白术多糖可以通过改善机体T 细胞亚群免疫功能,减轻肠道炎症反应和损伤,进而起到保护肠黏膜免疫屏障的作用。
TLR4/NF-κB 通路是近些年来发现与抗炎免疫机制密切相关的信号通路,NF-κB 的异常活化引起炎性细胞因子的失控释放,是导致胰腺外损伤的重要机制[17]。NF-κB 信号通路受多种上游信号分子刺激而激活,TLR4 是其中之一。有研究显示[18],SAP 时内毒素进入血液,其结构成分脂多糖被转运至细胞膜表面被TLR4 识别后启动细胞内信号传导,使NF-κB 从胞浆转到核内,诱导多种细胞因子如IL-6、IL-1β 等的合成,破坏肠黏膜屏障。本研究Western blot 结果显示,与假手术组比较,SAP 模型组大鼠小肠组织中TLR4、MyD88 蛋白以及p-NF-κB p65 水平均显著上升,与兰涛等[19]研究一致,而高剂量白术多糖干预组能降低大鼠小肠组织中TLR4、MyD88 蛋白和p-NF-κB p65 表达水平,由此可以推测SAP 诱导的肠黏膜免疫屏障损伤与TLR4/NF-κB 信号通路的激活有关,而白术多糖可以通过抑制TLR4/NF-κB 信号活化,保护SAP大鼠肠黏膜免疫屏障功能不受损伤。
综上所述,白术多糖可通过抑制TLR4/NF-κB信号通路,减轻SAP 大鼠炎症反应,提高肠道sIgA 水平,增加肠黏膜中T 细胞亚群比例,改善胰腺组织和小肠组织病理损伤,保护肠黏膜免疫屏障。