20(S)-原人参二醇止血作用及其机制
2021-03-25宿文杰张玉尧李荣森王隶书徐云凤
宿文杰,张玉尧,李荣森,王隶书,2,徐云凤,张 鹤,4*
(1.长春中医药大学/吉林省中药生物大分子重点实验室,吉林 长春 130117;2.吉林省中医药科学院,吉林 长春 130012;3.长春金赛药业股份有限公司,吉林 长春 130012;4.长春中医院大学附属医院,吉林 长春 130021)
三七为五加科植物三七Panax notoginseng(Burk.) FH.Chen 的干燥根,对血液系统有止血、抗血栓双重作用。目前,三七中抗血栓类皂苷成分研究报道较多,其中原人参二醇型人参皂苷Rb1[1]、Rg3[2]、Rd 和Rh2[3],原人参三醇型人参皂苷Re[4]、Rg1[5]、Rg2[6],三七皂苷Fc[7]和R1[8]均可抑制血小板聚集和抗血栓形成。而三七中的止血成分主要是三七素[9-10];三七皂苷Ft1 也有一定的止血功效[3,11]。在目前的研究中发现,三七中三七素质量分数仅为0.76%[12],三七皂苷Ft1更低,故认为三七中重要的止血成分仍未被发现。20 (S) -原人参二醇型皂苷在酸、碱、酶、微生物等条件下可水解脱去糖链,得到20 (S) -原人参二醇皂苷元 [20 (S) -protopanaxadiol,PPD][13-14]。近年来,研究发现PPD 能够通过升高抑郁模型大鼠脑内的去甲肾上腺素(NA)、HAV和5-羟色胺 (5-HT) 水平,发挥抗抑郁的作用[15]。而NA 和5-HT 水平升高可激活血小板,促进血小板聚集[16-17],Gao 等人报道PPD 能增加ADP 诱导的血小板聚集率[3]。目前尚未有PPD 在止血方面研究,因此本实验主要研究PPD 的止血作用并初步探讨其作用机制。
1 材料和方法
1.1 材料
1.1.1 动物 雄性昆明小鼠(18~22 g) 和雄性Wistar 大鼠(180~200 g) 购自辽宁长生生物技术有限公司,动物生产许可证号SCXK (吉) -2016-0003。实验经长春中医药大学实验动物伦理学委员会批准(编号20170903),动物饲养于SPF 级饲养室内,12 h/12 h 昼夜循环,室温(22±2)℃,相对湿度50%~55%,自由摄食饮水,实验开始前适应性饲养3 d。
1.1.2 试剂与仪器 20 (S) -原人参二醇(纯度≥98%,批号MUST-16070401,上海源叶生物科技有限公司);注射用白眉蛇毒血凝酶(Hemocoagulase,批号170622,锦州奥鸿药业有限责任公司);凝血酶原(PT,批号20181226)、活化部分凝血活酶时间 (APTT,批号20181226)、凝血酶时间(TT,批号20181226)、纤维蛋白原(FIB,批号20181226) 试剂盒(南京建成生物工程研究所);萤光素/萤光素酶试剂和凝血酶(美国Chrono-Log公司);Fluo 3-AM (批号S1056,碧云天生物技术研究所);环磷酸腺苷 (cAMP) ELISA 试剂盒(批号20181009A)、环磷酸鸟苷(cGMP) ELISA试剂盒(批号20 181 009 A) (上海优选生物科技有限公司);PAC-1 (批号304904)、CD62P (批号362804) (美国BioLegend 公司)。自动凝血分析仪(江苏霍纳医疗器械有限公司);XT-2000i 自动血液分析仪(日本希森美康株式会社);700 型血小板聚集仪 (美国Chrono-log 公司);Infinite M200Pro 多功能酶标仪 (瑞士 Tecan 公司);Cytation 5 多功能酶标仪(美国Bio-Tek 公司);流式细胞分析仪(美国BD 公司)。
1.2 方法
1.2.1 小鼠断尾和肝划痕出血时间测定 小鼠断尾模型,取雄性昆明小鼠(18~22 g) 40 只,随机分为5 组,分别为空白对照组(1% CMC-Na 生理盐水),血凝酶组 (1 kU/L),低、中、高剂量PPD 组(2、4、8 mg/kg)。皮下给药4 h 后,腹腔注射1%戊巴比妥钠麻醉小鼠。5 min 后,固定于鼠板,将鼠尾置于37 ℃生理盐水中预温3 min,距鼠尾尖端10 mm 处用干净手术刀剪断,尾巴浸没37 ℃的生理盐水中,记录出血时间。出血时间是从剪断开始出血到停止出血的时间。
小鼠肝划痕模型,分组给药方式与小鼠断尾模型相同,麻醉5 min 后,固定于鼠板,用干净的手术剪刀沿腹正中线剪开腹腔,暴露肝脏。保持小鼠生命,用2 mL 注射器形成约1 cm 创口,造成肝脏出血,用滤纸片每隔10 s 蘸一下,直至滤纸上没有血迹为停止出血,记录出血时间。每个实验结束后,二氧化碳安乐死法处死动物。
1.2.2 大鼠血常规的检测 将40 只Wistar 雄性大鼠(180~200 g) 随机分为5 组,空白对照组(1% CMCNa 生理盐水),血凝酶组(1 KU/mL),低、中、高剂量PPD 组(2、4、8 mg/kg)。皮下注射药物4 h 后,腹腔注射1%戊巴比妥钠麻醉大鼠,腹主动脉取血,加入到含有EDTA 的抗凝管中。应用XT-2000i 自动血液分析仪进行血常规各指标的检测。
1.2.3 凝血四项的测定 雄性Wistar 大鼠(180~200 g),腹腔注射1%戊巴比妥钠麻醉大鼠,腹主动脉取血,注入有3.8%枸橼酸钠的抗凝管中,颠倒混匀,3 000 r/min 离心15 min,上清为待测血浆。取1.45 mL 血浆,加入0.05 mL PPD,混合均匀后在37 ℃烘箱中孵育10 min,根据凝血酶原时间(PT)、活化的部分凝血活酶时间(APTT)、凝血酶时间(TT) 和纤维蛋白原浓度(FIB) 测定试剂盒说明书,应用H1201 自动凝血分析仪(江苏霍纳医疗器械有限公司,中国) 进行检测(具体步骤略)。血液标本在4 h 内完成测定。
1.2.4 ELISA 法检测大鼠血小板cAMP 和cGMP 水平 参考文献方法[18],从雄性Wistar 大鼠腹主动脉取血,3.8%枸橼酸钠(1 ∶9) 抗凝。800 r/min离心5 min,吸取上层富含血小板的血浆(PRP)。室温下,2 500 r/min 离心8 min,弃去上清液,得到血小板团块。加入适量Tyrode’ s buffer (137 mmol/L NaCl,2 mmol/L KCl,1 mmol/L CaCl2,12 mmol/L NaHCO3,5 mmol/L HEPES,0.35% FBS,pH 7.4),反复洗涤2 次,重悬血小板。取145 μL 洗涤血小板与5 μL 不同浓度的PPD (终浓度为35、70、140 μmol/L),37 ℃恒温孵育30 min,加150 μL 10 mmol/L EDTA 终止反应。置于-80 ℃冰箱,反复冻融5 次,4 ℃4 000 r/min 离心10 min,收集上清液,按照大鼠环磷酸腺苷(cAMP) 和大鼠环磷酸鸟苷(cGMP) 酶联免疫检测试剂盒说明书操作,酶标仪测定OD 值,根据标准曲线计算出每个样品中cAMP 和cGMP 的水平。
1.2.5 洗涤血小板的制备 健康志愿者肘静脉采血或雄性Wistar 大鼠(180~200 g) 腹主动脉取血,3.8%枸橼酸钠(1 ∶9) 抗凝。800 r/min 离心5 min,吸取上层富血小板血浆 (platelet-rich plasma,PRP);取PRP 血浆2 500 r/min 离心8 min,弃去上清液,得到浓缩血小板团块,加入适量Tyrode’s buffer,反复洗涤2 次,重悬血小板;用血细胞自动分析仪测定血小板数目,用Tyrode’s buffer调整洗涤人或大鼠血小板数目为3×108/mL。
1.2.6 [Ca2+]i测定 取洗涤人血小板,加入Fluo-3AM (终浓度为5 μmol/L) 轻摇混匀后,避光放置37 ℃烘箱中孵育60 min,弃去荧光探针,用Tyrode’ s buffer 重悬血小板,调整血小板浓度为3×108/mL。取140 μL 负载Fluo-3 的血小板加入96 孔板(黑色,不透明),每孔加入药物10 μL,溶剂作为空白对照,应用Cytation 5 多功能酶标仪每隔18 s 测定血小板胞浆内[Ca2+]i,总检测时间为20 min。设置激发波长为488 nm,发射波长为525 nm,[Ca2+]i测定公式为:[Ca2+]i=Kd× (FFmin)/(Fmax-F),式中Kd是Ca2+结合Fluo 3-AM 的解离常数,为525 nmol/L (37 ℃)[19];F为各样本荧光强度的测定值。Fmin和Fmax分别是最小荧光强度和最大荧光强度的测定值。Fmin和Fmax是分别在血小板中加入10 mmol/L EGTA 和0.1% Triton X-100 测定的荧光强度值。
1.2.7 血小板聚集率检测 本实验应用Chrono-log 700 血小板聚集仪采用比浊法测定血小板聚集率,转速为1 000 r/min,温度(37±1)℃。取洗涤大鼠/人血小板270 uL 加入反应杯,放入血小板聚集仪,调整基线,分别加入30 μL 甲醇和PPD (终浓度为17.5、35、70、140、280 μmol/L),待血小板聚集到达最高聚集率后停止记录。上述实验重复进行3 次。
1.2.8 流式细胞分析仪测定CD62P (P-选择素)的表达率和胱冬肽酶原激活物1 (procaspase activating compound 1,PAC-1) 结合率 取洗涤人血小板加入10 mmol/L CaCl2,使CaCl2终浓度为1 mmol/L。取含1 mmol/L CaCl2洗涤人血小板,加入不同浓度的PPD 放置37 ℃烘箱中孵育5 min,然后分别加入CD62P (FITC 标记的P-选择素) 和PAC-1 (FITC 标记的PAC-1),室温避光放置20 min,加入200 μL PBS 终止反应,使用流式细胞分析仪收集10 000 个血小板,分别计算CD62P的表达率和PAC-1 结合率。
1.3 统计学分析 通过GraphPad Prism 8.0.2 软件进行处理,数据以() 表示,组间比较采用单因素方差分析(one-way ANOVA)。P<0.05 表示差异具有明显统计学意义。
2 结果
2.1 PPD 对小鼠出血时间的影响 从表1 可以看出,与空白对照组比较,3 个剂量组PPD 能缩短小鼠断尾出血时间和小鼠肝划伤出血时间,各给药组均能降低小鼠断尾出血时间(P<0.05 或P<0.01),同时PPD 减少了小鼠肝划痕出血时间(P<0.01)。
表1 PPD 对小鼠断尾模型和肝划痕模型出血时间的影响(, n=8)Tab.1 Effect of PPD on mouse bleeding time at tail amputation model and liver scratch model (, n=8)
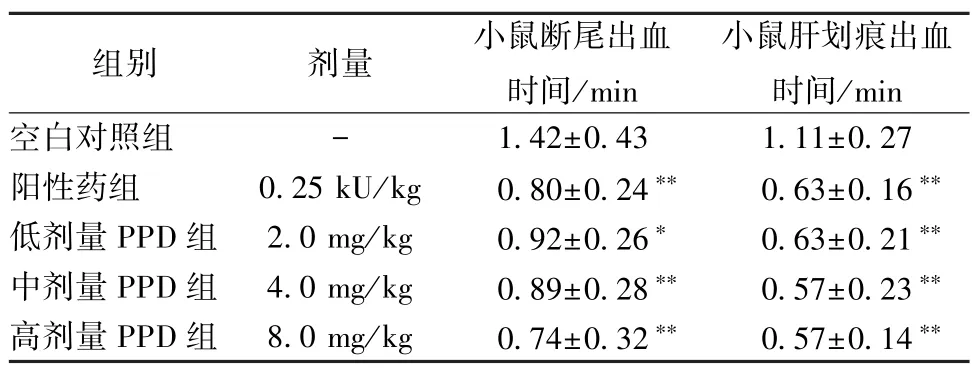
表1 PPD 对小鼠断尾模型和肝划痕模型出血时间的影响(, n=8)Tab.1 Effect of PPD on mouse bleeding time at tail amputation model and liver scratch model (, n=8)
注:与空白对照组比较,*P<0.05,**P<0.01。
2.2 PPD 对大鼠血常规的影响 从表2~4 可以看出,与空白对照组比较,红细胞(RBC)、血红蛋白(HGB) 和血小板(PLT) 参数均有明显变化。红细胞参数方面,与空白对照组比较,中剂量PPD 组增加大鼠RBC 数量(P<0.01),见表2;低剂量PPD 组和中剂量PPD 组增加血浆中红细胞压积(HCT) (P<0.05)。血红蛋白参数方面,低剂量PPD 组中平均血红蛋白量(MCH) 与空白对照组相比增高(P<0.05),各给药组大鼠HGB 数量及平均红细胞血红蛋白浓度(MCHC) 略有升高,但无明显差异(P>0.05)。血小板参数方面,与空白对照组比较,中剂量PPD 组和高剂量PPD组能增加大鼠血清中血小板计数(PLT) 和血小板压积(PCT) (P<0.05,P<0.01),见表4。与空白对照组比较,大鼠血清中其他血细胞参数(如白细胞、中性粒细胞、淋巴细胞等) 无明显差异(P>0.05)。
表2 PPD 对大鼠红细胞参数的作用(, n=8)Tab.2 Effect of PPD on parameters of red blood cell in rats (, n=8)
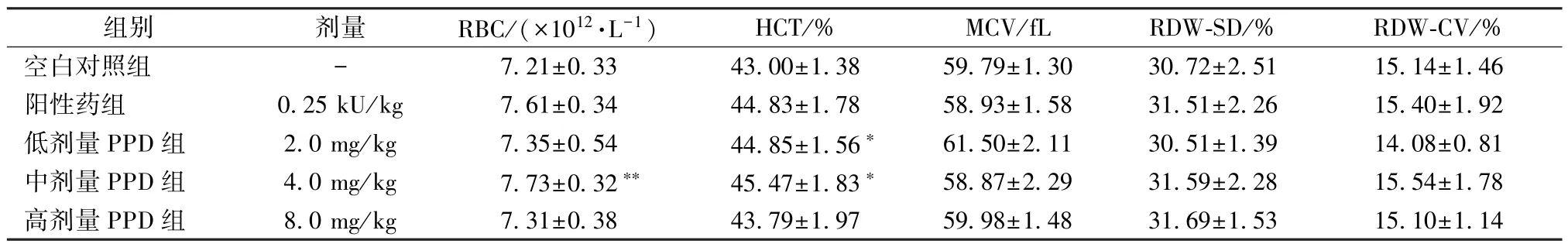
表2 PPD 对大鼠红细胞参数的作用(, n=8)Tab.2 Effect of PPD on parameters of red blood cell in rats (, n=8)
注:与空白对照组比较,*P<0.05,**P<0.01。
表3 PPD 对大鼠血红蛋白参数的作用(, n=8)Tab.3 Effect of PPD on parameters of hemoglobin in rats (, n=8)
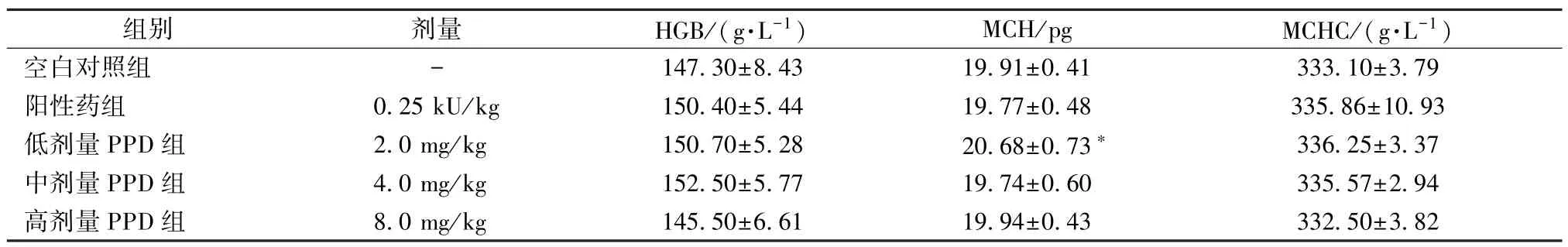
表3 PPD 对大鼠血红蛋白参数的作用(, n=8)Tab.3 Effect of PPD on parameters of hemoglobin in rats (, n=8)
注:与空白对照组比较,*P<0.05。
表4 PPD 对大鼠血小板参数的作用(, n=8)Tab.4 Effect of PPD on parameters of platelet in rats (, n=8)
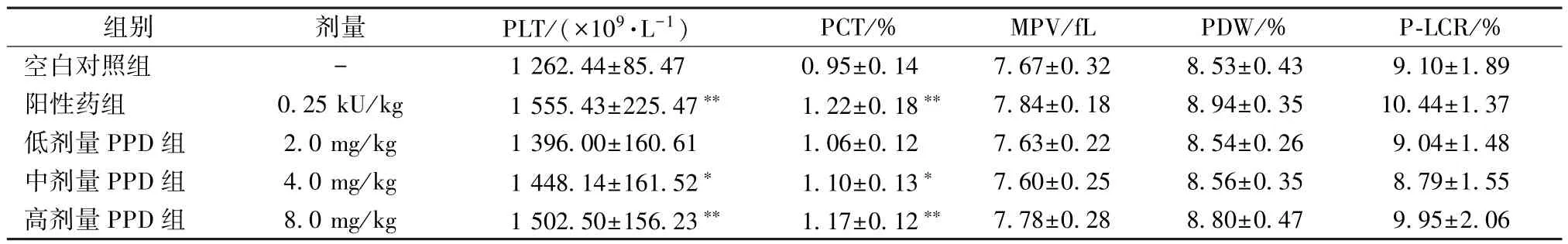
表4 PPD 对大鼠血小板参数的作用(, n=8)Tab.4 Effect of PPD on parameters of platelet in rats (, n=8)
注:与空白对照组比较,*P<0.05,**P<0.01。
2.3 PPD 对大鼠凝血四项的影响 从表5 可以看出,PPD 各给药组与空白对照组比较,PPD 3 个剂量组均能缩短大鼠APTT (P<0.01 或P<0.05),中剂量PPD 组、高剂量PPD 组增加纤维蛋白原水平(P<0.05,P<0.01),而对大鼠血浆TT 和PT没有明显差异(P>0.05)。
表5 PPD 对大鼠凝血四项的作用(, n=3)Tab.5 Effect of PPD on plasmatic coagulation parameters of rats (, n=3)

表5 PPD 对大鼠凝血四项的作用(, n=3)Tab.5 Effect of PPD on plasmatic coagulation parameters of rats (, n=3)
注:与空白对照组比较,*P<0.05,**P<0.01。
2.4 PPD 对大鼠血浆cAMP 和cGMP 水平的影响 血小板内cAMP 和cGMP 依赖蛋白激酶调节血小板的功能,在诱导和抑制血小板聚集过程中具有调节作用[20]。从表6 可以看出,与空白对照组比较,各给药组能抑制大鼠cAMP 的产生(P<0.01),呈剂量依赖性,当PPD 浓度为140 μmol/L 时,PPD对大鼠cAMP 的产生抑制作用最强;而对cGMP 的产生没有影响(P>0.05)。
表6 PPD 对大鼠血浆cAMP 和cGMP 水平的作用(,n=3)Tab.6 Effects of PPD on plasmatic cAMP and cGMP levels of rats (, n=3)
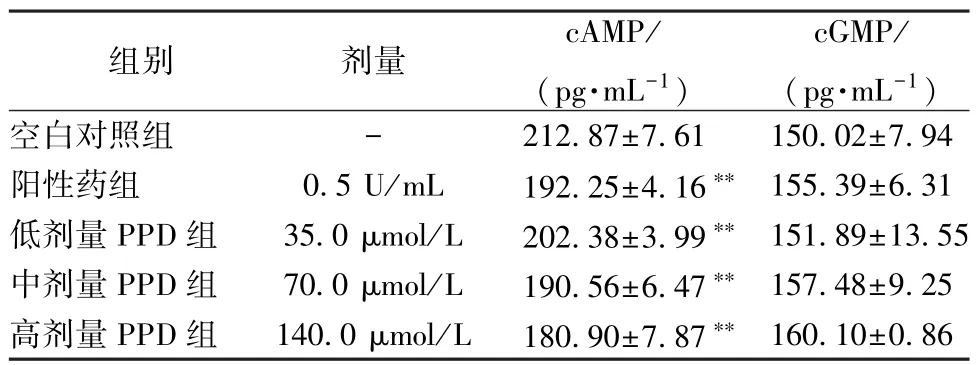
表6 PPD 对大鼠血浆cAMP 和cGMP 水平的作用(,n=3)Tab.6 Effects of PPD on plasmatic cAMP and cGMP levels of rats (, n=3)
注:与空白对照组比较,**P<0.01。
2.5 PPD 促进血小板Ca2+内流 血小板胞质内游离Ca2+浓度的升高在血小板活化中起到重要作用[21],因此本实验进一步检测PPD 对血小板钙离子内流的作用。图1A 显示,随着PPD 对洗涤人血小板作用时间增加,血小板内[Ca2+]i增加,而凝血酶的作用比较强,加入瞬间就可以增加血小板内[Ca2+]i。图1B 显示,与溶剂对照组比较,140 μmol/L PPD 在5 min 时增加[Ca2+]i(P<0.05),随着作用时间增加,70、35 μmol/L PPD 分别在10、15 min 增加[Ca2+]i(P<0.05)。
2.6 PPD 对洗涤大鼠/人血小板聚集的影响 血小板聚集是指血小板之间相互黏着、聚集成团的现象,是血小板的主要功能之一,在生理性止血和病理性血栓形成中均占重要地位[22]。从表7 可以看出,与空白对照组比较,PPD 可增加洗涤大鼠/人血小板聚集并呈剂量依赖性,浓度大于35 μmol/L可增加大鼠血小板的聚集率;在浓度大于140 μmol/L时,PPD 对洗涤大鼠/人血小板的聚集率增加趋势均不明显;当浓度为140 μmol/L 时,大鼠血小板聚集度为40.43%,人血小板聚集度为28.25%。
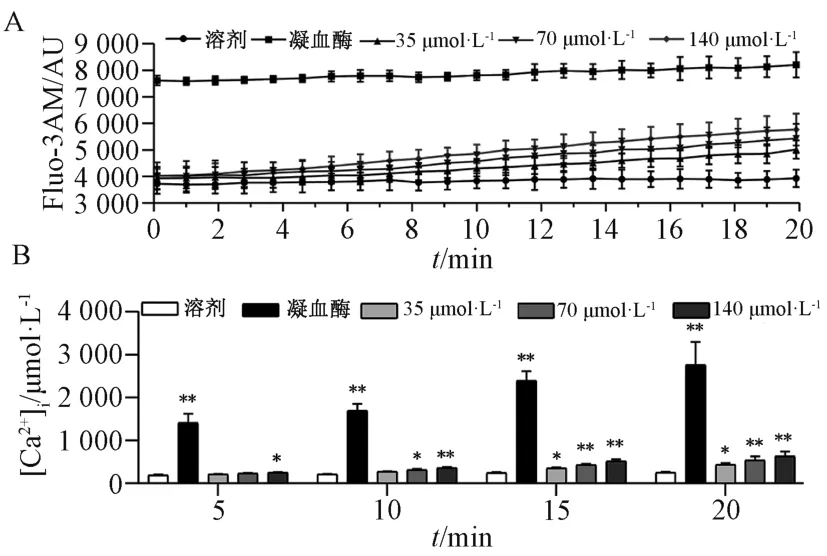
图1 PPD 对血小板内[Ca2+]i 浓度的作用Fig.1 Effect of PPD on the [Ca2+]i of platelets
表7 PPD 对洗涤血小板的聚集作用(, n=3)Tab.7 Aggregation effect of PPD on washing platelets (, n=3)
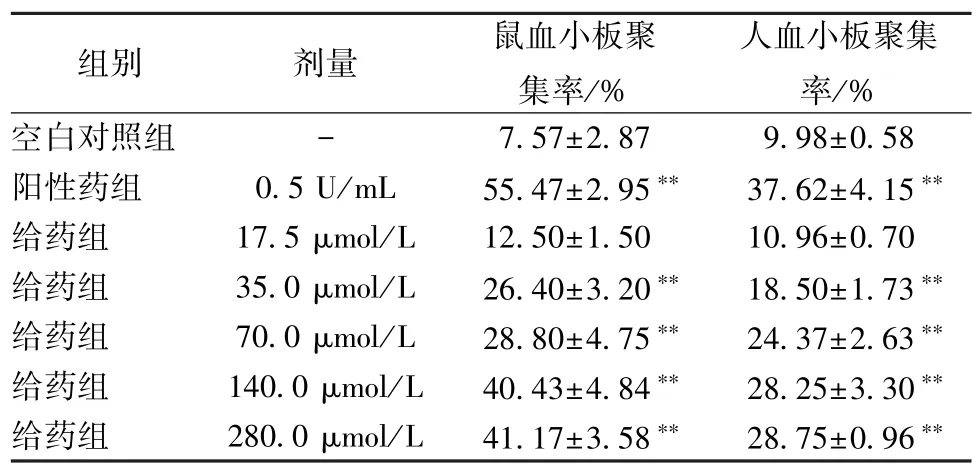
表7 PPD 对洗涤血小板的聚集作用(, n=3)Tab.7 Aggregation effect of PPD on washing platelets (, n=3)
注:与空白对照组比较,**P<0.01。
2.7 PPD 促进CD62P 表达 CD62P 存在于静息血小板的α 颗粒中;血小板活化时释放CD62P,参与血小板黏附、聚集等一系列反应。CD62P 是血小板活化的主要指标[23]。从图2B 可以看出,随着PPD 浓度增加,血小板CD62P 表达率增加;与空白组比较,PPD 浓度大于17.5 μmol/L 时能增加血小板CD62P 表达率(P<0.01);当PPD 浓度达到140 μmol/L 时,血小板 CD62P 表达率为81.90%,表达率与凝血酶作用相当。但图2A 显示,140 μmol/L PPD 作用明显弱于凝血酶。

图2 PPD 对血小板α 颗粒物质释放的作用Fig.2 Effect of PPD on α granule release of platelets
2.8 PPD 增加血小板PAC-1 的结合率 PAC-1 是血小板膜糖蛋白(GP) IIb/IIIa 复合物,血小板活化后构型会发生改变,PAC-1 是评价血小板活化的重要指标[24]。从图3 可以看出,随着PPD 浓度增加,血小板PAC-1 的结合率增加。与溶剂对照组比较,PPD 浓度大于17.5 μmol/L 时能增加血小板PAC-1 结合率;当PPD 浓度达到140 μmol/L 时,血小板PAC-1 结合率为90.40%,其作用与凝血酶的作用相当。

图3 PPD 对血小板PAC-1 结合率的作用Fig.3 Effect of PPD on PAC-1 binding rate of platelets
3 讨论
三七中原人参二醇型皂苷约占总皂苷的60%以上[25],其在体内经在酸、碱等条件下可水解脱去糖链,得到 20 (S) -原人参二醇皂苷元(PPD)[13-14],是重要的活性成分。本研究通过体内、体外实验发现原人参二醇具有止血作用并对其作用机制进行初步探讨。
小鼠断尾和肝脏划痕模型是筛选止血药物常用的模型[26-27],实验结果发现PPD 能抑制小鼠出血时间。通过检测大鼠的血常规,发现原人参二醇可提高PLT、PCT、红细胞参数中的RBC 和HCT,RBC 是止血过程中的重要参与者[28],而PCT 和HCT 升高与静脉血栓形成密切相关[29-30]。因此,以上体内实验结果显示PPD 通过增加PLT 和RBC数量,影响PCT 和HCT,参与止血过程。
凝血四项是研究药物参与内源性和外源性凝血途径的检测方法[31]。PT 和APPT 分别是外源性和内源性凝血系统常用的筛选实验;TT 反映凝血共同途径纤维蛋白原转变为纤维蛋白的所需时间;FIB 在凝血酶水解下最后形成不溶性的纤维蛋白,进而止血。本实验结果中PPD 可缩短APTT,增加FIB 的水平,表明PPD 可激活内源性凝血途径,促进FIB 生成,从而发挥止血作用。
cAMP 和cGMP 是调节血小板功能的抑制性细胞内第二信使,可诱导血小板聚集[32-33]。cAMP 水平与[Ca2+]i呈负相关[34],钙离子广泛参与血小板的活化过程,Ca2+的升高可改变血小板的形态,颗粒释放和GP-IIb/IIIa 活化[21]。本研究体外实验结果中PPD 能抑制血小板内cAMP 释放,促进血小板Ca2+内流;同时可直接诱导洗涤大鼠/人血小板聚集。以上结果表明PPD 通过抑制cAMP 释放,升高细胞内Ca2+水平,激活血小板,触发血小板的变形,并诱导血小板聚集而达到止血的作用。
CD62P 是细胞黏附分子选择素家族成员之一。血小板活化时CD62P 从α 颗粒中释放与血小板表面的胞膜融合,参与血小板黏附、聚集等一系列反应。PAC-1 是活化血小板上的GP Ⅱb/Ⅲa 复合物[24]。当血小板受到刺激时,血小板由膜内向膜外的信号转导引起血小板空间构型改变,形成活化的GPⅡb/Ⅲa 复合物,促进其与纤维蛋白原结合,引起纤维蛋白原构型改变[35]。CD62P 和PAC-1 是早期血小板活化最特异性的标志物[36]。结果显示PPD 能增加CD62P 释放和PAC-1 表达率,表明PPD 通过促进颗粒物质的释放、膜蛋白与血小板表面黏附以及GPⅡb/Ⅲa 复合物与纤维蛋白原结合,促进血小板聚集。
综上所述,PPD 可能是一方面通过激活大鼠的内源性凝血系统,影响体内血小板和红细胞参数,促进血浆中纤维蛋白原生成;另一方面通过影响钙离子和cAMP 信号通路,增加血小板Ca2+内流、CD62P 释放和促进PAC-1 的表达,诱导血小板聚集,达到止血的作用。本研究对PPD 的止血作用机制进行了初步的探讨,为三七药物的功效物质基础研究奠定基础。