离子液体[C14mim]BF4对大鼠的肝脏毒性
2021-03-25苑华飞田杏杏许峰葛月月魏海燕张蕤曹江宇徐红梅
苑华飞,田杏杏,许峰,葛月月,魏海燕,张蕤,曹江宇,徐红梅
合肥工业大学,食品与生物工程学院,药物科学与工程系,合肥 230009
离子液体(ionic liquids, ILs)是一种熔点低于100 ℃,在室温或接近室温下呈现液态,完全由阴离子、阳离子组成的有机盐[1-2]。相比于传统有机溶剂,ILs因具有溶解力强、热稳定性较高和不易挥发等优点,被广泛应用于化学合成[3]、萃取分离[4]和生物材料制备[5]等多个领域,曾一度被认为是挥发性有机溶剂的绿色替代品。然而,越来越多的研究表明,ILs并非完全绿色,由于其性质稳定,难以生物转化和降解,故易在环境或生物体内累积而产生危害[6-8]。因此,研究ILs对生物体的毒性及作用机制,评价其对生态环境的影响,对ILs的设计、合成、安全使用、减少环境污染以及维护生态平衡等,都具有深远的社会意义和重要的经济价值。
咪唑型ILs是近年来合成与研究最为广泛的ILs,对多种生物都有一定的毒性[9-13],国内外学者对其毒性机制也进行了有益的探索。Liu等[14]发现四氟硼酸化-1-丁基-3-甲基咪唑盐([Bmim]BF4)可使蚕豆幼苗体内抗氧化酶的活性发生显著变化,从而引发机体的氧化损伤。Zhang等[15]报道在急性暴露下,[Bmim]BF4会诱导斑马鱼体内细胞膜通透性增加,从而引起细胞内代谢紊乱与活性氧(reactive oxygen species, ROS)过量积累,继而引发脂质过氧化,导致肝脏损伤。本课题组在前期已对咪唑型ILs的毒性开展了相关研究,发现咪唑型ILs对小鼠的急性毒性随着烷基侧链长度的增加而增强,当烷基侧链长度为14时,毒性最强[16];进一步的研究显示[C14mim]BF4染毒可导致小鼠肝脏病变与损伤[17-18]。
尽管目前对ILs的毒性研究资料颇多,但多为考察ILs急性或亚急性染毒对生物体的影响,而有关ILs低剂量、长期染毒后,对生物体尤其是哺乳动物所产生的毒性及其作用机制的研究却十分匮乏[19]。因此,本实验在前期工作的基础上,选取[C14mim]BF4为研究对象,通过考察染毒大鼠体质量、脏体系数、组织形态学、肝功能指标和抗氧化酶活性等方面的变化,初步探讨了[C14mim]BF4对大鼠亚慢性染毒的肝毒性及其作用机理,以期为更加全面地评价ILs的毒性作用提供实验依据。
1 材料与方法(Materials and methods)
1.1 离子液体
咪唑型ILs [C14mim]BF4由中国科学院兰州化学物理研究所合成,纯度≥99%,其结构如图1所示。

图1 [C14mim]BF4的结构式Fig. 1 Structure of [C14mim]BF4
1.2 实验动物
健康SD大鼠40只(6周龄),雌、雄各半,体质量约为90~120 g,由安徽医科大学动物养殖中心提供,生产许可证为SCXK(皖)2019-001。大鼠饲养于标准动物房内(温度20~22 ℃、湿度65%~75%),自然光照,动物自由饮水、饮食。
1.3 主要试剂和仪器
生理盐水(0.9%氯化钠注射液)购自中国安徽丰原药业有限公司;甲醛为分析纯,购自中国上海振企化学试剂有限公司;无水乙醇为分析纯,购自中国上海中试化工总公司;活性氧(ROS)试剂盒购自中国碧云天生物技术有限公司;谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)试剂盒购自中国南京建成生物工程研究所有限公司。
电子天平(中国上海精密科学仪器有限公司,JA2004N);高速离心机(德国Thermo公司,CT14RD);冷冻切片机(德国Leica公司,RM2245);显微镜(日本Olympus日本,X71);紫外可见分光光度计(中国上海精密科学仪器有限公司,U1757CRT);酶标仪(美国Bio-Rad公司,680型);全自动生化分析仪(中国普朗医疗器械公司,PUZS-300)。
1.4 [C14mim]BF4溶液的配制
实验前,分别精密称取500、250和125 mg的[C14mim]BF4,各自溶于100 mL蒸馏水中,依次得到浓度为5、2.5和1.25 mg·mL-1的[C14mim]BF4溶液。
1.5 动物染毒及指标检测1.5.1 [C14mim]BF4对大鼠的亚慢性染毒
40只SD大鼠(雌雄各半)适应性饲养一周后,随机均分成5组。根据前期测得的半数致死量(LD50)值(249.8 mg·kg-1),设置3个染毒组(12.5、25和50 mg·kg-1)、1个染毒恢复组(50 mg·kg-1)和空白对照组。染毒组大鼠经口给予[C14mim]BF4染毒(1 mL药液/100 g体质量),每天1次,连续90 d,空白组的大鼠灌胃等容积的蒸馏水。染毒后逐日观察,记录各组大鼠的中毒反应,包括外观特征、活动状态和死亡数等,每周称量并记录大鼠体质量变化。染毒恢复组是指大鼠在停止染毒后,继续观察1个月,相关指标检测同染毒组。
1.5.2 脏器指数
末次染毒后,大鼠麻醉处死,立即解剖并分离其肝、肾、脾、肺和心脏,用预冷的生理盐水清洗血污,滤纸吸干水分,称量。根据测得的各器官质量,计算脏器指数。
1.5.3 组织病理学检查
将分离得到的各组大鼠的肝脏组织用10%甲醛溶液固定,采用不同浓度梯度的乙醇逐级脱水,石蜡包埋,切片机切片,脱蜡,HE染色,在显微镜下观察大鼠肝脏组织病理学变化。
1.5.4 肝功能指标的测定
末次染毒后,将大鼠麻醉,腹主动脉取血,静置30 min,3 500 r·min-1离心10 min,取血清;解剖后取新鲜肝脏,准确称取组织质量,按质量(g)∶体积(mL)=1∶9的比例加入9倍体积的生理盐水,冰水浴条件下,制备成10%的肝组织匀浆,2 500 r·min-1离心10 min,取上清,再用生理盐水稀释成最佳取样浓度。按照试剂盒说明书方法,分别检测血清和肝脏中ALT、AST和ALP的活性。
1.5.5 肝脏中CAT和SOD的测定
取大鼠新鲜肝组织,按照1.5.4的方法处理,使用试剂盒检测肝脏组织中CAT和SOD的活性。
1.5.6 肝脏ROS的测定
取大鼠新鲜肝脏组织,按照试剂盒说明书方法操作,研磨制备细胞悬液,200目尼龙网过滤,1 500 r·min-1离心10 min,加入磷酸缓冲液(PBS)重悬沉淀,细胞计数后加入DCFH-DA探针,37 ℃细胞培养箱内孵育20 min,在荧光显微镜下观察激发波长为495 nm的荧光;同时,在激发波长为490 nm,发射波长为540 nm的条件下,使用荧光酶标仪检测荧光强度。
1.6 数据统计与分析
2 结果(Results)
2.1 大鼠中毒体征观察
在染毒过程中,随着染毒时间的延长,大鼠毒性反应增强,表现为毛发枯涩、凌乱竖立,身体颤抖,兴奋等中毒症状。50 mg·kg-1组大鼠除具有上述症状外,还出现活动减少、精神萎靡不振、呼吸喘促和行走不稳等中毒症状。
2.2 [C14mim]BF4对大鼠体质量的影响
由图2可知大鼠体质量的变化趋势:与对照组相比,染毒早期(3~6周)大鼠体质量的增长量随着剂量的升高而降低(P<0.05);中期(6~9周)其体质量的增长量随着染毒剂量的增加而增大(P<0.05);而在染毒的后期(9~12周),大鼠体质量的增长量与正常组大鼠基本一致。
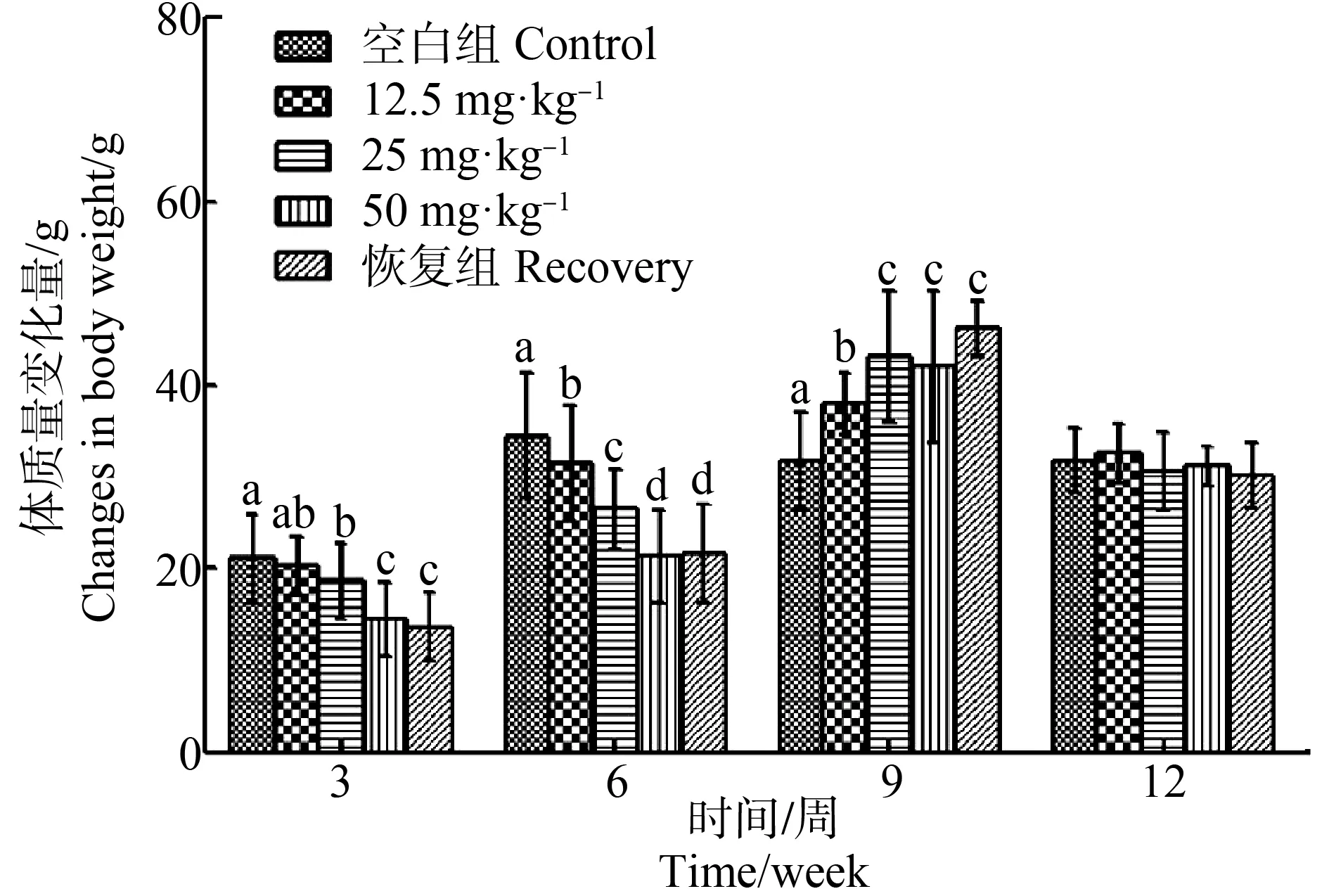
图2 [C14mim]BF4亚慢性染毒对大鼠体质量的影响Fig. 2 Effect of [C14mim]BF4 subchronic exposure on body weight of rats
2.3 [C14mim]BF4对大鼠脏器指数的影响
由表1所示,与对照组相比,[C14mim]BF4染毒对大鼠的心、肾和脾的脏器指数几乎无影响,但使其肝、肺的脏器指数略有升高;与50 mg·kg-1组相比,恢复组大鼠肝、肺的脏器指数略有下降;各组脏器指数间无统计学差异。
2.4 组织病理学检查
HE染色显示,对照组大鼠的肝细胞形态正常,肝细胞索排列整齐,肝小叶结构清晰(图3(a))。 [C14mim]BF4染毒后,随着剂量的增加,大鼠肝脏依次出现少量炎细胞浸润(图3(b))、肝细胞点状坏死及少量片状坏死(图3(c))、大量炎细胞浸润、脂肪空泡、桥接状坏死等病变(图3(d))。停止染毒一个月后,大鼠肝组织病变有所减轻,可见少量炎细胞浸润和双核细胞(图3(e))。上述结果表明,随着染毒剂量的增加,大鼠肝脏受损程度增强;停止染毒后,大鼠肝组织损伤程度有所减轻。
2.5 [C14mim]BF4对大鼠血清和肝脏中ALT、AST和ALP的影响
由图4可知,与对照组相比,各染毒组大鼠血清和肝脏中ALT、AST和ALP活性显著升高(P<0.05),且呈剂量依赖趋势;而恢复组大鼠在停止染毒一个月后,其血清和肝脏中ALT、AST和ALP活性均比50 mg·kg-1组明显降低(P<0.05)。上述结果显示,[C14mim]BF4对大鼠肝功能的损伤呈剂量相关性,染毒停止后,大鼠肝功能损伤有一定程度的恢复。
2.6 [C14mim]BF4对大鼠肝脏ROS的影响
如图5所示,[C14mim]BF4染毒组大鼠肝脏ROS荧光强度显著高于对照组(P<0.05),且呈剂量依赖性;而与50 mg·kg-1组相比,恢复组大鼠肝脏ROS荧光强度显著降低(P<0.05)。
2.7 [C14mim]BF4对大鼠肝脏中CAT和SOD的影响
如图6所示,[C14mim]BF4亚慢性染毒后,各组大鼠肝脏中抗氧化酶CAT和SOD的活性随着剂量的增加显著降低(P<0.05);而与50 mg·kg-1组相比,恢复组大鼠肝脏中CAT和SOD的活性则显著上升(P<0.05)。这表明[C14mim]BF4染毒可抑制大鼠肝脏抗氧化酶的活性,停止染毒30 d后,大鼠肝脏的抗氧化酶活性有所恢复。
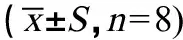
表1 [C14mim]BF4亚慢性染毒对大鼠脏器指数的影响Table 1 Effect of [C14mim]BF4 subchronic exposure on the ratio of viscera in rats n=8)
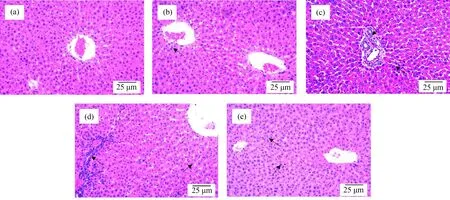
图3 大鼠肝组织病理切片(×100)注:(a) 对照组;(b)~(d) 分别为12.5 mg·kg-1、25 mg·kg-1和50 mg·kg-1组肝组织切片;(e) 恢复组。Fig. 3 Histology of livers from [C14mim]BF4-treated rats (×100)Note: (a) Control group; (b)~(d) Liver of rat treated with [C14mim]BF4 at dose of 12.5 mg·kg-1, 25 mg·kg-1 and 50 mg·kg-1, respectively; (e) Recovery group.

图4 [C14mim]BF4对大鼠血清和肝脏中谷丙转氨酶(ALT)、谷草转氨酶(AST)和碱性磷酸酶(ALP)活性的影响注:(a)~(c)分别为血清中ALT、AST和ALP活性;(d)~(e)分别为肝脏中ALT、AST和ALP活性。Fig. 4 Effects of [C14mim]BF4 on the activities of alanine aminotransferase (ALT), aspartate aminotransferase (AST) and alkaline phosphatase (ALP) in rat serum and liverNote: (a)~(c) The activities of ALT, AST and ALP in serum; (d)~(e) The activities of ALT, AST and ALP in liver.

图5 大鼠肝脏中活性氧(ROS)荧光图像和相对荧光强度(×100)注:(a) 对照组;(b)~(d) 分别为12.5 mg·kg-1、25 mg·kg-1和50 mg·kg-1组荧光图片;(e) 恢复组;(f) 相对荧光强度。Fig. 5 Fluorescence image and relative fluorescence intensity of reactive oxygen species (ROS) in rat liver (×100)Note: (a) Control group; (b)~(d) Liver of rat treated with [C14mim]BF4 at dose of 12.5 mg·kg-1, 25 mg·kg-1 and 50 mg·kg-1, respectively; (e) Recovery group; (f) Fluorescence intensity relative to Control.

图6 [C14mim]BF4对大鼠肝组织中(a)过氧化氢酶(CAT)和(b)超氧化物歧化酶(SOD)活性的影响Fig. 6 Effects of [C14mim]BF4 on the activities of (a) catalase (CAT) and (b) superoxide dismutase (SOD) in rat liver
3 讨论(Discussion)
咪唑型ILs因性质稳定易在环境中蓄积而产生危害[20],本课题组在前期开展了[C14mim]BF4对大鼠的急性毒性研究,发现其对大鼠的肝脏损伤最为严重。由于目前的研究多集中在对ILs的急性毒性研究,而有关ILs对哺乳动物的长期毒性及其作用机制仍知之甚少。因此,我们选取大鼠为实验对象,来探究[C14mim]BF4对哺乳动物的亚慢性毒性作用。
肝脏是机体解毒的主要器官,当受到外来有毒物质的侵袭时,肝脏可将有毒物质通过一系列代谢酶的作用转化为无毒或低毒物排出体外[21]。转氨酶在生物体的代谢过程中发挥着重要作用,并参与对环境应激的先天性免疫防御[22]。当肝细胞受损时,细胞膜通透性增加,ALT从细胞浆中流出;而当肝细胞受损严重或坏死时,线粒体中的AST也释放出来。因此,血清和肝脏中ALT、AST活性的变化能敏感地反映肝细胞的损伤程度。ALP主要来自于肝脏、骨骼和肠道,当胆道梗阻严重时,ALP活性显著升高[23]。相关研究表明,具有较长烷基链的ILs更易进入细胞,进而破坏细胞膜的结构[24-25]。已有研究表明ILs中毒可导致大鼠急性肝损伤,其特征是肝脏转氨酶持续升高和组织病理学改变[26]。本实验中,大鼠经口染毒[C14mim]BF490 d后,其血清和肝脏中ALT、AST和ALP活性均显著升高,表明[C14mim]BF4可能通过破坏肝细胞膜结构,使肝脏中代谢酶含量升高,产生毒性反应。组织病理学结果也显示,[C14mim]BF4染毒后,大鼠肝细胞膜结构受损,导致肝脏水肿,肝体指数增大,并伴有炎性细胞浸润。在恢复组中,肝功能标志物ALT、AST和ALP活性明显降低,肝脏损伤症状得到缓解,表明[C14mim]BF4诱导的肝损伤在停止暴露后,有一定程度的改善。

综上所述,离子液体[C14mim]BF4亚慢性染毒,可引起大鼠肝脏功能受损,其肝毒性可能与[C14mim]BF4诱发氧化应激,破坏肝脏抗氧化酶的活性有关。
