大型水生植物混合腐解对入湖河口水质的影响及适宜生物量研究
2021-03-25陈洪森魏伟伟蔡绪贻李春华
陈洪森, 魏伟伟, 叶 春, 蔡绪贻, 李春华
1.中国环境科学研究院,湖泊水污染治理与生态修复技术国家工程实验室, 北京 100012 2.中国地质大学(北京)水资源与环境学院, 北京 100083
在湖泊、河流等地表水生态修复中,大型水生植物的生态修复技术得到广泛应用并取得了良好效果[1-2]. 大型水生植物作为淡水生态系统的主要初级生产者[3],且在其生长期通过根、茎、叶等组织及根系生物膜的吸附、吸收和生长过程实现对水体和底泥中养分的吸收,可以降低水体中营养盐含量[4-7]. 然而,大型水生植物生物量过多将会加速湖泊沼泽化、堵塞航道甚至产生新的内源污染[8]. 因此,对大型水生植物生物量的管理成为富营养化水体治理面临的又一重要难题.
在大型水生植物生长过程中,生长期吸收储存营养盐,在衰亡期将通过腐解重新释放到水生态系统中造成水体的二次污染[9-10]. 国内外学者在水生植物腐解方面进行了大量的研究,植物腐解是一个受外界环境因子和自身特性双重影响的复杂过程[11-12]. 大型水生植物恢复的重要指标之一就是生物多样性,这也导致未收割的水生植物在自然腐解时是多种水生植物混合腐解,而前期研究主要集中在单种或2~3种大型水生植物腐解对水质的影响[9,11],而针对同一区域多种不同大型水生植物混合腐解的研究则鲜见报道. 探索多种水生植物混合腐解的规律和收割后水生植物的适宜生物量对维护恢复区水生态系统稳定,以及避免植物腐解导致的水质污染具有重要意义. 该研究选择蠡湖一典型入湖河口为研究对象,河口内生长的大型水生植物为人工种植后自然筛选的优势种,多年来植物大量生长使得该河口水质明显好转. 为避免冬春季植物腐解恶化水体的现象发生,通过探究不同收割比下多种混合大型水生植物在塑料大棚中的自然腐解过程,分析营养盐在泥-水-植物系统内的迁移转换规律,研究水生植物生物量与上覆水体及底泥中营养盐含量的相关性,判断腐解前的最佳保留生物量,以期为大型水生植物收割管理提供科学依据.
1 材料与方法
1.1 研究区概况
蠡湖是一个典型的城市湖泊,位于江苏省无锡市,出入湖河流众多,其中陆典桥浜河口水域相对开阔,风浪小且水动力弱,平均水深为1.2 m. 2016—2018年无锡市人民政府对该河口进行了大型水生植物恢复工程,其中挺水植物主要有芦苇(PhragmitesaustralisTrin.)、茭草(ZizanialatifoliaStapf.)、梭鱼草(PontederiacordataL.)、再力花(ThaliadealbataFraser.)、慈姑(SagittariasagittifoliaL.);漂浮植物主要有浮萍(LemnaminorL.)、水葫芦(EichhorniacrassipesSolms.);沉水植物主要有狐尾藻(MyriophyllumverticillatumL.).
1.2 试验设计
2018年11月调查蠡湖-陆典桥浜河口区水生植物生物量,各植物茎叶生物量(以鲜质量计)如下:芦苇4.8 kgm2、茭草1.21 kgm2、梭鱼草1.25 kgm2、再力花3.24 kgm2、慈姑0.46 kgm2、浮萍1.12 kgm2、水葫芦0.28 kgm2、狐尾藻0.24 kgm2. 挺水植物的茎叶生物量为水面10 cm以上部分,其他生活型植物为河口底泥以上部分. 每一试验组生物量即为假设一定比例收割后的剩余茎叶生物量,关于植物茎叶生物量的计算,若生物量设定40%,则为收割60%后的剩余部分,以此设定0%、20%、40%、60%、80%、100%共6个不同试验组. 因野外收割主要去除植物茎叶,根部仍旧留在原位,因此在添加腐解茎叶前,在每一试验组泥-水界面处布设同等质量的根,另设1组无植物根茎叶的空白组作为对照,每组3个平行. 各组茎叶生物量为每种植物在该组设定值下的累积和,即40%生物量等于以上每种植物40%茎叶生物量的总和(下文中生物量均指茎叶生物量),如图1所示.
1.3 试验样品采集及处理
2018年12月采集蠡湖-陆典桥浜河口内8种水生植物(芦苇、茭草、梭鱼草、再力花、慈姑、浮萍、水葫芦、狐尾藻)、底泥、水样带回实验室进行预处理,去除水样中漂浮的杂物和植物碎屑;使用彼得逊采泥器获取的底泥混合在一起搅拌均匀并去除石块、贝壳等;采集的植物清洗干净、剪碎成10 cm左右,放置于80目(0.180 mm)尼龙网袋中备用. 采用直径50 cm、高55 cm的塑料桶作为容器,将混合好的底泥平铺10 cm厚于桶底,加入水样,水深40 cm高,空白组和试验组共21个试验桶,静置一周. 设定100%生物量为A组、80%生物量为B组、60%生物量为C组、40%生物量为D组、20%生物量为E组、0%生物量为F组. 根据试验桶的顶表面积计算每组水生植物的添加量(以鲜质量计)依次为2.472、1.978、1.483、0.989、0.494、0 kg. 腐解试验用的植物根系为蠡湖-陆典桥浜河口区的优势种芦苇和茭草的根系,采集后清理剪断确保试验期内不再发芽. 根系添加量的计算方法与茎叶的相同,其质量比与蠡湖-陆典桥浜河口区的一致,在泥-水界面处插入0.186 kg茭草根(以鲜质量计)和0.223 kg芦苇根(以鲜质量计).
在透光非封闭塑料大棚(塑料只布设在大棚顶部)中开展试验,仅为试验提供挡雨功能,其他条件与野外近似. 试验时间为2018年12月25日—2019年5月25日,周期150 d,每10 d采集一次水样,30 d采集一次底泥样,并记录腐解过程中各水生植物形态的变化. 试验期间,因蒸发和取水损失的水量采用去离子水补给. 测定的水体水质指标包括水体温度(T)、ρ(DO)、pH、氧化还原电位(Eh)、ρ(CODMn)、ρ(TN)、ρ(TP)、ρ(NH4+-N)、ρ(NO3--N);底泥指标有w(TN)、w(TP)、w(TC)(TC为总碳),以及试验开始时添加的水生植物样品体内的氮、磷含量.
1.4 试验期间样品分析及数据处理
水样指标测定方法:水体温度和pH采用便携式pH计测定;水体ρ(DO)和Eh采用YSI DO200型溶解氧仪测定;ρ(TN)采用碱性过硫酸钾消解紫外分光光度法测定;ρ(NH4+-N)采用纳氏试剂光度法测定;ρ(NO3--N)采用紫外分光光度法;ρ(TP)采用钼酸铵分光光度法测定;ρ(CODMn)采用酸性高锰酸钾氧化法测定[13]. 将采集的水生植物茎叶样品用去离子水清洗干净放置烘箱中烘干至恒质量,采用奈氏比色法测定w(TN),采用钒钼黄比色法测定w(TN). 试验期间采集的沉积物底泥样品先放置在通风干燥处晾干,再碾碎过100目(0.150 mm)筛,并采用元素分析仪测定w(TC)和w(TN),采用消解-钼锑抗分光光度法测定w(TP)[14].
运用Excel软件整理试验数据,使用OriginPro 8.0软件绘制检测指标浓度变化图,用SPSS 22.0软件分析生物量与各水质指标之间的相关性.
2 结果与分析
2.1 水温及植物形态变化
温度是植物腐解过程中重要的外界环境因子,影响植物腐烂分解速率和改变上覆水体中植物茎叶的形态. 试验周期正处于太湖无锡地区的冬春季,自然腐解条件下水体温度变幅较大(见图2). 试验期间(2018年12月底至翌年2月初)水温逐渐降低,最低为5.3 ℃,2月中旬之后随着天气回暖,水温逐渐升高,最高达28.7 ℃. 观察水生植物在腐解过程中茎叶形态变化发现:①0~90 d内水葫芦、狐尾藻、慈姑、梭鱼草、浮萍5种植物发黄、断裂、腐烂逐渐沉入水底;茭草、芦苇、再力花的叶有明显发黄和部分断裂,其茎无明显变化;试验桶中上覆水体逐渐发黄变黑发臭. ②90~150 d内随着水温升高,生物量较少的C、D、E组,各水生植物逐渐全部沉入水底,水体透明度增高,D、E组清澈见底;A、B组由于生物量较多,部分植物茎叶沉入水底,水体发黑且透明度低. 从植物形态和上覆水体变化分析,NP较高的植物(见表1)有着更快的腐解速率,这与Valiela等[15]的研究结论一致.

图2 上覆水体温度随时间的变化Fig.2 Change of temperature in overlying water with time
表1 大型水生植物茎叶中氮、磷的平均含量及NP
Table 1 Average nitrogen and phosphorus contents of aquatic macrophytes′ stems and leaves
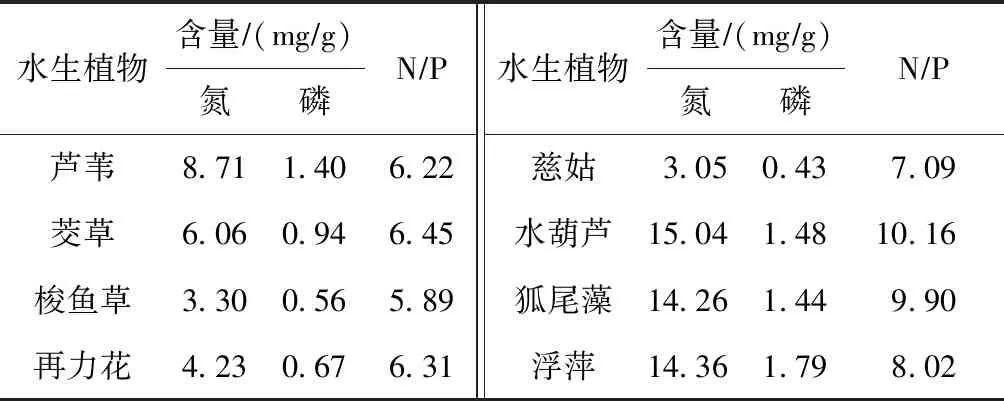
表1 大型水生植物茎叶中氮、磷的平均含量及NP
水生植物含量∕(mg∕g)氮磷N∕P水生植物含量∕(mg∕g)氮磷N∕P芦苇8.711.406.22慈姑3.050.437.09茭草6.060.946.45水葫芦15.041.4810.16梭鱼草3.300.565.89狐尾藻14.261.449.90再力花4.230.676.31浮萍14.361.798.02
2.2 上覆水体的理化指标变化
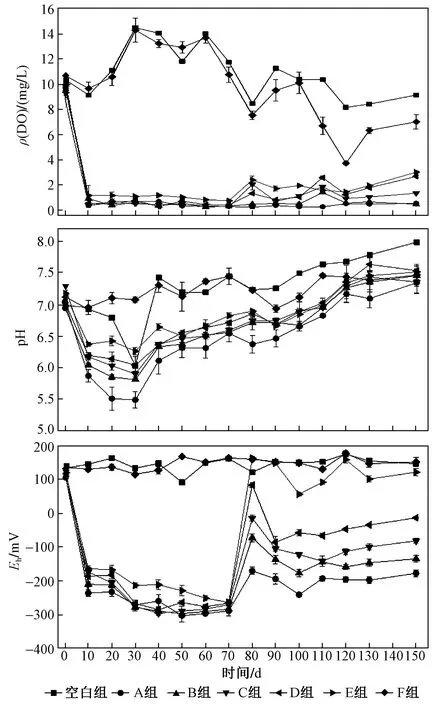
图3 上覆水体ρ(DO)、pH、Eh随时间的变化Fig.3 Change of ρ(DO), pH and Eh in overlying water with time
多种大型水生植物混合腐解过程中上覆水体的理化指标随时间的变化如图3所示. 试验初期,植物茎叶腐解消耗水中大量DO[16],上覆水体ρ(DO)迅速降低,A、B、C、D、E组ρ(DO)从试验初始的(9.72±1.03) mgL迅速降至(0.67±0.49) mgL,10~70 d持续缓慢降低,随着植物残体中有机物的逐渐腐解,试验桶内植物生物量不断降低,70 d后腐解耗氧量小于大气复氧量,ρ(DO)逐渐升高. 水生植物腐解初期,易淋溶物中包含大量有机酸,生物量越大浸出的有机酸浓度越高,pH从7.09±0.19逐渐降至30 d左右的最小值(5.9±0.41),随着有机酸逐渐分解完成,30 d后pH逐渐增高,120 d左右达到稳定(pH=7.28±0.14).Eh变化与ρ(DO)相似,试验初始Eh迅速下降且在10~70 d内达到(-275.3±14.5) mV,80 d左右A、B、C、D、E组均出现不同程度的增大后迅速降低,100 d后缓慢增加并趋于稳定. 与空白组相比,试验组DO、pH、Eh在腐解期间基本都低于空白组,这表明植物腐解会导致水体理化性质的显著变化. 通过相关性分析表明,生物量与ρ(DO)、pH、Eh均呈极显著负相关(P<0.01),相关系数分别为-0.558、-0.518、-0.631. 在整个试验前中期,F组水体的理化指标较空白组变化不明显,100 d后ρ(DO)、pH、Eh较空白组有所升高,这可能与试验后期水温升高植物根部发生腐解有关. 从各试验组结果来看,生物量对水体理化指标影响大致符合生物量越大、理化指标越差的规律.
2.3 泥-水-植物系统碳变化
CODMn作为表征水体有机物及可氧化无机物含量的重要指标,其值越高,表明水体有机物污染和可氧化无机物污染的状况越严重[17-18]. 试验期间,A、B、C、D、E组上覆水体ρ(CODMn)变化趋势相似,试验初期由于植物体内水溶性有机物不断浸出,ρ(CODMn)在0~20 d内迅速上升,由于温度降低导致20~40 d内有所缓慢下降,40~70 d内又再度上升至稳定,但上升速率较第1次有所减缓,各组在稳定期间的峰值依次为(24.41±0.34)(20.14±0.76)(17.71±1.26)(16.68±1.04)(11.40±0.73) mgL,100 d后逐渐降至稳定,依次为(18.5±1.12)(16.85±0.69)(15.31±0.96)(13.27±1.01)(9.53±0.37) mgL. 对比其他组与F组的变化可知,在整个植物腐解过程中,生物量对泥-水-植物系统中上覆水体有机物和无机物污染产生巨大影响,而泥-水界面处植物根部对水体水质影响较小且主要表现在试验后期水温升高,但增加了上覆水体中一定的有机物及可氧化无机物含量.
上覆水体ρ(CODMn)的变化牵动底泥中有机质含量,底泥w(TC)如图4所示. 由图4可见,试验初期植物腐解对底泥中w(TC)的影响较小,随着植物腐解作用加强,上覆水体含有大量有机物,加之泥-水-植物系统中微生物腐解作用有限,导致未能消耗的含碳物质向底泥中沉积,w(TC)在30 d后逐渐升高. 从试验组的对比来看,生物量对底泥w(TC)影响显著,且同时发现试验中后期水体温度升高促使底泥中w(TC)增长加快.

图4 上覆水体ρ(CODMn)及底泥w(TC)随时间的变化Fig.4 Change of ρ(CODMn) in overlying water and w(TC) in sediment with time
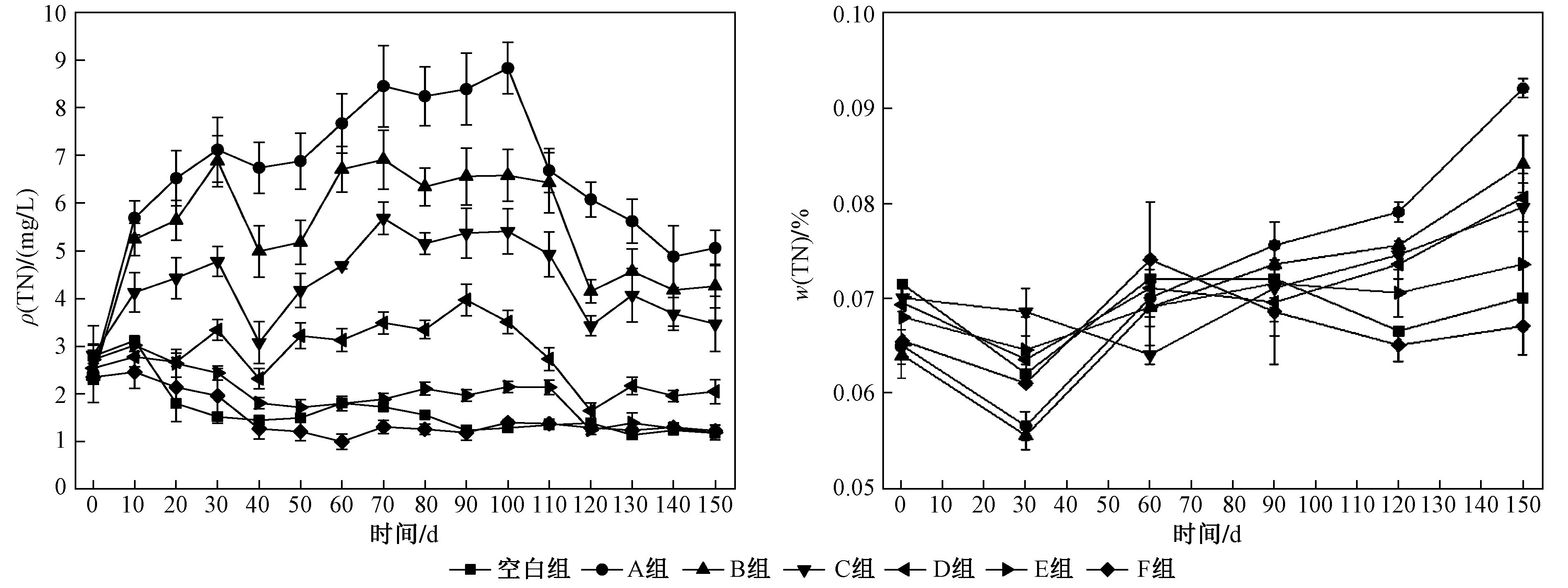
图5 上覆水体ρ(TN)及底泥w(TN)随时间的变化Fig.5 Change of total nitrogen concentration in overlying water and sediment with time
2.4 泥-水-植物系统氮变化
2.4.1上覆水体ρ(TN)及底泥w(TN)的变化
水生植物腐解改变了各试验组上覆水体ρ(TN)的变化(见图5). 由图5可见,A、B、C、D组上覆水体ρ(TN)在0~30 d内迅速持续升高,30~40 d内B、C、D组较A组出现迅速下降,40~70 d内持续升高直至达到峰值,各试验组在70~100 d内ρ(TN)依次为(8.47±0.36)(6.60±0.31)(5.40±0.28)(3.58±0.39)mgL,100 d后持续下降直至达到稳定,试验末期A、B、C、D组ρ(TN)分别稳定在4.97、4.22、3.57、2.01 mgL. 相较于空白组,试验初期E组ρ(TN)在10 d内升高,10~40 d内逐渐降低,后缓慢升高至80 d左右达到最大值,80~110 d内较为稳定,这一时期ρ(TN)为(2.09±0.12) mgL,110 d后逐渐降低直至稳定〔ρ(TN)为1.24 mgL〕. 试验F组相较于其他试验组在试验前中期变化不明显,90~120 d内缓慢升高后逐渐降低直至稳定〔ρ(TN)为1.27 mgL〕.
植物碎屑作为泥-水-植物系统氮源之一,上覆水体中氮会以不同形式向底泥和空气中迁移,改变底泥中氮含量. 底泥w(TN)的变化如图5所示,试验初期w(TN)在0~30 d内降低,30 d后持续升高,温度作为整个试验过程中主要的变化因素使得w(TN)在60~150 d内逐渐升高,试验末期各组底泥w(TN)表现为A组>B组>D组>C组>E组>F组,A~F组较试验初始分别升高41.5%、31.3%、13.6%、15.8%、8.1%和3.1%.
2.4.2上覆水体中不同形态氮浓度变化
NH4+-N和NO3--N是表征水体水质的两个重要指标,水体中不同形态氮在硝化细菌和氨化细菌的作用下频繁转化[19]. 上覆水体ρ(NH4+-N)和ρ(NO3--N)变化如图6所示:A、B、C、D组ρ(NH4+-N)在0~30 d内迅速持续升高,30~40 d内降低,40~70 d内持续升高直至峰值,100 d后逐渐降低直至稳定;A、B、C、D组ρ(NO3--N)在30~50 d内持续降低,50~70 d升高直至峰值,90 d后逐渐降低直至稳定;E、F组ρ(NH4+-N)在0~10 d内迅速升高直至峰值,10 d后持续缓慢下降,0~70 d内缓慢升高直至峰值,70 d逐渐降低直至稳定.
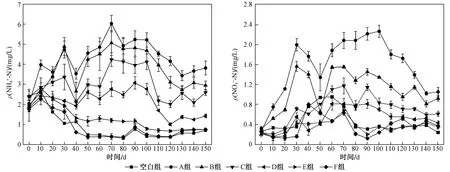
图6 上覆水体ρ(NH4+-N)及ρ(NO3--N)随时间的变化Fig.6 Change of NH4+-N and NO3--N concentrations in overlying water with time
从二者浓度变化曲线分析,上覆水体ρ(NO3--N)变化较ρ(NH4+-N)滞后,这可能是因为:①植物茎叶的快速腐解显著增加了上覆水体中各形态氮浓度. ②水溶性有机碳浓度的升高和水体中氨氮含量的增加为反硝化作用提供了额外的碳源和氮源,促进试验桶中硝化作用的发生[20],促使氨态氮向亚硝态氮、硝态氮转化,上覆水体ρ(NH4+-N)先升后降. 上覆水体中ρ(NO3--N)增加,一方面会促使反硝化细菌将硝态氮和亚硝态氮转化为含氮气体逸散至空气;另一方面由于底泥的吸附作用,氮素向底泥中迁移,最终降低ρ(NO3--N).
2.5 泥-水-植物系统磷变化
水生植物腐解过程中ρ(TP)如图7所示,A、B、C、D、E组在整个腐解过程中ρ(TP)的变化趋势相似. 试验桶内生物量越高,ρ(TP)变化波动越高,分析表明,生物量与ρ(TP)呈极显著正相关(P<0.01),相关系数为0.825.ρ(TP)在试验初期快速升高,10~40 d逐渐下降直至稳定,40~70 d再次上升直至达到峰值,各组较试验初期第10天时的峰值低且上升速度缓慢,70 d后逐渐降低直至稳定,各组在试验末期ρ(TP)依次为(0.734±0.08)(0.424±0.083)(0.24±0.013)(0.107±0.019)(0.067±0.009)mgL,较试验初始磷含量分别增加了32、15、10、4.7和3倍. F组在整个试验周期内变化不显著,相较于空白组,上覆水体ρ(TP)有一定程度上升,表明植物根部也发生腐解并对水质产生影响.
底泥w(TP)如图7所示,含磷物质在上覆水体和底泥之间发生明显迁移转化. 磷在泥-植物-水系统中的迁移转化过程较为复杂,包括含磷颗粒的沉降与再悬浮、溶解性磷的吸附与解吸,以及磷酸盐的沉淀和溶解等[21-22],这些都影响底泥中w(TP)变化. A、B、C、D组w(TP)在0~30 d内升高,30~60 d降低,60 d后持续升高,E、F组w(TP)在0~60 d内持续降低,60 d后逐渐升高,各组较试验初始磷含量分别增加了18.0%、21.4%、27.4%、9.3%、12.3%和3.9%,这表明混合植物腐解显著增加底泥中磷含量的积累,成为二次污染的潜在因素之一.

图7 上覆水体ρ(TP)及底泥w(TP)随时间的变化Fig.7 Change of total phosphorus concentration in overlying water and sediment with time
3 讨论
3.1 多种水生植物混合腐解的特点
大型水生植物腐解过程受多种因素的影响,一方面,各植物体内碳、氮、磷含量与其之间比值大小导致植物腐解速率快慢不同[23],同时植物体内纤维素、半纤维素和木质素含量也是影响植物腐解难易程度的重要因子[24];另一方面,外部环境(包括温度、水文特征、pH及养分可用性等)调节腐解活动,从而改变水生植物腐解率和腐解速率[23,25]. 在该研究中,为了解多种混合植物腐解特点,通过结合对比分析周林飞等[26]和叶春等[16]研究结果来探究多种大型水生植物在近自然条件下腐解的特征,前者研究单一沉水植物在自然气温变化下的腐解过程,后者探究单一沉水植物在特定恒温条件下的腐解变化. 首先,对比单一沉水植物在恒温和自然条件两种情况下的结果,恒温下,上覆水体养分浓度在7 d左右到达峰值,14 d后逐渐降低,40 d左右基本稳定;而自然条件下,上覆水体养分浓度在0~14 d内迅速升高,后随温度变化缓慢升高,40 d左右水体氮浓度达到峰值,此后受温度影响整体呈降低趋势,自然条件下植物腐解在第1、2阶段持续时间较恒温条件长. 其次,该研究中多种水生植物混合腐解结果表明,0~30 d内迅速升高,70 d左右达到峰值,100 d后缓慢降低,近自然条件下多种植物混合腐解的第1、2阶段时间较单一植物腐解长且持续变化,这表明多种水生植物混合腐解的第1、2阶段在某种程度上具有相对的持续性和长时间性. 笔者认为,多种植物混合腐解在一定程度上近似为多种单一植物腐解的叠加结果,各种植物因自身特性导致腐解速率不同而处于不同腐解阶段. 此外,Leppert等[27]研究表明,水生植物物种丰富度能够抑制植物茎叶的腐解,延长植物腐解时间.
3.2 生物量对混合植物腐解的影响
生物量是影响水生植物腐解对上覆水体理化性质、营养盐含量以及泥-水-植物系统营养物质迁移的重要因素之一. 水生植物腐解近似为植物生长的逆过程,在不加以管理下将生长期吸收的营养物质重新释放到上覆水体中,改变原有水体氮、磷和有机质含量,恶化水生态系统环境[26,28]. 试验初期大量植物茎叶腐解消耗水体中氧气和释放有机酸,水体ρ(DO)快速降低、呈弱酸性、Eh迅速下降. 随着腐解过程的进行,淋溶有机物中易腐解有机物在微生物作用下得到彻底腐解,水体中ρ(DO)在大气复氧下不断回升,pH逐渐升高至弱碱性,Eh逐渐升高. 从各理化因子变化曲线来看,在整个腐解过程中生物量越大,水体ρ(DO)越低,水体酸性就越强. 试验末期,在水体理化特征方面,20%生物量较0%生物量无显著差别,这表明泥-水-植物系统中存在少量的植物时,对上覆水体酸碱性、ρ(DO)情况的影响并不明显.
在泥-水-植物系统中,参与腐解的植物碎屑是水体营养盐的来源,而底泥既是吸收营养盐的汇也是释放营养的源[29],若系统中没有植物碎屑,上覆水体中各种形式的氮和磷将来自底泥的释放. 当存在植物腐解时,上覆水体中因植物腐解含有较高浓度的氮、磷,底泥通过吸附作用储存部分来自水中的氮、磷. 试验初期底泥营养盐释放大于吸收,底泥中氮、碳、磷含量降低,后期随着植物腐解,底泥成为泥-水-植物系统中营养盐汇集目标,此时以吸收储存为主,w(TN)、w(TP)、w(TC)升高. 相关性分析结果(见表2)表明,茎叶生物量与水体ρ(TN)和ρ(TP)均呈极显著正相关(P<0.01),上覆水体氮、磷含量主要受茎叶生物量的影响. 试验终末底泥营养盐含量受生物量影响,生物量越大的试验组迁移至底泥中营养盐含量也相对越多. 由图8可见,水生植物20%生物量较0%生物量对冬春季水体水质净化更为有利,当存在少量的植物茎叶时,可以抑制底泥中营养盐的释放和提供物质循环中植物生长的养分.

表2 生物量与各水质变量之间的相关关系
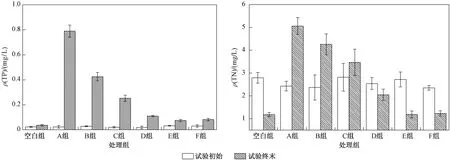
图8 试验初始和终末上覆水体ρ(TN)、ρ(TP)Fig.8 Total nitrogen and total phosphorus contents in overlying water at the beginning and end of the experiment
3.3 环境因子对植物腐解的影响
温度通过改变植物碎屑释放有机物和淋溶物质的速率,以及改变微生物活性来影响植物腐解速率[30]. Geraldes等[31]研究认为,温度较水生真菌种类或数量更影响植物腐解速率,较高的温度会增强化学反应和生物活性,改变水生丝孢菌种外酶的活性加速茎叶腐解. 整个试验期间处于无锡市冬春季节(12月—翌年5月),水体平均温度多数时间在20 ℃以下. 已有研究[32]表明,0~20 ℃对植物腐解速率较为明显,20 ℃以上对植物腐解影响不显著. 该研究中,30~70 d内水温异常快速变化导致上覆水体养分浓度在这期间先降后升,这一现象明显不同于恒温下植物腐解试验水质的变化特征,表明低温条件下一方面待腐解的植物茎叶碎屑以积累为主,减缓植物腐解速率;另一方面底泥和植物碎屑通过吸附作用,降低了上覆水体氮、磷的浓度;当温度升高时,微生物活性和化学反应增强,水体氮、磷浓度再次升高.
此外相关性分析结果(见表2)表明,理化性质指标〔ρ(DO)、Eh和pH)〕与营养盐含量呈极显著负相关(P<0.01). 水生植物腐解既影响上覆水体营养盐含量也改变了水体的理化性质,这些环境因子又将反作用于植物腐解而最终影响泥-水-植物系统营养盐含量变化. 在厌氧和弱酸性条件下,不同富营养程度水体中腐解植物茎叶损失量也发生不同变化,富营养程度越高,茎叶损失量越少[33]. 另外,酶在酸性水体中活性降低进而影响植物体内木质素和纤维素分解的快慢[34],使得植物在快腐解后水体营养盐含量处于峰值而居高不下. 试验桶水生植物经过第1阶段的腐解后,上覆水体ρ(DO)和Eh明显降低直至厌氧状态,且系统内微生物活动强度因环境因子变化而变化[35]. 低ρ(DO)将影响NH4+-N向NO3--N和NO2--N转化的过程,加快系统中反硝化作用.
4 结论
a) 多种水生植物混合腐解过程中上覆水体营养盐含量的变化与单一植物腐解产生的影响变化相似,经历植物腐解的3个阶段;在时间上,由于植物自身氮、磷含量及NP不同导致植物腐解快慢有所区别,近自然条件下,混合植物腐解较单一植物和恒温下植物腐解的第1、2阶段需要更长时间且具有持续性.
b) 在泥-水-植物系统中,泥和植物都是水体氮、磷的源,整个植物腐解过程中,植物不断释放营养盐,增加水体氮、磷、碳浓度. 底泥在试验初期以释放营养为主,30 d后以吸收为主,w(TC)和w(TN)升高,60 d后w(TP)升高,试验末期各组底泥中w(TC)、w(TN)和w(TP)较试验初期有不同程度的增加.
c) 相关性分析表明,生物量与上覆水体和底泥中营养盐含量均存在正相关关系,同时水体ρ(DO)、pH和Eh也会对植物腐解产生影响且与上覆水中营养盐含量呈极显著负相关. 根据试验初始和终末上覆水体营养盐的含量表明,剩余20%生物量组水质更好. 因此,与其他试验组相比,建议冬春季在蠡湖-陆典桥浜河口区保留20%水生植物茎叶生物量.
