基于群体效应研究双氢杨梅树皮素对金黄色葡萄球菌的体内抗菌作用*
2021-03-25洪正善王元霞曾春晖
洪正善 ,王元霞,杨 柯 ,曾春晖△
1 广西中医药大学,广西 南宁 530200;2 广西国际壮医医院
金黄色葡萄球菌(staphylococcus aureus,SA)是造成社区和医院获得性感染的常见病原菌,是导致人血液感染的主要原因,可感染各种器官从而引起感染性心内膜炎、化脓性关节炎和骨髓炎等[1]。SA 还能躲避宿主的免疫系统,对抗生素产生耐药性,影响疗效[2]。
细菌通过对环境中信号分子的感应而进行的一系列基因调控现象,称为群体效应(quorum sensing,QS),也称为自诱导[3]。细菌之间通过某些自身分泌的次级代谢产物作为信号分子,在细菌达到某个阈浓度时通过对这些信号分子的识别而产生一些基因表达,从而产生一系列生理变化[4]。目前认为 SA 内有两种 QS 系统——Agr 和LuxS/AI-2 系统 ,且这两个 QS 系统与 SA 的毒性和耐药性密切相关[5]。
藤茶[Ampelopsi grossedentata(Hand-Mazz)W.T.Wang]系葡萄科蛇葡萄属植物显齿蛇葡萄的嫩茎叶[6]。其化学成分主要是黄酮类化合物,而双氢杨梅树皮素(ampelopsim,APS)、杨梅树皮素及蛇葡萄素被认为是其中的主要活性成分[6]。前期研究[7]发现APS对SA、白色葡萄球菌、绿脓杆菌、大肠杆菌、白色念珠菌等均有极高的抗菌活性,APS可不同程度损害耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,MRSA)、SA 的细胞壁、细胞膜,漏出胞浆内容物,改变细菌形态[8]。
因此,本实验通过观察APS对标准SA NTCC8325及其QS 调控基因agrA 和luxS 缺失株腹腔感染小鼠的保护作用,研究藤茶提取物APS 通过QS 系统减少SA感染的作用。
1 材料与方法
1.1 实验菌株标准金黄色葡萄球菌NTCC8325标准株购于江苏晶美生物科技有限公司;金黄色葡萄球菌NTCC8325 的agrA 基因缺失株NTCC8325△agrA 和 luxS 基因缺失株 NTCC8325△luxS 由中国科技大学孙宝林教授提供。
1.2 主要药物和试剂APS 由广西中医药大学中药化学教研室提供,从藤茶茎叶中分离、纯化得到,为灰白色粉末,纯度≥98%,结构式如下:

二甲基亚砜(dimethyl sulfoxide,DMSO)(天津市富宇精细化工有限公司,批号:20171105);氯化三苯四氮唑(2,3,5-tripheny-ltetrazolium chloride,TTC;中国华东师范大学化工厂,批号:20101026);水解酪蛋白胨(mueller-hintonbroth,MH)肉汤(广东环凯微生物科技有限公司,批号:3105299);胰蛋白胨大豆肉汤(trypticase soy broth,TSB;广东环凯微生物科技有限公司,批号:310445);营养琼脂(北京陆桥技术有限责任公司,批号:100689);结晶紫试剂(西陇化工股份有限公司,批号:140115)。
1.3 主要仪器SW-CJ-1F 型洁净工作台(苏净集团苏州安泰空气技术有限公司);HVE-50 型高压灭菌锅(广州市深华生物技术有限公司);CDUPT 型纯水仪(成都越纯科技有限公司);SQP 型电子天平[赛多利斯科学仪器(北京)有限公司];Mini-15K 型高速离心机(杭州奥盛仪器有限公司);ST-360 型全波长酶标仪(Epoch Biotek 公司,美国);JJ200 型电子天平(常熟市双杰测试仪器厂);722N 型紫外可见分光光度计(上海仪电分析仪器有限公司);XW-80A 型涡旋振荡器(海门市其林贝尔仪器制造有限公司);Sysmex XT-2000i全自动血液分析仪(日本)。
1.4 实验动物昆明种小鼠,体质量18~22 g,雌雄兼半,购于湖南斯莱克景达实验动物有限公司,实验动物许可证号:SCVK(湘)2016-0002,实验动物合格证号:43004700040127。
1.5 实验方法
1.5.1 菌液配制 将标准SA NTCC8325 及agrA基因缺失株NTCC8325△agrA 接种在营养琼脂平板上,37℃培养过夜(≈12 h)。挑取活化后的单菌落接种于10 mL MH肉汤培养基中,37℃振摇过夜。
1.5.2 药物配置 每1 mg的APS加50 μL的DMSO助溶,之后用生理盐水稀释到所需浓度,再用0.22 μm的针式过滤器过滤除菌备用。
1.5.3 SA标准株及agrA基因缺失株的生长曲线制作 分别吸取活化的SA NTCC8325、NTCC8325△agrA和NTCC8325△luxS菌悬液50 μL至新鲜10 mL TSB 培养液混匀继续培养。分别于混匀后0、2、4、6、8、10、12、14、16、18、20、22 h 测A600值,同时测3次取平均值。将所得数据以时间为横坐标,A600值为纵坐标作图,得其生长曲线图,比较相邻时间点A600值的差值,得到细菌活力最强的时间点。
1.5.4 小鼠腹腔感染模型和灌胃给药 取130只昆明种小鼠,雌雄各半,随机分为空白组、NTCC8325模型组、NTCC8325△agrA模型组、NTCC8325△luxS模型组及 NTCC8325 APS、NTCC8325 △agrA APS、NTCC8325△-luxSAPS高(200mg/kg)、中(100mg/kg)、低(50 mg/kg)剂量组。小鼠预先灌胃给药,空白组及各模型组灌胃生理盐水,每天1次,连续7天,给药容量为20 mL/kg,第7 天灌胃1 h 后,每只小鼠腹腔注射培养至活力最强的受试菌0.5 mL(空白组注射无菌生理盐水)。
1.5.5 腹腔液活菌计数 造模4 h 后,无菌环境下眼球取血,然后颈椎脱臼处死小鼠,向小鼠腹腔注射5 mL 预冷的无菌PBS,抖动小鼠腹部使腹腔内白细胞充分游离,2 min 后小心吸取腹腔内液体,按等比稀释法稀释成 1×10-2、1×10-4、1×10-6倍数,分别于营养琼脂平板上涂布100 μL 稀释液,重复 3 次,37℃培养 24 h 后,选取菌落数 30~300 之间的培养皿,计算每毫升中菌落形成单位(cfu)。cfu=平均菌落数×稀释倍数×5。
1.5.6 感染小鼠血液白细胞分类计数 造模4 h后,小鼠眼球取血,在血液凝结前吸取100 μL 至装有100 μL 20 U/mL 肝素钠溶液中,充分混匀避免血凝块,进行白细胞分类计数。
1.6 统计学方法采用SPSS 11.5 统计软件处理数据,计量资料以()表示,采用单因素方差分析,组间多重比较采用LSD-t检验,检验水准为α=0.05。
2 结果
2.1 SA 标准株及agrA 基因缺失株的生长曲线NTCC8325 菌株在 10~12 h 之间OD 值增加最大,生长最快;NTCC8325△agrA 菌株在 12~14 h之间OD 值增加最大,生长最快;NTCC8325△luxS菌株在12~14 h 之间OD 值增加最大,生长最快。见图1、表1。
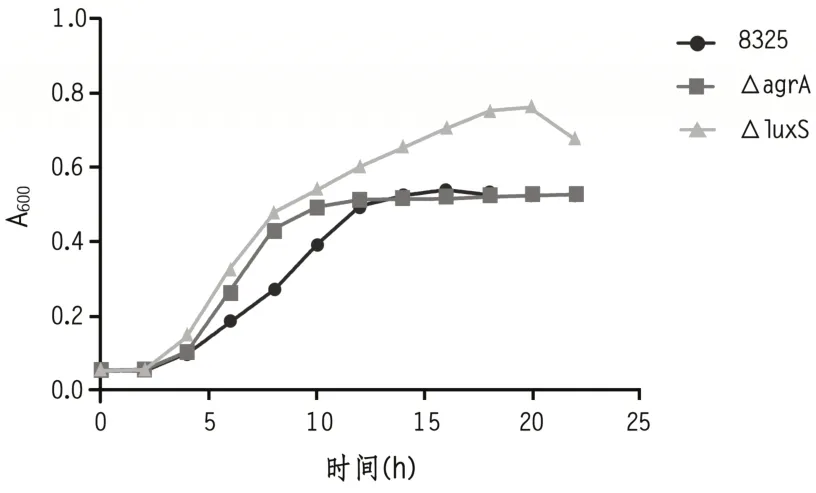
图1 SA NTCC8325、NTCC8325△agrA和NTCC8325△luxS的生长曲线

表1 菌液培养不同时间的OD值
NTCC8325 菌株 10~12 h OD 值从 0.145 增加到 0.457,增加了 0.209 个 OD 值;NTCC8325△agrA菌株 12~14 h OD 值从 0.247 增加到 0.461,增加了 0.214 个 OD 值。因此 ,11 h 左右 NTCC8325 的 OD值在0.145~0.457之间,此时菌株活力最强;13 h左右 NTCC8325△agrA 的 OD 值在 0.247~0.461 之间,此时菌株活力最强;13 h左右NTCC8325△luxS的OD值在0.248~0.468之间,此时菌株活力最强。
2.2 腹腔活菌数造模4 h 后,模型组小鼠腹腔液中的活菌数高于空白组(P<0.01);高剂量APS能减少NTCC8325 腹腔感染小鼠腹腔液中的活菌数(P<0.05),减少 NTCC8325△agrA 和 NTCC8325△luxS腹腔感染小鼠腹腔液中的活菌数(P<0.01);中剂量APS 能减少NTCC8325 和NTCC8325△luxS腹腔感染小鼠腹腔液中的活菌数(P<0.05),减少NTCC8325△agrA 腹腔感染小鼠腹腔液中的活菌数(P<0.01);低剂量APS 能减少NTCC8325△agrA腹腔感染小鼠腹腔液中的活菌数(P<0.05),能减少NTCC8325△luxS腹腔感染小鼠腹腔液中的活菌数(P<0.01)。高剂量APS灌胃后,NTCC8325△agrA和NTCC8325△luxS 腹腔感染小鼠腹腔液中的活菌数少于NTCC8325 腹腔感染小鼠腹腔液中的活菌数(P<0.05);中剂量APS灌胃后,NTCC8325△luxS腹腔感染小鼠腹腔液中的活菌数少于NTCC8325腹腔感染小鼠腹腔液中的活菌数(P<0.05);低剂量APS 灌胃后,NTCC8325△luxS 腹腔感染小鼠腹腔液中的活菌数少于NTCC8325 腹腔感染小鼠腹腔液中的活菌数(P<0.05)。见表2。
表2 各组小鼠腹腔液中活菌计数()

表2 各组小鼠腹腔液中活菌计数()
注:与空白组比较,*表示P<0.01;与同菌种的模型组比较,#表示P<0.05,##表示P<0.01;同一剂量组内与NTCC8325 组比较,△表示P<0.05,△△表示P<0.01;-表示等体积生理盐水
剂量(mg/kg)CFU(×105/mL)0.02±0.01 2.00±0.40*1.19±0.15*△1.96±0.29*1.12±0.49#1.12±0.16△0.82±0.11##△1.33±0.23##1.10±0.26 0.89±0.11##△1.59±0.03 0.93±0.14#1.03±0.17##△组别空白组鼠数10模型组10- -高剂量组10200中剂量组10100低剂量组NTCC8325 NTCC8325△agrA NTCC8325△luxS NTCC8325 NTCC8325△agrA NTCC8325△luxS NTCC8325 NTCC8325△agrA NTCC8325△luxS NTCC8325 NTCC8325△agrA NTCC8325△luxS 1050
2.3 小鼠腹腔白细胞分类计数
2.3.1 白细胞计数 造模4 h,模型组白细胞(white blood cell,WBC)数高于空白组(P<0.01);与同菌种的模型组比较,高剂量APS 能减少NTCC8325 和NTCC8325△luxS 腹腔感染小鼠血液中的白细胞(P<0.01),能降低NTCC8325 腹腔感染小鼠血液中的白细胞(P<0.05);中剂量APS 能减少NTCC8325△luxS 腹腔感染小鼠血液中的白细胞(P<0.01),能降低NTCC8325 腹腔感染小鼠血液中的白细胞(P<0.05);低剂量APS 能减少NTCC8325(P<0.05)。与同一剂量NTCC8325组比较,模型组NTCC8325△agrA 腹腔感染小鼠血液中的白细胞数低于NTCC8325 腹腔感染小鼠血液中的白细胞数(P<0.01);高剂量组中NTCC8325△agrA腹腔感染小鼠血液中的白细胞数低于NTCC8325腹腔感染小鼠血液中的白细胞数(P<0.05)。见表3。
表3 各组小鼠腹腔液中白细胞计数()
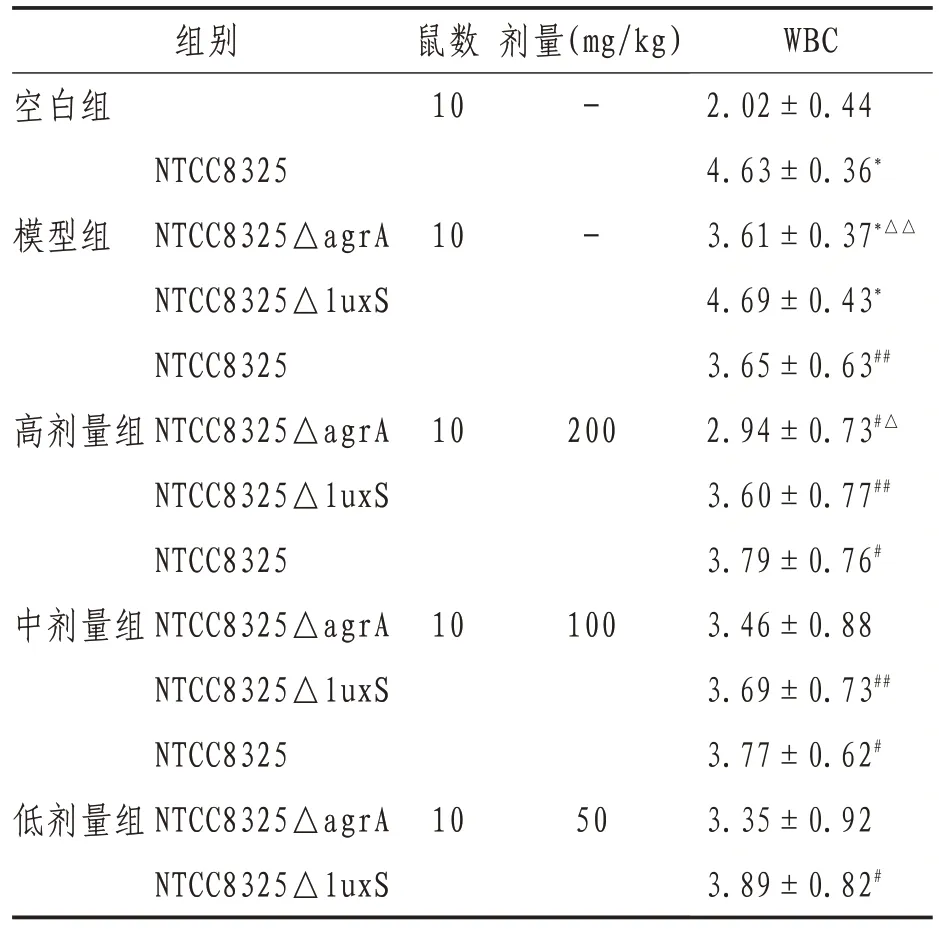
表3 各组小鼠腹腔液中白细胞计数()
注:与空白组比较,*表示P<0.01;与同菌种的模型组比较,#表示P<0.05,##表示P<0.01;同一剂量组内与NTCC8325 组比较,△表示P<0.05,△△表示P<0.01;-表示等体积生理盐水
剂量(mg/kg)组别空白组鼠数10 10- -模型组高剂量组NTCC8325 NTCC8325△agrA NTCC8325△luxS NTCC8325 NTCC8325△agrA NTCC8325△luxS NTCC8325 NTCC8325△agrA NTCC8325△luxS NTCC8325 NTCC8325△agrA NTCC8325△luxS 200 10 10中剂量组100 50低剂量组WBC 2.02±0.44 4.63±0.36*3.61±0.37*△△4.69±0.43*3.65±0.63##2.94±0.73#△3.60±0.77##3.79±0.76#3.46±0.88 3.69±0.73##3.77±0.62#3.35±0.92 3.89±0.82#10
2.3.2 中性粒细胞计数 造模4 h,模型组中性粒细胞(neutrophil,NEUT)数高于空白组(P<0.01);与同菌种模型组比较,高剂量APS 能减少NTCC8325△luxS 腹腔感染小鼠血液中的中性粒细胞(P<0.01),能降低NTCC8325 腹腔感染小鼠血液中的中性粒细胞(P<0.05);中剂量APS能减少NTCC8325△luxS 腹腔感染小鼠血液中的中性粒细胞(P<0.05)。与同一剂量的NTCC8325组比较,各菌种组间比较差异无统计学意义(P>0.05)。见表4。
表4 各组小鼠腹腔液中中性粒细胞计数()
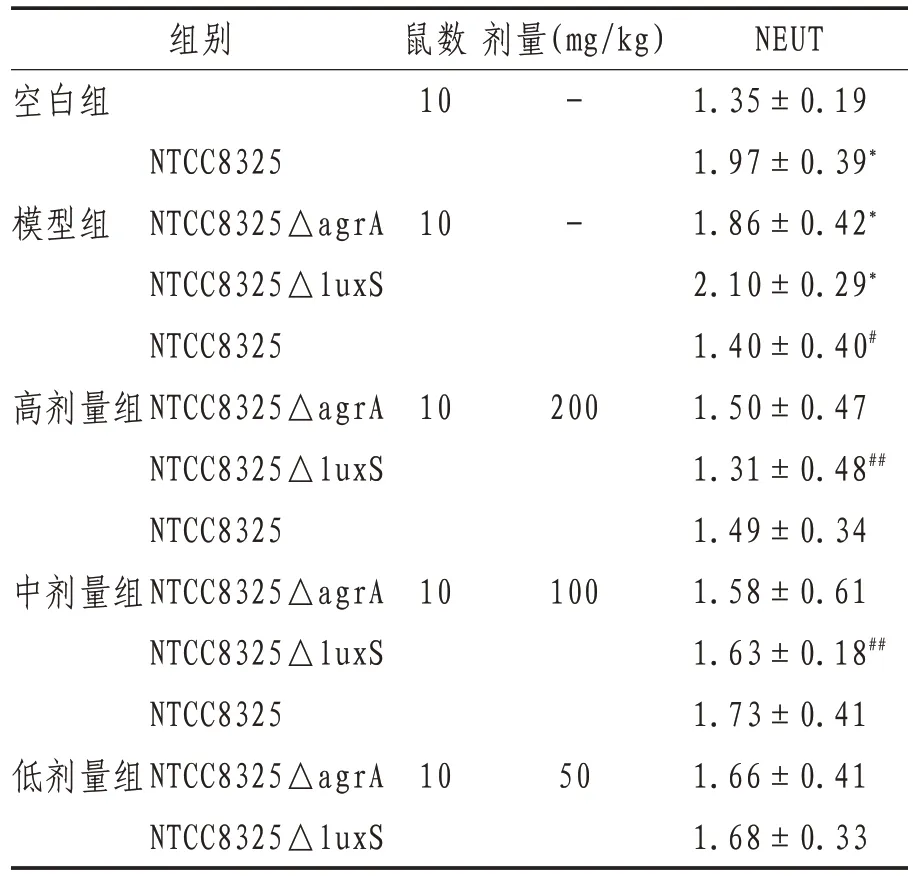
表4 各组小鼠腹腔液中中性粒细胞计数()
注:与空白组比较,*表示P<0.01;与同菌种的模型组比较,#表示P<0.05,##表示P<0.01;同一剂量组内与NTCC8325组比较,△表示P<0.05,△△表示P<0.01;-表示等体积生理盐水
NEUT 1.35±0.19 1.97±0.39*1.86±0.42*2.10±0.29*1.40±0.40#1.50±0.47 1.31±0.48##1.49±0.34 1.58±0.61 1.63±0.18##1.73±0.41 1.66±0.41 1.68±0.33组别空白组鼠数10剂量(mg/kg)模型组10- -高剂量组10200中剂量组10100低剂量组NTCC8325 NTCC8325△agrA NTCC8325△luxS NTCC8325 NTCC8325△agrA NTCC8325△luxS NTCC8325 NTCC8325△agrA NTCC8325△luxS NTCC8325 NTCC8325△agrA NTCC8325△luxS 1050
2.3.3 单核巨噬细胞计数 造模4 h,模型组单核巨噬细胞(mononuclear macrophages,MONO)数高于空白组(P<0.01);与同菌种模型组比较,高剂量 APS 能减少 NTCC8325 和 NTCC8325△luxS 腹腔感染小鼠血液中的单核巨噬细胞(P<0.05)。与同一剂量NTCC8325 组比较各菌种组间差异无统计学意义(P>0.05)。见表5。
表5 各组小鼠腹腔液中单核巨噬细胞计数()

表5 各组小鼠腹腔液中单核巨噬细胞计数()
注:与空白组比较,*表示P<0.01;与同菌种的模型组比较,#表示P<0.05,##表示P<0.01;同一剂量组内与NTCC8325 组比较,△表示P<0.05,△△表示P<0.01;-表示等体积生理盐水
MONO 0.34±0.06 0.70±0.23*0.53±0.09*0.56±0.18*0.46±0.10#0.42±0.07#0.49±0.25 0.51±0.15 0.66±0.11 0.44±0.15 0.56±0.21 0.56±0.21 0.48±0.05组别空白组鼠数10剂量(mg/kg)模型组10- -高剂量组10200中剂量组10100低剂量组NTCC8325 NTCC8325△agrA NTCC8325△luxS NTCC8325 NTCC8325△agrA NTCC8325△luxS NTCC8325 NTCC8325△agrA NTCC8325△luxS NTCC8325 NTCC8325△agrA NTCC8325△luxS 1050
3 讨论
在SA 中,agr QS 系统是一个全局调控子,对葡萄球菌属生物膜形成和许多外毒素的分泌有较大影响[9],agr 基因座大小为 3.5 kb,由 RNAⅡ和RNAⅢ两个不同的转录单位组成,他们分别由P2和 P3 启动子激活[10],在 QS 信号分子 AIPs 进入菌体内时,通过磷酸化AgrA,并结合RNAⅡ上的P2启动子区域和RNAⅢ上的P3 启动子区域,一方面通过影响 P2 与 P3 中间区域上的 sar 结合点[11],影响agr/sar双组分系统调控的SA的生物被膜形成通路,另一方面通过sarA 和RNAⅢ的激活,促进α-溶血素、肠毒素、纤维原结合蛋白、中毒性休克综合征毒素等外毒素的分泌[12]。lux QS 系统广泛分布于革兰氏阳性菌和革兰氏阴性菌,是多种细菌共通的QS 效应系统,影响生物被膜形成、毒素产生、致病因子表达等一系列细菌行为[13]。在SA中,lux QS 系统通过影响KdpDE 二元信号系统参与调控荚膜多糖合成酶基因的转录[9],同时通过影响icaR的转录水平减少SA生物被膜量[5]。
本实验发现,在缺失QS 调控基因agrA 和luxS 后,SA 生长至活力最强期所需时间延后,同时对小鼠的感染能力减弱,这可能因为QS 系统缺失后,生物被膜增厚,生物被膜解离减少,导致SA的生长和传播受到限制[14],此时APS 作用在难以扩散的生物被膜中,与标准株比较,能极大程度杀灭体内的细菌,减少体内活菌量,从而减弱炎症反应。同时,因为在SA中,lux系统的表达与细菌生长状态呈依赖性,随着菌落数增长,luxS 缺失株定殖作用更强,同时生物被膜的解离作用较弱,所以luxS 缺失株的生物被膜厚度可能并未增加太多,而此时luxS 缺失株的毒力因子分泌未受到明显影响,导致其更容易被体内免疫系统识别并吞噬,因此,luxS 缺失株感染小鼠体内的活菌数较少,白细胞数较多,此时灌胃APS后,APS进一步减少活菌数,降低体内白细胞数,减轻感染程度,说明APS 在体内通过作用agr 系统产生抗SA 作用。而在agrA 缺失株中,生物被膜厚度增加,毒力因子分泌减少,感染力较弱,体内免疫系统识别较少,因此,agrA 缺失株感染小鼠体内活菌数较多,白细胞数较少;此时灌胃APS 后,APS 进一步减少活菌数,降低体内白细胞数,减轻感染程度,说明APS 在体内通过作用lux 系统产生抗SA 作用。进一步观察发现,给药APS后,luxS缺失株感染小鼠体内的活菌数减少的趋势较agrA 缺失株感染小鼠体内活菌数减少趋势明显,因此推测APS 在体内通过直接影响agr系统及间接影响lux系统,从而协同产生抗SA作用。
