麒麟尾组培苗繁殖生产技术
2021-03-25傅海平陈生龙谢小坚
傅海平 陈生龙 江 南 谢小坚 韦 晴
(1.东莞市农业科学研究中心,广东 东莞 523000;2.东莞市讯禾园艺科技有限公司,广东 东莞 523000)
麒麟尾(Epipremnumpinnatum)属天南星科多年生常绿藤本观叶植物,原产我国南部的广东、广西、海南等省(自治区)及东南亚等地。麒麟尾叶长卵心形,叶绿且富有光泽,成熟叶为羽裂状,易攀爬,其因特殊的品种特性近年来被广泛用于垂直绿化。
扦插繁殖是麒麟尾繁殖方法中的一种,但扦插繁殖量少,整齐度不好,不能满足市场需求。组培法是短期内快速繁殖大批量种苗的方法,不受气候季节等影响。关于麒麟尾组织培养的研究报道不多,有研究为了品种的进一步推广繁殖,用TDZ诱导丛生芽[1]。本试验用6-BA对麒麟尾进行愈伤组织及丛生芽诱导、小苗温室驯化研究,以期为品种规模化生产寻找良好的方法。
1 材料与方法
1.1 试验材料
选取生长良好的麒麟尾盆栽,品种来源于广东省东莞市讯禾园艺科技有限公司。先用农地乐1 000倍液灌根处理,灭除基质中的虫卵;再干水处理;待三四天水分完全干后,选一年生无病虫害的健壮顶芽作外植体,切5~6 cm的带顶芽茎秆(见图1)。

图1 麒麟尾消毒后的顶芽
1.2 方法
1.2.1 外植体处理。对新剪切的麒麟尾取其顶芽,放到净水中用毛笔轻刷干净,放在流动的自来水中冲洗0.5h。用无菌水冲洗茎段3次后用75%乙醇消毒10 s,再用无菌水冲洗两三次,用0.1%氧化汞消毒8 min,最后用无菌水冲洗5~7次(以上每次无菌水冲洗时分别手摇1 min),用无菌滤纸吸干表面的水分。在超净工作台上用手术刀片将消毒后的茎切成2~3 cm小段[2-3]。
1.2.2 愈伤组织诱导。以MS为基本培养基,共设计了4种培养基用于麒麟尾外植体愈伤组织的诱导,分别为C1,MS+6-BA2.0 mg/L+IBA0.2 mg/L;C2,MS+6-BA3.0 mg/L+IBA0.2 mg/L;C3:MS+6-BA4.0 mg/L+IBA0.2 mg/L;C4:MS+6-BA5.0 mg/L+IBA0.2 mg/L;所有培养基的pH值均为5.8~6.0,每个配方加蔗糖30 g/L、卡拉胶5 g/L。共接20瓶,每瓶接种1个茎段,试验重复3次。接种后放入培养室中进行培养,前7 d暗培养,7 d后光照培养,光照度为40~50μmoL/(m·s),光照时间为12h/d,培养温度(25±2)℃[4-6]。调查愈伤组织诱导率。
1.2.3 不定芽诱导和继代。挑选直径在1 cm左右的带芽小块,转入4种不同的分化培养基中。对芽直径大于2.5 mm的粗芽按2~4芽/团进行切割,并采用对剖方式破坏其生长点,若新芽抽出长度大于20 mm,去顶;对芽直径小于或等于2 mm的细小芽,以8~10 mm的团块直径进行切割,将切割好的芽团接种于不同培养基中进行扩繁培养。
不定芽增殖培养基为B1,MS+6-BA1.0 mg/L+NAA0.5 mg/L;B2,MS+6-BA1.5 mg/L+NAA0.5 mg/L;B3,MS+6-BA2.0mg/L+NAA0.mg/L;B4,MS+6-BA2.5 mg/L+NAA0.5 mg/L,生根培养基为MS+NAA0.5 mg/L+1%活性炭+蔗糖30g/L+卡拉胶5.4g/L。在光照条件下培养,光照度为40~50μmoL/(m·s),光照时间为12h/d,温度(25±2)℃。
1.2.4 麒麟尾组培苗移栽。当生根培养的瓶苗长至2.5~3.0 cm时,用自来水洗净根部的培养基后放于1 000倍多菌灵消毒液中浸泡30 s,移栽到装有不同基质[如按照m(细泥炭或泥炭)∶m(珍珠岩)=6∶1混合的基质或使用、国产泥炭]的穴盘中,每种处理1 000株。种植过程中大小分级,不要损害根系,前期每天早晚各喷水1次,温度控制在27~30℃。后期湿度可降低到60%左右,待新根长出后施肥1次。驯化7 d后逐渐撤去薄膜,30 d待新根长出后进行种苗正常管理并统计成活率。
2 结果与分析
2.1 外植体愈伤组织形成的过程
麒麟尾茎段质地坚硬,形成愈伤组织的时间相对较长。外植体接种30 d后开始观察愈伤组织的形成过程,结果如图2所示。接种30 d后,基部开始膨大,不同培养基均能诱导外植体产生愈伤组织,但只有部分茎段形成愈伤组织时,愈伤组织为白色,絮状且松软,围绕基部生长。60 d后,有的茎段基部开始形成丛生芽,如图3所示。部分茎段形成愈伤组织的同时也出现新芽,剔除愈伤组织后,部分茎段能肉眼看出新的细微芽点,为下一阶段形成丛生芽做准备。所以,培养30 d后外植体在不同培养基环境下部分茎段能产生少量愈伤组织,但不同培养基有不同的诱导反应。C3培养基愈伤诱导率达到48.3%,多于其他处理。C3是适合麒麟尾愈伤组织的诱导培养基(见表1)。虽然本研究外植体在适宜的培养基中均能产生愈伤组织,但是数量相对较少,愈伤组织松软、分散,不容易形成不定芽。为了获得良好、足够数量的芽,需将新芽点挑选出来进行分切,然后诱导丛生芽。另外,愈伤组织随着时间加长逐步褐化失去活性。本试验采用了幼嫩和老的茎段,经观察发现,新芽和老芽对愈伤组织及不定芽形成没有显著影响。

图2 外植体接种后30 d后的生长状态

图3 外植体接种后60 d后的生长状态
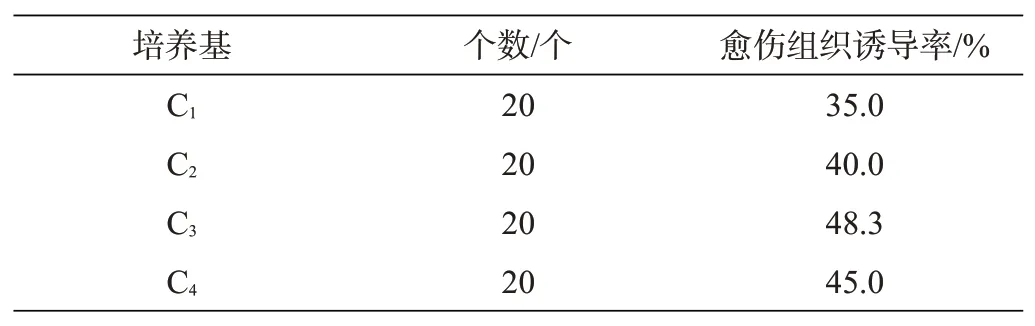
表1 不同激素梯度配比对愈伤组织诱导的效果
2.2 不同激素组合对不定芽诱导率的影响
研究表明,将剔除愈伤组织的芽点放置于培养基中培养30 d后,诱导的总芽数及不定芽是不同的。植物生长调节剂的种类及质量其浓度组合是调控外植体产生不定芽的主导因素。外植体接种在诱导培养基培养30 d后,基部开始膨大,60 d后形成不定芽,结果如表2所示。在不同种类和质量浓度植物生长调节剂的培养下,都能产生一定数量的不定芽,但对不同种类植物生长调节剂的反应不同。4种不同培养基培养后不定芽数量不一样。这些在培养基上再生的不定芽继续培养30 d后,再生了许多具有根和芽的小苗,B2培养基中不定芽诱导率高达275%,培养后的芽数最多(图4),说明此培养基适合麒麟尾不定芽的诱导。

表2 不同植物生长调节剂梯度配比对外植体不定芽诱导的效果

图4 麒麟尾丛生芽诱导
2.3 小苗的生根培养
小芽点在增殖培养后,产生了大量的不定芽,将芽分切成单株,在附加有1 mg/L 6-BA和1 mg/L NAA的MS培养基上培养1个月30 d后,再生了带有根和芽的小苗。当团块上的芽长度在15~20 mm,具有2片完整叶且叶片平展时,按单芽切割,将切下来的单芽接种到附带活性炭的培养基中,生根培养15 d后开始长根,42 d后长根率达到98%,具有3片叶且长势健壮,小苗叶片呈绿色。
2.4 组培苗温室驯化
麒麟尾组培生根苗转移到温室中经过自然光练苗5 d后,根系较多,茎秆直径大且呈直立状(图5)。麒麟尾组培生长速度慢,前期生长势相对较弱,生根后练苗很关键,能弥补前期不足。复壮后开袋种植,能显著提高成活率,节省后期育苗时间。温室管理着重水分调节,间干间湿能强化根系生长,待其长到一定程度后适当加强光照,使穴苗生长健壮、光亮,整个过程中注意通风保湿,全程做好细节管理,病虫害以防为主。经3种基质种植后,纯泥炭基质种出来的品质比较好,见表3。

图5 温室驯化苗

表3 不同基质组培苗移栽成活率
3 讨论
3.1 愈伤组织不易形成不定芽
麒麟尾选择外植体诱导时,取材部位对诱导影响较大,是后期组培成功的关键因素。因此,本试验选择一年生生长势旺、无病害植株顶芽做外植体。通过本诱导试验,发现添加不同质量浓度的6-BA对愈伤诱导有明显的差异,6-BA(4.0 mg/L)有利于愈伤组织的形成。高质量浓度植物生长能产生大量愈伤组织,但是植物生长调节剂偏高不利于后期培养,高植物生长调节剂易产生玻璃化,后期容易退化、形成石头苗等。本试验的愈伤组织在后期容易褐化,不能形成不定芽,和许渝花等研究的愈伤组织直接生成不定芽结论不一致[4-6],可能是在不同植物生长调节剂下有不同的效果。
3.2 1.5 mg/L6-BA有利于不定芽增殖
由于早期植物生长调节剂高质量浓度偏高,为了减少植物生长调节剂累积影响,在讯禾公司规模化生产中应用1.5 mg/L6-BA的诱导繁殖系数为1.40~2.75,是比较理想的培养基。该培养基高质量浓度适度即可保证一定的增殖率,又不至于使植株过早老化,是稳定生产的基础。不同植物生长调节剂及不同浓度对诱导有不同的效果[7-9],可以试验使用其余植物生长调节剂诱导。
3.3 麒麟尾品种性状比较特殊,苗期生长慢,组培成本相对较高
早期母本的选择和组培过程中及时转切可降低生产成本,切割过程中剔除老化、质量不好的芽和组织;转切时适当去顶有利于提高增殖系数,并及时挑出污染苗。当根系数量为两三条时转移到炼苗温室,经过自然光照射15 d后苗挺立,秆子粗壮,根系发达,保证后期温室驯化苗的品质。
4 结论
本试验以麒麟尾一年生盆栽顶芽为材料,筛选其诱导、增殖的最佳培养基,优化温室驯化方法,以规模化生产种苗为研究对象。麒麟尾的愈伤组织诱导率最高的培养基为MS+6-BA3.0 mg/L+IBA0.2 mg/L,MS+6-BA1.5 mg/L+NAA0.5 mg/L为不定芽增殖最佳培养基,增殖率275%,加之适度的光温条件,可生产出优质的组培苗,经自然光照炼苗后的组培苗移栽成活率达到98%。温室驯化以进口品氏泥炭(0~10#)为最佳种植基质,后期间干间湿、适度提高光照的生产养护管理能保证品质。通过麒麟尾组织培养和温室生产技术的研究,建立麒麟尾组培快繁体系,为麒麟尾工厂化生产提供可靠的技术支撑。
