射频消融治疗肝癌晚期复发的危险因素、模式和生存分析
2021-03-25陈毅杨伊冯对平樊庆胜周翔
陈毅 杨伊 冯对平 樊庆胜 周翔
肝癌是中国最常见的癌症之一[1,2]。肝细胞癌(hepatocellular carcinoma,HCC)占原发性肝癌的75.85%。肝癌的治疗取决于多种因素,包括疾病的分期、潜在的肝脏状况和患者的体能状态[3,4]。肝移植被认为是符合米兰标准(孤立性肿瘤5 cm 或3 个以上肿瘤3 cm,无肝外转移或大血管侵犯)[5]的HCC 的根治性治疗方法。然而,肝移植受到器官稀缺和成本高的限制,而手术切除也有限制性,如伴有肝硬化,肝储备差和门静脉高压不适合手术[6]。
对早期HCC(单个或不超过3 个,直径不超过3 cm 的肿瘤),如不能肝移植或手术切除,局部消融已被接受为一种替代疗法。既往研究报道[7],手术切除和消融治疗HCC 生存率相似。美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南也建议不可切除的肝细胞癌(大于5 cm)应该接受姑息治疗,包括动脉或全身治疗,因为对于5 cm 以上的HCC 消融治疗预后也相对较差[8]。射频消融术(radiofrequency ablation,RFA)是目前应用最广泛的消融技术,在符合米兰标准的肝癌患者中取得了良好效果[9-11],被认为是早期HCC 的一线治疗方法[9-14]。
然而,肝癌患者的长期生存率受到手术与射频消融后复发的限制[14,15]。基于时间分布,肝癌复发是分为早期复发(小于2 年)和晚期复发(大于2 年)[14]。早期复发与晚期复发的危险因素也有不同,多项研究报道早期复发的危险因素通常与原发肿瘤的生物学特征相关,如肿瘤的数量、肿瘤大小、分化程度、血清甲胎蛋白(alpha-fetoprotein,AFP)、白蛋白-胆红素(albumin-bilirubin,ALBI)值和是否血管侵犯[16-18]。相反,晚期复发HCC 发生在根治性术后2 年,这被认为是第二次新生癌变导致的[14-17]。
为此,笔者进行了肝癌RFA 晚期复发患者的危险因素、模式和生存的多中心回顾性研究。同时,建立诺谟图预测无复发生存(recurrence free survival,RFS),以帮助制定辅助治疗和预防策略。
资料与方法
1.病人的选择
本回顾性研究已获国家癌症中心、山西医科大学第一医院和北京中医院伦理批准。对于拒绝或不适合外科手术的患者,在诊断明确后行RFA治疗。目前的研究主要集中在RFA 后晚期复发,故排除早期复发患者或在治疗后2 年内死亡的患者[15]。收集2011 年1 月~2016 年12 月在国家癌症中心、山西医科大学第一医院和北京中医医院接受RFA 的患者。病例纳入标准如下:(1)按照欧洲肝脏病学会(European Association for the Study of the Liver,EASL),根据病理学或影像学诊断为肝癌[19];(2)体能评分:ECOG-PS 评分为0 或1;(3)单个肿瘤不超过5 cm 或不超过3 个肿瘤且不超过3 cm;(4)没有肝外转移或大血管侵犯;(5)肿瘤达到完全消融。排除标准如下:(1)早期复发;(2)2 年内由于任何原因死亡;(3)失访;(4)患者以前在其他中心接受RFA;(5)手术治疗后复发。
所有临床相关变量均在治疗前确定,根据以往的研究结果[20-22]收集包括年龄、性别、肿瘤大小、肿瘤数目、肿瘤位置、病因、抗病毒治疗、肝硬化、Child-Pugh 分级、白蛋白胆红素分级、血清甲胎蛋白、血清白蛋白(albumin,ALB)、天门冬氨酸转氨酶(asparatae amintransferease,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)、血清总胆红素(total bilirubin,TBil)和γ-谷氨酰转肽酶(γglutamyltranspeptidase,γ-GT)水平。主要血管包括有肝总动脉、门静脉的第一和第二支和下腔静脉[21]。不利位置定义为肿瘤边缘的位置距离重要结构小于0.5 cm,重要结构包括主要的血管,初级和二级肝内胆管、胆囊、膈肌、心包和胃肠道[21]。
2.RFA 过程
所有RFA 在CT 或超声引导下局麻进行,操作医生具有至少5 年RFA 治疗HCC 的经验。使用的电极类型和消融策略取决于肿瘤负荷、肿瘤形状、肿瘤位置等。进行扩大或重叠消融,使所有的肿瘤尽可能达到至少有0.5 cm 的安全边界[23-25]。当病灶位于不利的位置时,必要时在RFA 之前,制造人工胸腔积液或腹腔积液。最后进行针道消融,以避免肿瘤播散和出血。
3.随访
完全消融定义为消融边界大于0.5 cm 或消融后1 个月影像学检查未提示肿瘤残留。RFA 术后超声造影(contrast-enhanced ultrasound,CEUS)成像、磁共振成像或CT 增强扫描确定是否完全消融[23-27]。如有残余肿瘤,对残留肿瘤再次消融[28]。随访时间分别为RFA 后1、3、6、9 和12 个月,如无异常,之后每6 个月进行一次随访直至肿瘤复发或死亡,本研究最后随访日期为2019 年9 月30 日。慢性乙型肝炎病毒(hepatitis B virus,HBV)感染(乙肝表面抗原阳性)和HBV DNA 水平>1000 拷贝/毫升,口服抗病毒治疗拉米夫定,阿德福韦酯或恩替卡韦治疗[15,29]。丙型肝炎病毒(hepatitis C virus,HCV)感染,采用干扰素和利巴韦林的联合治疗[29,30]。RFS 定义 为RFA 治疗到肿瘤复发的时间,总生存期(overall survival,OS)定义为第一次RFA 治疗至任何原因导致死亡的时间。复发后采用多种方法治疗,其中包括外科手术、再次RFA、肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)或系统性疗法(索拉非 尼或FOLFOX4 方案化疗疗法)[6]。局部肿瘤复发(local tumor progression,LTP)定义为RFA 后肿瘤病灶边缘出现新发病灶[26,27]。肝内远处复发(intrahepatic distant recurrence,IDR)被定义为不同肝亚节段的新发肿瘤或同一肝亚节段不相邻区域的新发肿瘤[31-33]。肝外复发(extrahepatic recurrence,ER)被定义为肝外的新发病灶[26,27]。
4.统计学分析
分类变量以频率(百分比)表示,用Fisher 精确判别法或χ2进行比较。连续变量比较使用Mann-Whitney U 检验或t 检 验。Kaplan-Meier 曲线绘制OS 和RFS,采用Log-Rank 检验评估组间的差异。采用Cox 回归模型来确定RFS 的风险因素。P 值<0.05 被认为是有统计学意义。所有的统计分析都采用了R 软件进行分析3.6.2(http://www.r-project.org/)。
采用诺谟图对预测预后模型进行评价,计算一致性指数(C-index)。C 指数在0.5~1.0 之间变化,1.0 表示完美的预测结果。预测的3、4、5 年RFS 与观察的实际的RFS 进行比较。采用时间依懒性曲线(t-ROC)进行分析,计算t-ROC 曲线下面积(t-AUC)进行模型的预测能力的评价。
结果
1.病人特征分析
3 个中心的778 例HCC 患者接受了射频消融治疗。其中105 例因超出米兰标准被排除,42 例因没有完全消融被排除,197 例由于早期复发被排除,36 例随访死亡排除。最后,398 例被纳入,其中98 例(24.62%)晚期复发和300 例(75.38%)无复发。患者的基本数据见表1。两组患者的性别、肿瘤数量、最大的肿瘤直径、肝硬化、ALBI 级别有差别。患者选择和研究设计的流程图见图1。
2.晚期复发的危险因素
单因素和多因素Cox 回归分析确定了RFA术后晚期复发的临床危险因素,男性(HR:3.177,95%CI:1.181~8.540,P=0.022),多发性肿瘤(HR:4.374,95%CI:2.677~7.149,P<0.001),潜在的肝硬化(HR:4.321,95%CI:1.003~18.622,P=0.049)为晚期复发的独立危险因素(表2)。
3.晚期复发的模式
根据复发部位将晚期复发分为三种类型:LTP、IDR 和ER(图2a)。本研究发现了6 种晚期复发模式(图2b):单纯LTP(n=14)、IDR(n=43,43.88%)、ER(n=15)、IDR 与ER(n=17,17.35%)、LTP 与IDR(n=3,3.06%)、LTP 伴ER(n=6,6.12%)。超过60%的患者(n=60,61.22%)发展为IDR,而只有大约20%的患者(n=23,23.47%)发展为LTP。
4.晚期复发的治疗和生存分析
中位随访时间58.7 个月(范围:24.1~96.0),晚期无复发组死亡24 例,晚期复发组死亡28 例。在98 例晚期复发患者51 例(52.04%)接受积极的治疗,包括手术切除(9 例),再次RFA(42 例),而其余47 例(47.96%)接受姑息治疗,包括TACE(31 例),索拉非尼(11 例)和FOLFOX4 化疗(5 例)。晚期复发组的3 年、5 年和8 年OS 率分别为89.54%、76.15%、51.27%,晚期无复发组的3 年、5年和8 年OS 率分别为98.28%、92.07%和82.20%。累计OS 率晚期复发组明显低于晚期无复发组(P<0.001)(图3)。
5.诺谟图的构建和校准
基于多变量分析确定的独立危险因素(肿瘤数量、性别和肝硬化),构建诺谟图预测3 年、4 年和5 年的RFS(图4)。每个风险因素有一个得分,三个得分的总和位于总分轴上,对应显示对3 年、4 年和5 年RFS 概率的预测。
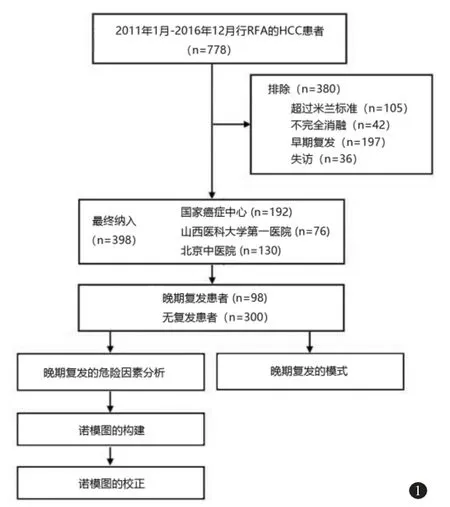
图1 病人的流程图
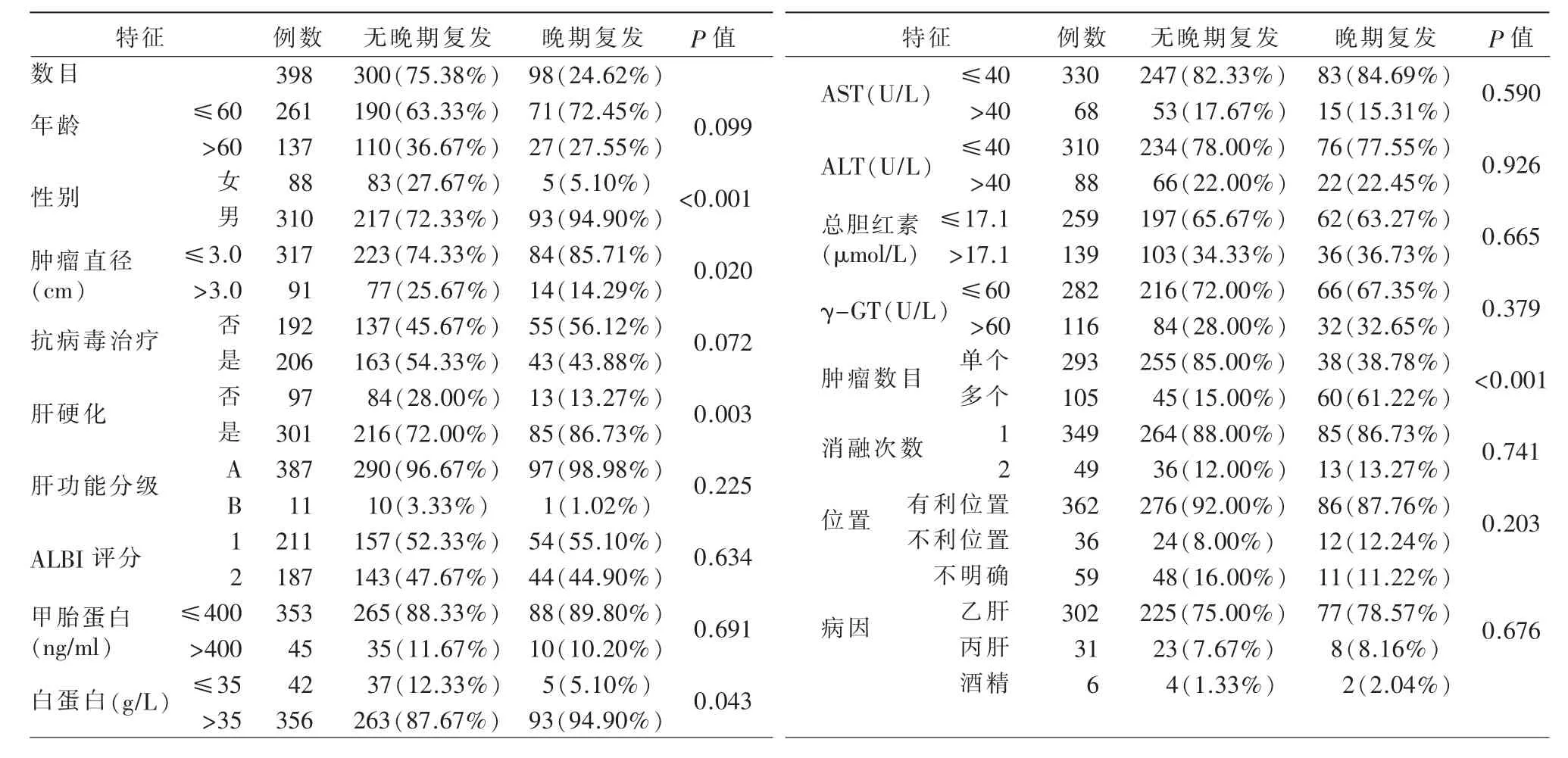
表1 病人基本特征
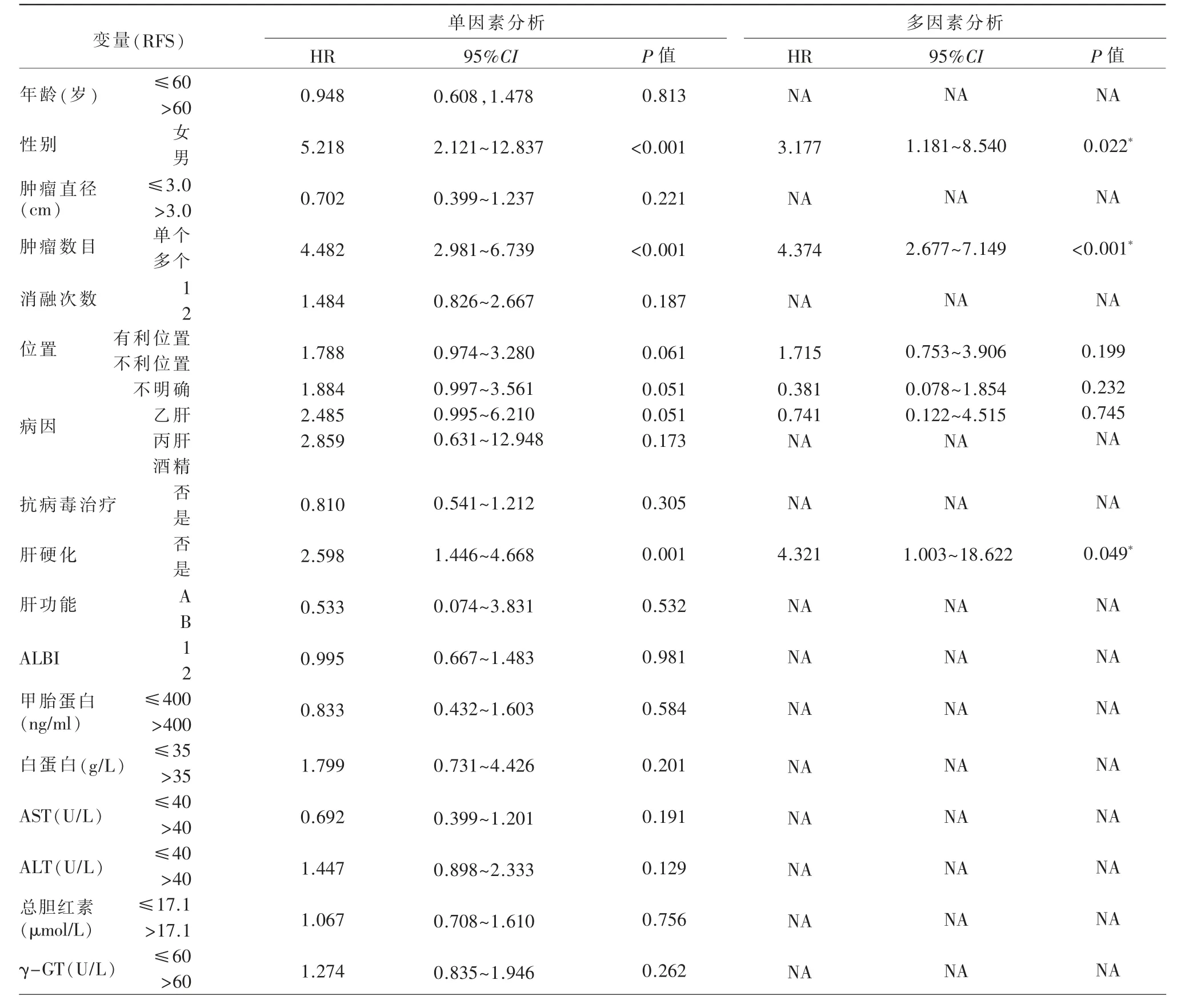
表2 晚期复发患者相关变量的Cox 回归分析
预测3 年、4 年和5 年RFS 概率诺谟图的c指数为0.763(95%CI:0.740~0.786)。预测3 年、4年和5 年RFS 的诺谟图的t-AUCs 为0.813(敏感度0.802,特异度0.748;图5),0.781(敏感度0.730,特异度0.785;图5b)和0.723(敏感度0.630,特异度0.784;图5)。3、4、5 年RFS 的校准曲线与45°参考线进行了理想匹配(图6),显示x 轴上的诺谟图预测RFS 概率与y 轴上实际的3、4、5 年RFS率之间的最佳一致性。
讨论
对于不能手术的患者来说,RFA 已被公认为治疗符合米兰标准肝癌患者的根治性治疗方法[14]。肝癌复发是影响RFA 术后的长期生存最重要的因素[14,15],识别早期和晚期复发的危险因素可以帮助改善RFA 术后的管理。尽管“早期复发”和“晚期复发”在临床和学术研究中很常见,但是目前仍然缺乏明确定义。最近的高质量临床研究采用了2 年作为鉴别早期和晚期复发的时间截点[14,15,34,35],研究者认为2 年是合理的,因为这能充分区分原发肿瘤的侵袭性生物学行为和肿瘤的新生癌变,也就更有利于确定晚期复发的危险因素[14,15,34,35]。
本研究发现,男性、多发性肿瘤、肝硬化是独立的晚期复发的危险因素,最常见晚期复发模式为单独的肝内远处复发(43 例,43.88%)。无晚期复发组与晚期复发组患者相比较OS 差别有统计学意义(P<0.001)。最后,根据危险因素,建立一个良好的、经过校准的诺谟图预测RFS。
在本研究中,男性(HR 为3.177,95% CI 为1.181~8.540,P=0.022),多发性肿瘤(HR 为4.374,95% CI 为2.677~7.149,P<0.001),肝硬化(HR 为4.321,95%CI 为1.003~18.622,P=0.049)是RFA 后晚期复发的独立危险因素。共60 例发生了肝内远处复发(61.22%),只有23 例为原位复发(23.47%)。既往研究[14,15,34,35]也认为肝切除术后晚期复发最可能的是新发肿瘤,特别是在肝炎和肝硬化背景下,与本研究的结果一致。
对于晚期复发来说,男性是一个独立的危险因素。以前的研究报道,由于性激素的影响,男性比女性患肝癌的几率更高[36-38]。此外,相比女性来讲,男性的晚期复发率较高,也可能由于新发的肝癌。研究[15,39]发现两种性别的复发率有显著差异,并提出男性需要更严格的术后随访和监测。有研究人员尝试使用性激素治疗肝癌,也取得令人鼓舞的结果[40,41]。
有研究已经证实了多个肿瘤数目是早期复发的重要危险因素[6,14]。在本研究中,多发性肿瘤(HR:3.766,95%CI:2.287~6.201,P<0.001)为影响晚期复发的独立风险因素,其结果与一项多中心研究一致[14],但与一些回顾性研究结果相反[16,34]。本研究中,肿瘤的大小不是影响晚期复发的危险因素,也有报道对于无血管侵犯的HCC 患者,肿瘤大小不影响生存率[42,43]。笔者认为,肿瘤大小是早期复发重要的危险因素,而不是晚期复发的,因为肿瘤大小可能导致消融不全而复发,当然还需要大样本的前瞻性研究来证实。
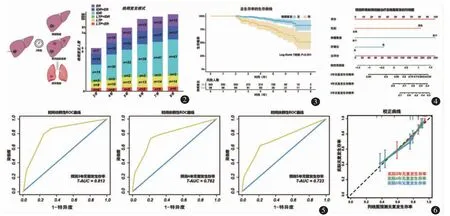
图2 复发模式图和本研究的主要复发模式 图3 伴有晚期复发和不伴有晚期复发的生存率比较,有明显的差异 图4 诺谟图预测3、4、5 年的RFA 术后的RFS 图5 诺谟图预测3、4、5 年RFS 的t-AUC 值 图6 诺谟图预测3、4、5 年RFS 的校正曲线
尽管大多数学者认为肝癌消融治疗的安全边界是5~10 mm,但是目前仍然证据不足[26,44]。以前的研究报道,消融的边界大于5 mm 可认为是消融成功的标准,原因是由于极低的LTP[23-25,45]。因此,现在大部分使用5 mm 作为安全边界,尽管有新证据表明消融幅度更大,如10 mm 时,LTP 的概率显著降低[46,47]。但是是否将采用10 mm 作为安全边界需要进一步证实。临床上诺谟图作为一种可视化的预测工具得到了广泛应用,主要用于预测各种类型肿瘤患者的预后。本研究根据RFA 后晚期复发的危险因素来构建诺谟图预测RFS,同时也证明了构建的诺谟图是可靠的预测模型。
本研究存在的局限性。(1)回顾性研究和有限的样本量会导致潜在的偏差。(2)大多数患者为乙肝病毒或丙肝病毒感染者,结果不能推论至其他人群(如西方国家的酒精性肝硬化)当中[36]。(3)研究结果还需要大规模的前瞻性研究验证。(4)使用2 年以区分早晚期复发仍有争议,需要进一步明确晚期复发的确切原因。
总之,初步结果表明男性、多个肿瘤灶、肝硬化是RFA 治疗肝癌晚期复发的独立危险因素。晚期复发发生率为25%,最常见的晚期复发模式为肝内远处复发,无晚期复发者生存期更长。
