甘蓝蔗糖合成酶基因家族鉴定及响应低温胁迫表达模式分析
2021-03-22张伟余方伟李建斌王神云
张伟 余方伟 李建斌 王神云


摘要:蔗糖合成酶(SUS)是植物蔗糖代谢的关键酶之一,它不仅影响植物的产量和品质,还在植物抵御逆境胁迫中起重要作用。基于已经公布的甘蓝全基因组数据信息,利用生物信息学方法对甘蓝BoSUS基因家族成员进行鉴定,分析其系统进化关系、染色体定位、基因结构、启动子顺式作用元件和低温胁迫下的表达模式。结果表明,甘蓝全基因组共鉴定到7个BoSUS基因成员,系统进化分析分成3个亚组(Ⅰ、Ⅱ、Ⅲ)。BoSUS蛋白氨基酸长度范围为805(BoSUS1a)~940(BoSUS6b)个,均是亲水性蛋白。在芸薹族特异的全基因组3倍化事件后,与拟南芥AtSUS4共线性的甘蓝BoSUS4基因发生了丢失,与AtSUS1、AtSUS6共线性的BoSUS1和BoSUS6基因均发生了扩张,出现了双拷贝(BoSUS1a、BoSUS1b和BoSUS6a、BoSUS6b)。表达模式分析表明,BoSUS1a、BoSUS1b和BoSUS3基因在甘藍不同器官/组织尤其在花器官的蔗糖代谢中起着重要作用,为库器官(花)的发育提供能量和物质。耐冷甘蓝CT-923叶片中BoSUS1a和BoSUS1b基因表达水平在低温处理6、24 h后相比对照急剧升高,BoSUS1a和BoSUS1b酶活性增强,为甘蓝产生保护性反馈机制提供能量,使得耐冷甘蓝CT-923耐寒性增强。综上所述,本研究为解析甘蓝BoSUS基因响应低温胁迫的分子机制和指导甘蓝耐寒种质资源创新具有重要意义。
关键词:甘蓝;低温胁迫;蔗糖合成酶;表达模式
中图分类号: S188文献标志码: A文章编号:1002-1302(2021)02-0024-09
收稿日期:2020-09-02
基金项目:国家自然科学基金(编号:31902009);国家大宗蔬菜产业技术体系建设专项(编号:CARS-23-G42);江苏省农业科技自主创新资金[编号:CX(18)2006]。
作者简介:张伟(1989—),男,安徽安庆人,博士,副研究员,主要从事甘蓝耐寒机理及育种研究。E-mail:zhangwei@jaas.ac.cn。
通信作者:王神云,硕士,研究员,主要从事甘蓝抗病、抗逆机理及遗传育种研究。E-mail:wangshenyun@jaas.ac.cn。
蔗糖合成酶(sucrose synthase,SUS,EC 2.4.1.13)通常被认为是一种胞质可溶性酶,分布在细胞质基质中,也广泛存在于膜系统和细胞壁。在大多数植物中,蔗糖是光合作用的主要产物之一,储存在库器官中的蔗糖不能被直接利用,须要通过SUS或蔗糖转化酶(invertase,INV,EC3.2.1.26)分解。SUS催化蔗糖和尿苷二磷酸(UDP)产生尿苷二磷酸葡萄糖(UDPG)和果糖,此反应可逆[1],水解的六碳糖参与细胞结构组成、物质贮藏和细胞新陈代谢等[2-3]。SUS还参与植物生长的多个代谢过程,包括蔗糖转运、淀粉与纤维素合成、生物及非生物逆境响应等[4-5]。
低温对蔬菜的危害一方面影响植物的外部形态,另一方面引发植物生理生化的强烈变化,导致减产和品质下降[6-7]。甘蓝(Brassica oleracea var. capitata L.)属于十字花科芸薹属甘蓝种中顶芽能形成叶球的变种,是我国一种重要的十字花科蔬菜,其营养丰富,适应性及抗逆性均较强,在全国各地普遍种植,在蔬菜供应中具有举足轻重的地位[8]。15~20 ℃为甘蓝最适宜结球的温度,但其生长受温度影响较大,早春易发生倒春寒现象,造成甘蓝的先期抽薹,或是温度低到超过甘蓝的耐受程度,幼苗直接冻死或叶球冻伤,严重影响甘蓝的产量。
在低温胁迫下,植物可溶性糖含量明显增加,作为渗透调节物质的可溶性糖主要有蔗糖、葡萄糖、果糖、半乳糖等,其含量与植物抗寒性之间呈正相关。Sasaki等提出甘蓝叶片中的可溶性糖含量与甘蓝的耐寒性密切相关[9]。王磊等的研究表明,在感受低温胁迫后,抗冻性强的甘蓝品种中可溶性糖含量上升幅度高于抗冻性差的品种;感受冻害低温后,可溶性糖含量下降,但抗冻性强的品种下降幅度小于抗冻性差的品种[10]。蔡青等的研究表明,在 -1 ℃ 低温条件下处理6 h,耐寒性强的甘蓝品种与耐寒性弱的品种叶片中可溶性糖含量存在显著性差异,且抗寒性强的品种可溶性糖含量上升幅度较大[11]。由此可见,经过低温锻炼的植株体内可溶性糖含量的增加使得作物耐寒能力增强,且在适应温度范围内耐寒性强的材料比耐寒性弱的材料含量高。
随着越来越多物种基因组测序的完成,SUS家族成员已经在拟南芥[12]、水稻[13]、玉米[14]、杨树[15]、大豆[16]等物种中被鉴定。不同物种的SUS家族成员存在较大差异,但蛋白序列保守性比较高,均具有蔗糖合成酶结构域和糖基转移酶结构域。研究表明,在低氧胁迫下,玉米根[1]和马铃薯块茎[17]中一些SUS亚型的表达被诱导或增强。抑制SUS基因的表达,会导致玉米[1]和棉花[18]的种子萎缩,马铃薯块茎[19]中淀粉积累减少。SUS家族成员间不同的表达模式表明它们在植物生长发育及胁迫响应中具有不同的生理功能。但是BoSUS基因在甘蓝中的全基因组鉴定以及如何响应低温胁迫均尚未可知。因此,鉴定分析甘蓝BoSUS家族成员具有重要意义。本研究对甘蓝进行全基因组BoSUS基因家族的鉴定,分析甘蓝BoSUS蛋白的进化历程、结构特征以及表达模式,探究甘蓝BoSUS基因在低温胁迫响应中的作用。
1材料与方法
1.1甘蓝BoSUS基因家族的鉴定
根据前人的报道从拟南芥TAIR数据库(http://www.arabidopsis.org/)下载了6条SUS蛋白序列(AtSUS1~AtSUS6)[12]。大白菜和甘蓝全基因组序列分别从BRAD数据库(http://brassicadb.org/brad/)和甘蓝基因组数据库(Bolbase,http://ocri-genomics.org/bolbase/)[20-21]下载获得。
为了在全基因组鉴定出甘蓝和白菜中的SUS基因序列,通过Pfam 31.0数据库(http://pfam.xfam.org/)获取蔗糖合成酶结构域(Sucrose_synth,PF00862)和糖基转移酶结构域(Glycos_transf_1,PF00534)的隐马尔科夫模型(HMM),利用hmmer(http://www.hmmer.org/)软件在全基因组数据库中搜索含有该结构域的序列,将仅含有PF00862和PF00534结构域的蛋白序列作为候选SUS基因家族候选序列。利用在线Pfam 31.0数据库、SMART数据库(http://smart.embl-heidelberg.de/)和Conserved Domain数据库(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi/)进一步验证SUS候选序列的保守结构域,最终确定目的SUS基因。甘蓝BoSUS和大白菜BrSUS基因的命名根据其与AtSUS1~AtSUS6序列的同源性及共线性关系并添加后缀(a、b、…)来命名。
1.2甘蓝BoSUS蛋白特征预测、系统发育和进化树分析
利用在线ProtParam工具(https://web.expasy.org/protparam/)对获得的甘蓝SUS蛋白质序列分子量、理论等电点、不稳定指数、脂肪族指数和亲水性平均系数进行分析。使用CELLO v2.5(http://cello.life.nctu.edu.tw/)和BaCelLo(http://gpcr2.biocomp.unibo.it/bacello/index.htm)进行亚细胞定位预测。利用Gene Structure Display Server(GSDS 2.0,http://gsds.gao-lab.org/)根据每个BoSUS基因组序列和相应的CDS序列绘制基因结构图[22]。利用MEGA 7.0对甘蓝BoSUS、拟南芥AtSUS和大白菜BrSUS蛋白质序列绘制系统进化树,采用邻接法(neighbor-joining,NJ),设置Bootstrap值为 1 000,其他参数保持默认值[23]。
1.3BoSUS基因的染色体定位、共线性及进化约束值(Ka/Ks)分析
根据甘蓝BoSUSs基因在染色体上的物理位置,使用MapChart 2.30[24]对BoSUSs基因进行染色体定位。利用BRAD数据库分析甘蓝和拟南芥之间的直系和旁系同源基因关系,利用TBtools[25]绘制共线性图。通过使用DnaSP 6计算同义替换率(Ks)、非同义替换率(Ka)和进化约束值(Ka/Ks)。使用公式T=Ks/2r计算同源基因之间的分化时间,双子叶植物中每个位点每年的同义替换率r=1.5×10-8[26]。
1.4甘蓝BoSUS基因启动子区域的顺式作用元件分析
利用在线软件New PLACE(https://sogo.dna.affrc.go.jp/)分析BoSUS成员起始密码子上游 1 500 bp 序列中ABRE(ABA-响应元)、ARE(厌氧诱导的顺式作用元件)、CGTCA-motif、GARE-motif、LTRE(低温响应元件)、TCA-元件和TGACG-motif等顺式作用元件。
1.5甘蓝BoSUS基因在不同器官/组织以及低温胁迫下的表达模式分析
为了分析甘蓝不同器官/组织中BoSUS基因的表达水平,在NCBI的GEO数据库下载甘蓝不同器官/组织(愈伤组织、根、茎、叶、芽、花和角果)转录组数据(登录号为GSE42891),以BoSUS基因的FPKM(fragments per kilobase per million mapped reads)值来表示甘蓝BoSUS在不同器官/组织中的表达水平,并绘制柱形图。
耐冷甘蓝923(CT-923)和冷敏甘蓝D9(CS-D9)的种子发芽后播种在无菌基质中,放在人工气候室中进行生长,环境条件设定为:白天25 ℃/夜晚18 ℃,光照14 h/黑暗10 h。为了开展低温胁迫处理,将5叶1心期的幼苗转移至春化室(4 ℃)处理,作为对照的幼苗仍处于正常条件下。在处理6、24 h后,分别对春化室和人工气候室的幼苗同时进行取样。对于每个甘蓝材料每个时间点的取样,至少选取18株幼苗,随机选取6株作为1个生物学重复(3个生物学重复),每株材料取顶部第3张完全展开叶,剪碎后放进锡箔纸在液氮中冷冻并储存在-80 ℃冰箱中。利用Trizol试剂(Invitrogen,USA)提取样品的总RNA,将获得的高纯度和完整性好的RNA用于RNA-Seq文库构建。构建好的24个RNA-Seq文库在Illumina HiSeqTM 2500平台上进行测序。根据RNA-Seq数据中获取的每个BoSUS基因的FPKM值来绘制柱形图。
2结果与分析
2.1甘蓝BoSUS基因家族的鉴定、系统发育和蛋白特征分析
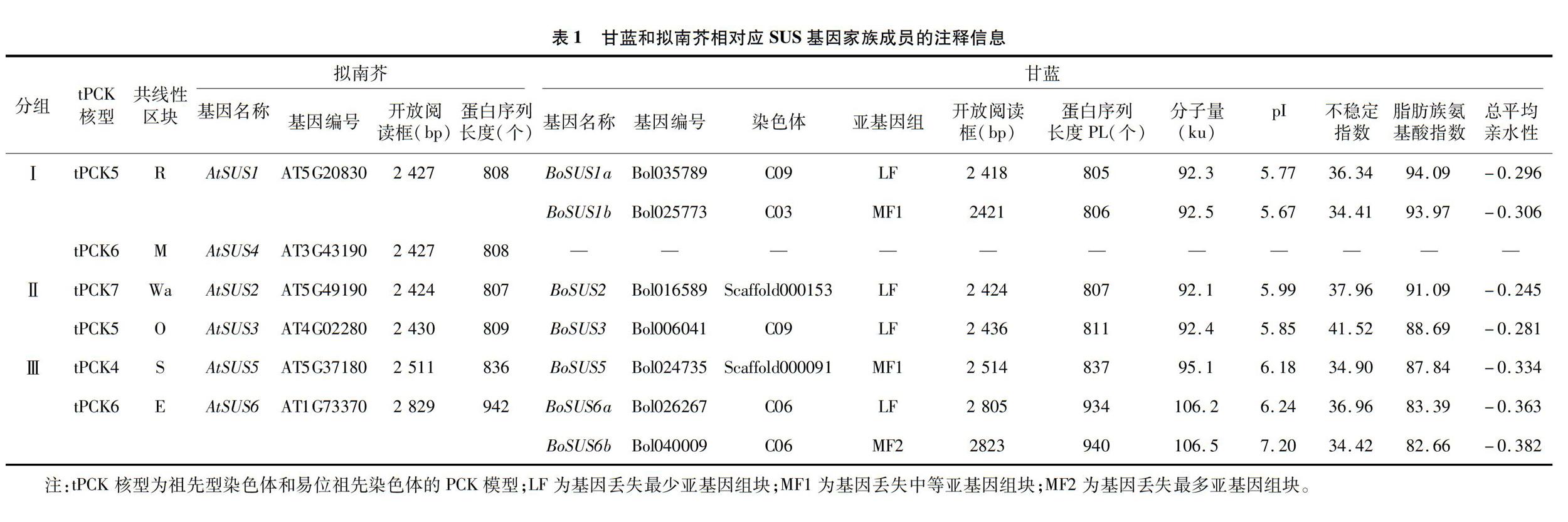
通过对全基因组蛋白数据库的鉴定和结构域验证,在甘蓝和大白菜基因组中分别鉴定到7个BoSUS蛋白和7个BrSUS蛋白。根据命名规则,将这些蛋白分别命名为BoSUS1~BoSUS6和BrSUS1~BrSUS6。将甘蓝、大白菜和拟南芥的20个SUS蛋白序列构建了邻接法(NJ)无根系统进化樹,从而来阐明它们的进化关系(图1)。系统发育分析表明,这些SUS蛋白成员根据聚类被分为3个不同的亚组(Ⅰ~Ⅲ)。亚组Ⅰ、Ⅱ、Ⅲ分别包含6、6、8个SUS成员。其中亚组Ⅰ包括BoSUS1a和BoSUS1b,亚组Ⅱ包括BoSUS2和BoSUS3,亚组Ⅲ包括BoSUS5、BoSUS6a和BoSUS6b。
通过在线ProtParam工具预测了BoSUS蛋白的物理和化学特征。BoSUS蛋白的氨基酸长度范围为805(BoSUS1a)~940(BoSUS6b)个,相对应的开放阅读框(ORF)分布为2 418~2 823 bp(表1)。BoSUS蛋白的分子量分布为92.1(BoSUS2)~106.5(BoSUS6b) ku,理论等电点(pI)范围为5.67(BoSUS1b)~7.20(BoSUS6b)(表1)。除了BoSUS6b,其余所有的BoSUS家族成员的pI均小于7,这说明甘蓝BoSUS蛋白主要是弱酸性蛋白。BoSUS蛋白的不稳定指数范围为34.41(BoSUS1b)~41.52(BoSUS3)。除BoSUS3外,其余的不稳定指数均未超过临界值(大于40被认为不稳定)。此外,脂肪族氨基酸指数和总平均亲水性分别为8266~94.09和-0.382~-0.245(表1)。所有BoSUS蛋白的总平均亲水性值均为负值,表明均是亲水性蛋白。
2.2BoSUS基因的染色体分布和共线性分析
在本研究中,7个BoSUS家族基因均分布在3个亚基因组上,其中LF亚基因组中有4个BoSUS基因,MF1亚基因组中有2个BoSUS基因,MF2亚基因组中有1个BoSUS基因(表1)。此外,与拟南芥AtSUS基因相比,甘蓝中除了BoSUS4基因丢失之外,其他所有的BoSUS基因在芸薹族特异的全基因组3倍化事件[20](WGT)后均被保留了下来。总共有3个BoSUS基因(BoSUS2、BoSUS3和BoSUS5)保留了单拷贝,2个BoSUS基因(BoSUS1和BoSUS6)保留了双拷贝(表1)。同一BoSUS基因不同拷贝之间具有相同的共线性区块,结果如图2所示。此外,还分析了BoSUS基因在甘蓝染色体上的物理定位。BoSUS1b定位于染色体C03上,BoSUS6a和BoSUS6b位于染色体C06上,BoSUS3和BoSUS1a位于染色体C09上,而BoSUS2和BoSUS5只锚定到Scaffolds上,未能锚定到甘蓝的任何染色体上(图2)。
此外,将鉴定到的直系同源和旁系同源SUS基因用于分析BoSUS和BrSUS、AtSUS基因之间的共线性关系。利用BRAD数据库分析了甘蓝和大白菜之间的直系和旁系同源SUS基因关系。共鉴定到甘蓝之间2对旁系同源基因、甘蓝和拟南芥之间7对直系同源基因、甘蓝和大白菜之间11对直系同源基因以及大白菜之间2对旁系同源基因(图3)。
2.3甘蓝和拟南芥SUS基因的Ka、Ks分析
通过计算分析了甘蓝和拟南芥中7个SUS直系同源基因对,得到了它们的同义替换率(Ks)、非同义替换率(Ka)和进化约束值(Ka/Ks)(表2)。结果表明,进化约束值Ka/Ks均小于1,说明甘蓝和拟南芥在与共同祖先分化之后,SUS基因家族经历了纯化(负向)选择作用。Ks值的分布还能体现基因家族的分化时间。在甘蓝和拟南芥的直系同源基因对中,非同义替换率Ks值范围为0.324 2~0529 7。双子叶植物中每个位点每年的同义替换率,表明甘蓝BoSUS基因与拟南芥的同源基因的分化大致发生在10.8×106~17.7×106年, 与芸薹族特异的全基因组3倍化时间(13×106~17×106年)基本相符[20,27]。
2.4甘蓝BoSUS基因结构和亚细胞定位预测分析
本研究根据甘蓝BoSUS基因家族成员的CDS序列和基因组DNA序列,绘制甘蓝BoSUS基因结构图(图4)。结果显示,除了BoSUS1b含有10个外显子,BoSUS5含有13个外显子,BoSUS2含有14个外显子外,其余的BoSUS基因均含有12个外显子,但是各成员外显子的位置和长度存在较大差异。其中,相比BoSUS1a,旁系同源基因BoSUS1b发生了可变剪切和内含子插入,导致其丢失第6、第11位外显子,且第2、第6位内含子长度增长(图4)。而BoSUS6a和BoSUS6b之间外显子、内含子数量以及长度均没有发生明显变化,属于高度保守的。
分别通过在线软件CELLO v2.5和BaCelLo对甘蓝BoSUS蛋白进行亚细胞定位预测,结果如表3所示,2种软件的预测结果均表明甘蓝BoSUS蛋白位于细胞质中。
2.5甘蓝BoSUS基因启动子的顺式作用元件分析
用PlantCARE数据库对甘蓝BoSUS基因家族成员的上游1 500 bp启动子区域进行顺式作用元件的预测(表4)。预测有7个与逆境和激素反应相关的顺式作用元件,包括ABRE(ABA响应元件)、ARE(厌氧诱导调控元件)、GARE-motif(赤霉素响应元件)、LTR(低温响应元件)、TCA-element(水杨酸响应元件)、CGTCA-motif、TGACG-motif(茉莉酸甲酯响应元件)。这些顺式作用元件在5个BoSUS基因中均有分布,但是BoSUS6b基因启动子中没有发现此类调控元件。
2.6甘蓝BoSUS基因在不同器官/组织及低温胁迫下表达模式分析
研究7个BoSUS基因在甘蓝愈伤组织、根、茎、叶、芽、花和角果中的基因表达水平(图5)。其中,BoSUS2基因在各个器官/组织中均没有表达量(FPKM)(图5未列出)。从整体表达水平看,BoSUS1a、BoSUS1b和BoSUS3基因在各个器官/组织中的表达水平(根和叶除外)要高于BoSUS5、BoSUS6a和BoSUS6b基因。此外,BoSUS1a、BoSUS1b和BoSUS3均在花中高水平表达,BoSUS1a基因在花中的表达量FPKM值最大,为867(图5)。
此外,还分析了BoSUS基因在低温胁迫下不同耐寒性甘蓝材料中的表达模式差异。如图6所示,总体而言,BoSUS1a基因低温处理下的整体表达水平远远高于其他几个BoSUS基因。耐冷甘蓝CT-923叶片中BoSUS1a和BoSUS1b在低温处理6、24 h后的表达量相比对照(Mock)急剧升高。冷敏甘蓝CS-D9叶片中BoSUS1a和BoSUS1b基因的表达水平在低温处理6 h后出现了缓慢的升高,而在低温处理24 h后,处理组的表达量相比对照也是出现了表达量急剧升高。而BoSUS3基因仅仅在冷敏甘蓝CS-D9叶片被低温处理24 h后出现了2.5倍的上升,其他时期均没有明显变化(图6)。此外,BoSUS5、BoSUS6a和BoSUS6b整体表达水平很低,这与图5的组织表达水平相类似,且低温处理后的表达量没有发生明显变化。综上所述,BoSUS1a和BoSUS1b是响应低温胁迫的关键蔗糖合成酶基因。
3讨论与结论
糖代谢不仅是植物发育的核心,也是非生物胁迫响应的核心, 因此了解其潜在的机制对于提高植物对干旱、高温和冷胁迫的耐受性至关重要[28]。由于蔗糖本身就是一种重要的信号分子,参与到植物的生長发育过程,SUS参与的蔗糖代谢过程产生的己糖分子也可以作为感知能量和代谢物变化的信号分子[29],参与到细胞壁信号转导、细胞周期和激素调节等过程中,以此来调控种子的发育过程[5,30-31]。
SUS蛋白是一種胞质可溶性酶,有助于淀粉和蛋白质的生物合成以及能量的产生,在植物生长发育中有重要的作用。基于甘蓝基因组,鉴定出7个SUS家族成员,拟南芥、水稻和桃中也鉴定出6个SUS基因[12-13,32],葡萄中鉴定出5个SUS基因[33],杨树中鉴定出4个SUS基因[15]。外显子-内含子结构被认为在多基因家族的进化中发挥重要作用。本研究发现BoSUS基因内含子的数目为9~13个,其中包含11个内含子的BoSUS基因数目最多,为4个,这与大豆和杨树的内含子数目均在11~14个之间[15-16]相符合,这表明SUS家族的内含子数目在不同物种间具有高度保守性。此外,旁系同源基因BoSUS1a、BoSUS1b之间发生了部分可变剪切和内含子插入,导致BoSUS1a与BoSUS1b基因之间功能的多样性,使得出现了BoSUS1a与BoSUS1b基因在不同器官/组织以及响应低温胁迫的基因表达水平的极大差异。通过甘蓝BoSUS基因在不同器官/组织中的表达水平可以看出,BoSUS1a、BoSUS1b和BoSUS3基因在甘蓝不同器官/组织中蔗糖代谢过程中起着重要作用。此外,BoSUS1a、BoSUS1b和BoSUS3基因均在花器官中表达水平最高,表明花器官作为库器官,在生长发育过程中需要大量的物质和能量,需要蔗糖合成酶将库器官里的蔗糖分解,形成从源到库的蔗糖浓度梯度,为蔗糖由韧皮部向库器官的运输提供压力,保证蔗糖向库中持续供应。
耐冷甘蓝CT-923叶片中BoSUS1a和BoSUS1b基因的表达水平在低温处理6、24 h后相比对照急剧升高,而冷敏甘蓝CS-D9中BoSUS1a和BoSUS1b基因表达水平虽然出现了升高,但表达水平远远低于耐冷甘蓝CT-923。表明耐冷甘蓝CT-923在低温胁迫下,叶片中BoSUS1a和BoSUS1b基因迅速响应,表达量急剧上升,使得BoSUS1a和BoSUS1b酶活性增强,为产生保护性反馈机制提供能量,还增加了细胞内的细胞液浓度,冰点降低,抑制了细胞内冰核的形成,使得耐冷甘蓝CT-923耐寒性增强。这与Fenando等的“当植物受到胁迫时,细胞内的可溶性糖含量迅速增加,来维持细胞内蛋白质结构和细胞膜稳定”的结论[34]相一致。有研究还发现,SUS促进蔗糖分解所需要的能量相比其他蔗糖代谢需要的更少,所以在逆境胁迫下,植物更倾向于通过SUS促进蔗糖分解来提供还原糖维持生长[35]。Klotz等研究发现,在低温、干旱、高盐和伤害胁迫下,甜菜SUS基因都会被诱导而表达上调[36]。同样在小麦的研究中发现,遭遇冷害的小麦SUS蛋白含量升高了5~6倍,这表明SUS蛋白可能参与小麦冷驯化的过程,可能是通过调节细胞内可溶性糖的含量以及渗透压的方式来增强耐寒性[37]。此外,在水稻研究中还发现,水稻种子在受到高温胁迫时,通过过表达OsSUS3基因可使种子的垩白减少,来降低高温对水稻产量和品质的造成危害[38]。总之,SUS蛋白可以参与多个逆境胁迫响应,通过过表达SUS基因大多数都能提高植物抵抗逆境胁迫的能力[39]。本研究发现的耐冷甘蓝CT-923叶片中BoSUS1a和BoSUS1b基因在低温胁迫后的表达水平急剧变化,为后续进一步开展BoSUS1a和BoSUS1b基因的具体功能研究奠定了基础。
参考文献:
[1]Koch K E. Carbohydrate-modulated gene expression in plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1996,47(1):509-540.
[2]Chourey P S,Taliercio E W,Carlson S J,et al. Genetic evidence that the two isozymes of sucrose synthase present in developing maize endosperm are critical,one for cell wall integrity and the other for starch biosynthesis[J]. Molecular & General Genetics,1998,259(1):88-96.
[3]Lutfiyya L L,Xu N F,DOrdine R L,et al. Phylogenetic and expression analysis of sucrose phosphate synthase isozymes in plants[J]. Journal of Plant Physiology,2007,164(7):923-933.
[4]Ruan Y L,Jin Y,Yang Y J,et al. Sugar input,metabolism,and signaling mediated by invertase:roles in development,yield potential,and response to drought and heat[J]. Molecular Plant,2010,3(6):942-955.
[5]Chinnusamy V,Zhu J H,Zhu J K. Cold stress regulation of gene expression in plants[J]. Trends in Plant Science,2007,12(10):444-451.
[6]Brill E,van Thournout M,White R G,et al. A novel isoform of sucrose synthase is targeted to the cell wall during secondary cell wall synthesis in cotton fiber[J]. Plant Physiology,2011,157(1):40-54.
[7]Ngele T,Heyer A G. Approximating subcellular organisation of carbohydrate metabolism during cold acclimation in different natural accessions of Arabidopsis thaliana[J]. The New Phytologist,2013,198(3):777-787.
[8]楊丽梅,方智远,庄木,等. “十二五”我国甘蓝遗传育种研究进展[J]. 中国蔬菜,2016(11):1-6.
[9]Sasaki H I,Ichimura K A,Oda M A. Changes in sugar content during cold acclimation and deacclimation of cabbage seedlings[J]. Annals of Botany,1996,78(3):365-369.
[10]王磊,李建勇,张振贤,等. 冻害低温下越冬甘蓝渗透调节物质的变化和作用[J]. 山东农业大学学报(自然科学版),2001,32(4):487-490,494.
[11]蔡青,李成琼,司军. 结球甘蓝耐寒性研究进展[J]. 长江蔬菜,2009(2):1-3.
[12]Baud S,Vaultier M N,Rochat C. Structure and expression profile of the sucrose synthase multigene family in Arabidopsis[J]. Journal of Experimental Botany,2004,55(396):397-409.
[13]Hirose T,Scofield G N,Terao T. An expression analysis profile for the entire sucrose synthase gene family in rice[J]. Plant Science,2008,174(5):534-543.
[14]Duncan K A,Hardin S C,Huber S C. The three maize sucrose synthase isoforms differ in distribution,localization,and phosphorylation[J]. Plant & Cell Physiology,2006,47(7):959-971.
[15]Zhang D Q,Xu B H,Yang X H,et al. The sucrose synthase gene family in Populus:structure,expression,and evolution[J]. Tree Genetics & Genomes,2011,7(3):443-456.
[16]晁毛妮,张自阳,王润豪,等. 大豆蔗糖合成酶家族成员的全基因组鉴定及表达分析[J]. 西北植物学报,2018,38(2):232-241.
[17]Fu H,Park W D. Sink-and vascular-associated sucrose synthase functions are encoded by different gene classes in potato[J]. The Plant Cell,1995,7(9):1369-1385.
[18]Ruan Y L,Llewellyn D J,Furbank R T. Suppression of sucrose synthase gene expression represses cotton fiber cell initiation,elongation,and seed development[J]. The Plant Cell,2003,15(4):952-964.
[19]Zrenner R,Salanoubat M,Willmitzer L,et al. Evidence of the crucial role of sucrose synthase for sink strength using transgenic potato plants(Solanum tuberosum L.)[J]. The Plant Journal,1995,7(1):97-107.
[20]Wang X W,Wang H Z,Wang J,et al. The genome of the mesopolyploid crop species Brassica rapa[J]. Nature Genetics,2011,43(10):1035-1039.
[21]Liu S Y,Liu Y M,Yang X H,et al. The Brassica oleracea genome reveals the asymmetrical evolution of polyploid genomes[J]. Nature Communications,2014,5:3930.
[22]Hu B,Jin J P,Guo A Y,et al. GSDS 2.0:an upgraded gene feature visualization server[J]. Bioinformatics,2015,31(8):1296-1297.
[23]Kumar S,Stecher G,Tamura K. MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution,2016,33(7):1870-1874.
[24]Voorrips R E. MapChart:software for the graphical presentation of linkage maps and QTLs[J]. The Journal of Heredity,2002,93(1):77-78.
[25]Chen C J,Chen H,Zhang Y,et al. TBtools:an integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant,2020,13(8):1194-1202.
[26]Koch M A,Haubold B,Mitchell-Olds T. Comparative evolutionary analysis of chalcone synthase and alcohol dehydrogenase loci in Arabidopsis,Arabis,and related genera(Brassicaceae)[J]. Molecular Biology and Evolution,2000,17(10):1483-1498.
[27]Cheng F,Mandáková T,Wu J,et al. Deciphering the diploid ancestral genome of the mesohexaploid Brassica rapa[J]. The Plant Cell,2013,25(5):1541-1554.
[28]Kakumanu A,Ambavaram M M,Klumas C A,et al. Effects of drought on gene expression in maize reproductive and leaf meristem tissue revealed by RNA-Seq[J]. Plant Physiology,2012,160(2):846-867.
[29]Lastdrager J,Hanson J,Smeekens S. Sugar signals and the control of plant growth and development[J]. Journal of Experimental Botany,2014,65(3):799-807.
[30]Ruan Y L. Signaling role of sucrose metabolism in development[J]. Molecular Plant,2012,5(4):763-765.
[31]Barratt D H,Derbyshire P,Findlay K,et al. Normal growth of Arabidopsis requires cytosolic invertase but not sucrose synthase[J]. PNAS,2009,106(31):13124.
[32]Zhang C H,Yu M L,Ma R J,et al. Structure,expression profile,and evolution of the sucrose synthase gene family in peach(Prunus persica)[J]. Acta Physiologiae Plantarum,2015,37(4):81.
[33]Zhu X D,Wang M Q,Li X P,et al. Genome-wide analysis of the sucrose synthase gene family in grape(Vitis vinifera):structure,evolution,and expression profiles[J]. Genes,2017,8(4):111.
[34]Fenando E P,Boero C,Gallardo M,et al. Effect of NaCl on germination,growth,and soluble sugar content in Chenopodium quinoa Willd. seeds[J]. Botanical Bulletin-Academia Sinica Taipei,2000,41(1):27-34.
[35]房經贵,朱旭东,贾海锋,等. 植物蔗糖合酶生理功能研究进展[J]. 南京农业大学学报,2017,40(5):759-768.
[36]Klotz K L,Haagenson D M. Wounding,anoxia and cold induce sugarbeet sucrose synthase transcriptional changes that are unrelated to protein expression and activity[J]. Journal of Plant Physiology,2008,165(4):423-434.
[37]Crespi M D,Zabaleta E J,Pontis H G,et al. Sucrose synthase expression during cold acclimation in wheat[J]. Plant Physiology,1991,96(3):887-891.
[38]Takehara K,Murata K,Yamaguchi T,et al. Thermo-responsive allele of sucrose synthase 3(Sus3) provides high-temperature tolerance during the ripening stage in rice(Oryza sativa L.)[J]. Breeding Science,2018,68(3):336-342.
[39]何艺涛,王广亚,范春芬,等. 植物蔗糖合酶研究进展[J]. 植物生理学报,2020,56(6):1165-1176.魏后军,胡波,陈萌萌,等. 新西兰兔RBM4基因的克隆、序列分析及组织表达[J]. 江苏农业科学,2021,49(2):33-36.
