山竹醇通过NF-κB信号通路抑制IL-1β诱导的髓核细胞炎症和细胞外基质降解
2021-03-22张顺利顾运涛
张顺利,顾运涛,陈 荣,赵 海
(海南医学院第二附属医院骨科一区,海南 海口 570102)
椎间盘退行性变(intervertebral disc degeneration,IDD)是一种常见的脊柱复杂疾病,会导致患者脊柱功能障碍和生活质量降低[1]。IDD常引起下腰痛,这是中老年群体中常见的症状,可造成巨大的社会负担[2]。正常的髓核可维持椎间盘的结构和功能,髓核衰老和功能受损是IDD发生的潜在原因[3]。有研究发现,在IDD过程中存在细胞外基质丢失、正常椎间盘髓核细胞表型改变、促炎细胞因子释放等现象,而干预髓核细胞的改变可以延缓椎间盘退变的进程[4-5]。有研究表明,多种炎性细胞因子的表达增加都与IDD的发生有关,白细胞介素(interleukin-1β,IL-1β)与肿瘤坏死因子-α(tumour necrosis factor-alpha,TNF-α)在IDD患者的髓核和纤维环细胞中表达均增加[6]。IL-1β与TNF-α可通过增加其他细胞因子的水平,诱导ADAMTS-4、ADAMTS-5和MMPs的表达,并抑制细胞外基质的合成[7-9]。有研究发现,山竹醇具有广泛的生物活性,包括抗氧化、抗炎、神经保护、抗菌等[10-14]。饲粮中添加山竹醇可通过改善仔猪的抗氧化能力,改变应激导致的脂质代谢紊乱,从而保护肝[13-14]。同时,山竹醇可通过抑制IL-1β诱导的软骨细胞炎症,发挥治疗骨关节炎的作用[10]。然而,山竹醇对椎间盘退行性变的治疗作用尚不明确。因此,本研究通过探讨山竹醇对IL-1β刺激的髓核细胞的保护作用,及对其炎症反应和相应基质代谢水平的作用,以期为临床治疗IDD提供参考。
1 材料与方法
1.1 实验动物及试剂
SD大鼠(2个月龄)购自中国科学院动物中心(上海),山竹醇购自Sigma Aldrich公司,重组大鼠IL-1β购自Pepro Tech公司,一抗p-p65、p65、抗IκBα和抗β-actin抗体购自Abcam公司。所有动物实验均经海南医学院伦理委员会批准。
1.2 大鼠髓核细胞培养及处理
大鼠髓核细胞分离和培养的步骤参考文献[15]。SD大鼠用过量戊巴比妥钠安乐死,在无菌条件下收集L1~L5段腰椎间盘。解剖显微镜下从腰椎间盘中分离髓核组织,用0.25%胰蛋白酶及0.1% Ⅱ型胶原酶于37 ℃处理4 h,然后用含有1%青链霉素的DMEM/F12进行培养,每隔1 d更换1次完整的培养基。使用传代至第二代的髓核细胞进行后续实验。
1.3 MTT法检测髓核细胞活力
将大鼠髓核细胞接种于96孔板中,每孔8 000个。培养24 h后,根据细胞贴壁时间的不同,用含不同浓度(0、1、2.5、5、10 μM)山竹醇(溶于DMSO)联合或不联合IL-1β的新鲜培养基进行培养。向每个孔中加入10 μL MTT溶液,细胞培养箱中孵育4 h,使用酶标仪在OD 570 nm处测量每孔的吸光度值。
1.4 Western blot检测相关蛋白表达
用含不同浓度山竹醇(0、2.5、5 μM)联合或不联合IL-1β的新鲜培养基进行培养,分为Control组、IL-1β组、IL-1β+Gar 2.5 μM组和IL-1β+Gar 5 μM组,其中Control组用0 μM山竹醇不联合IL-1β处理髓核细胞,IL-1β组用0 μM山竹醇联合IL-1β处理髓核细胞,IL-1β+Gar 2.5 μM组用2.5 μM山竹醇联合IL-1β处理髓核细胞,IL-1β+Gar 5 μM组用5 μM山竹醇联合IL-1β处理髓核细胞,并用细胞裂解缓冲液收集。在冰上用细胞裂解液孵育30 min后,以12 000 r/min离心20 min,收集上清液,测量蛋白质浓度,配制蛋白上样标准品。蛋白质(40 μg)在10%~12% SDS-PAGE凝胶上分离,转载至PVDF膜上。将PVDF膜用封闭缓冲液孵育1 h,用p65(1∶1 000)、p-p65(1∶1 000)、IκBα(1∶1 000)和β-actin(1∶1 000)的一抗溶液孵育过夜,然后与相应的二抗孵育1 h。通过ECL-Western印迹试剂盒检测条带,并利用ChemiDicTM XRS成像系统对目标条带进行曝光,同时利用Image J图像分析软件进行统计。
1.5 定量RT-PCR检测靶基因mRNA表达
为了研究山竹醇是否能调节IL-1β刺激下的髓核细胞分解代谢水平,本研究检测了MMP-3、MMP-9、MMP-13、ADAMTS-4和ADAMTS-5 mRNA水平的表达。为了进一步研究山竹醇对髓核细胞基质代谢水平的影响,本研究检测了山竹醇对IL-1β刺激下的髓核细胞中细胞外基质蛋白(Col Ⅱ和Aggrecan)mRNA的表达水平的影响。用TRIzol法提取各组髓核细胞总RNA,用1 μg总RNA逆转录合成cDNA,用Prime-Script RT-PCR试剂盒和SYBR premix Ex Taq(Roche Diagnostics GmbH,Penzberg,Germany)预混料进行cDNA的合成和扩增。用DDCt法计算各靶基因mRNA水平,并将其标准化为内参基因(β-actin)的相对水平。具体引物序列见表1。

表1 引物序列
1.6 免疫荧光染色检测观察p65核转移
P65染色时将髓核细胞接种于6孔板载玻片上24 h,每孔1×105/mL。用含不同浓度山竹醇(0、5 μM)联合或不联合IL-1β的新鲜培养基进行培养,分为Control组(0 μM山竹醇不联合IL-1β)、IL-1β组(0 μM山竹醇联合IL-1β)、以及IL-1β+Gar 5 μM组(5 μM山竹醇联合IL-1β)。细胞处理后用4%多聚甲醛固定细胞15 min,用0.1% Triton X-100孵育5 min,用10%牛血清白蛋白于37 ℃封闭1 h后,用抗p65(1∶500)的一抗孵育过夜,然后用相应的二抗孵育1 h。用DAPI染色7 min,在激光共聚焦显微镜下观察。
1.7 统计学分析
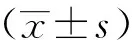
2 结果
2.1 山竹醇抑制髓核细胞凋亡
MTT法检测结果显示,山竹醇在0~10 μM剂量下对大鼠髓核细胞无细胞毒性;IL-1β可诱导髓核细胞活力降低(P<0.05),剂量为2.5~10 μM的山竹醇能够改善IL-1β刺激下的髓核细胞活力(P<0.05),见图1。因此,取山竹醇2.5、5 μM剂量用于实验。
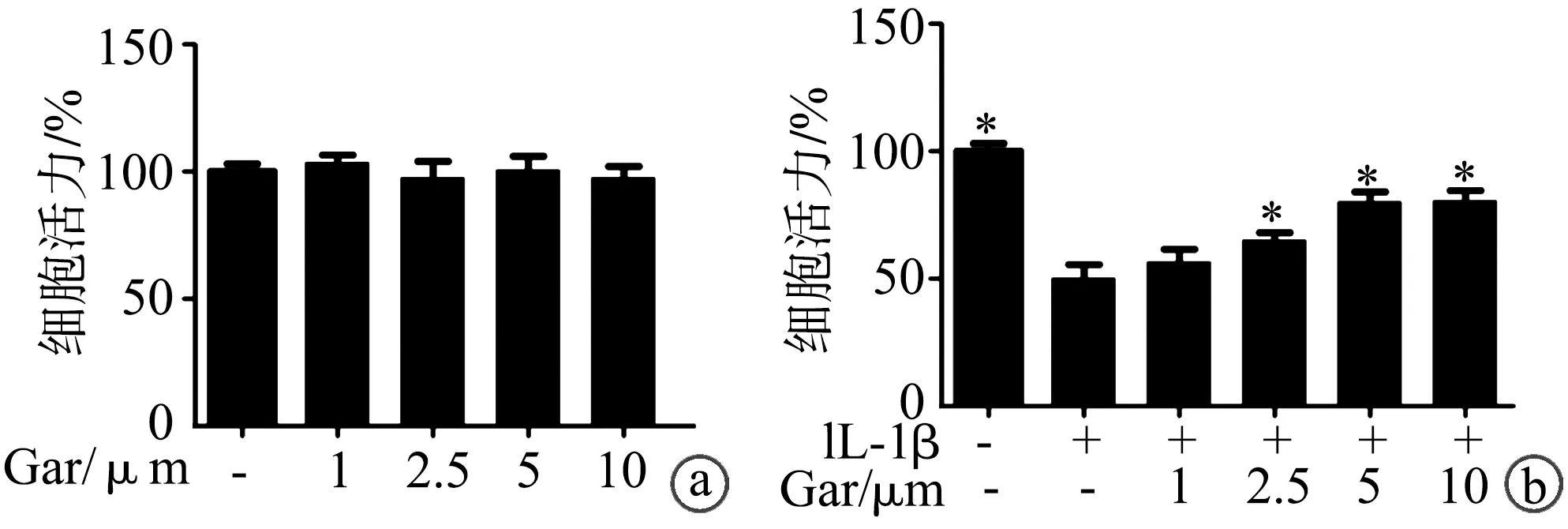
a:一定浓度梯度的山竹醇对大鼠髓核细胞活力的影响;b:山竹醇对IL-1β刺激下髓核细胞活力的影响 *:与仅IL-1β刺激比较,P<0.05
2.2 山竹醇抑制IL-1β刺激的髓核细胞分解代谢活性
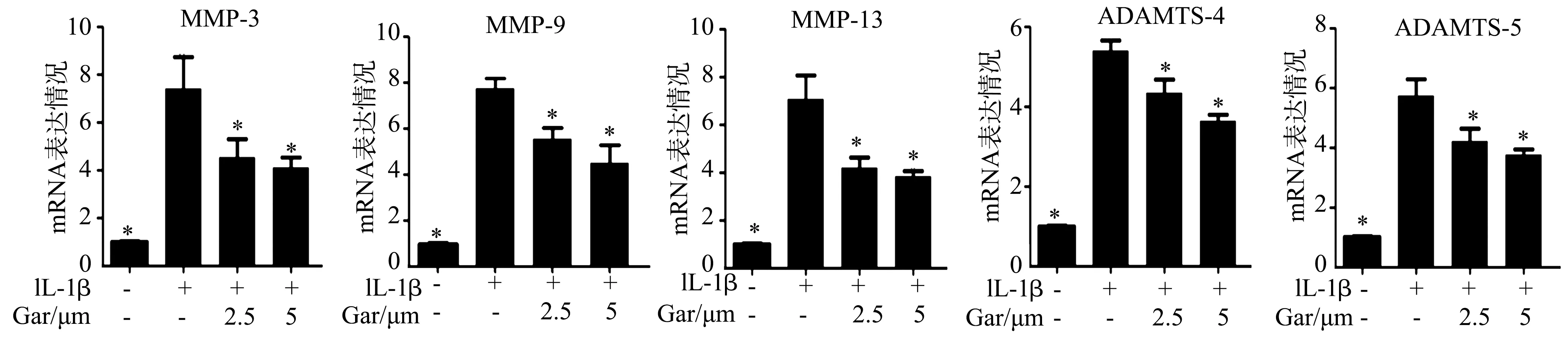
IL-1β刺激后髓核细胞中MMP-3、MMP-9、MMP-13、ADAMTS-4和ADAMTS-5 mRNA表达水平显著提高(P<0.05),而山竹醇能抑制IL-1β刺激后的髓核细胞中MMP-3、MMP-9、MMP-13、ADAMTS-4和ADAMTS-5 mRNA表达水平(P<0.05),见图2。
2.3 山竹醇改善IL-1β刺激后的细胞外基质水平
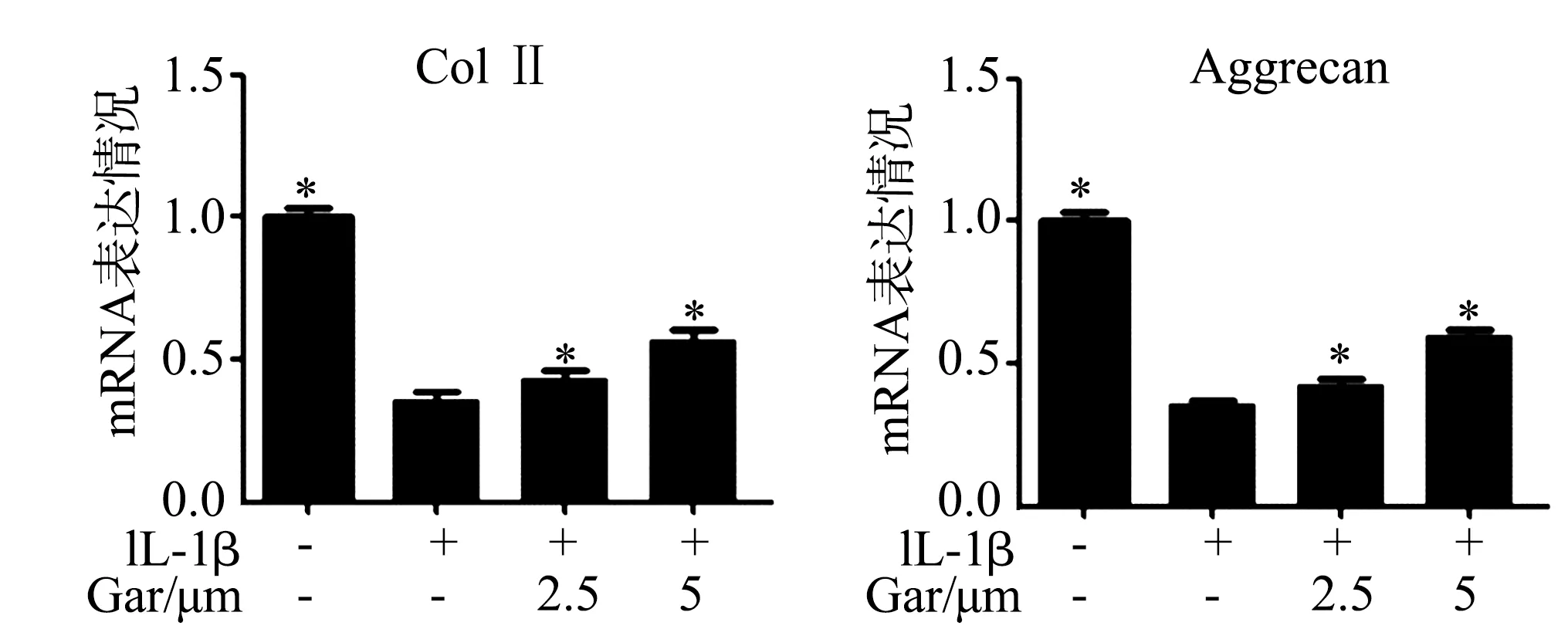
IL-1β下调了髓核细胞中Col Ⅱ和Aggrecan mRNA表达水平(P<0.05),而山竹醇则显著改善了IL-1β刺激下髓核细胞中Col Ⅱ和Aggrecan mRNA表达水平(P<0.05),见图3。
2.4 山竹醇抑制IL-1β刺激的髓核细胞中炎症因子水平增高
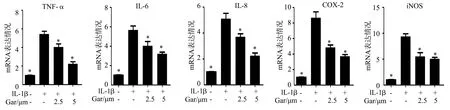
定量RT-PCR检测结果显示,IL-1β可显著提高髓核细胞中TNF-α、IL-6、IL-8、COX-2和iNOS mRNA表达水平(P<0.05);而山竹醇可抑制IL-1β诱导的TNF-α、IL-6、IL-8、COX-2和iNOS mRNA表达水平(P<0.05),见图4。
*:与IL-1β组比较,P<0.05
*:与IL-1β组比较,P<0.05
2.5 山竹醇抑制IL-1β刺激的髓核细胞中NF-κB信号通路
Western blot结果显示,IL-1β激活了髓核细胞中的NF-κB信号通路,而山竹醇逆转了IL-1β对NF-κB p65的活化作用(P<0.05),同时逆转了IL-1β引起的IκBα蛋白水平降低(P<0.05),见图5。免疫荧光染色结果显示,IL-1β刺激下髓核细胞核中发生p65核转移,山竹醇显著抑制了p65向核的转移(图6)。
*:与IL-1β组比较,P<0.05
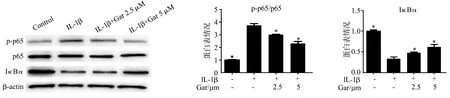
*:与IL-1β组比较,P<0.05
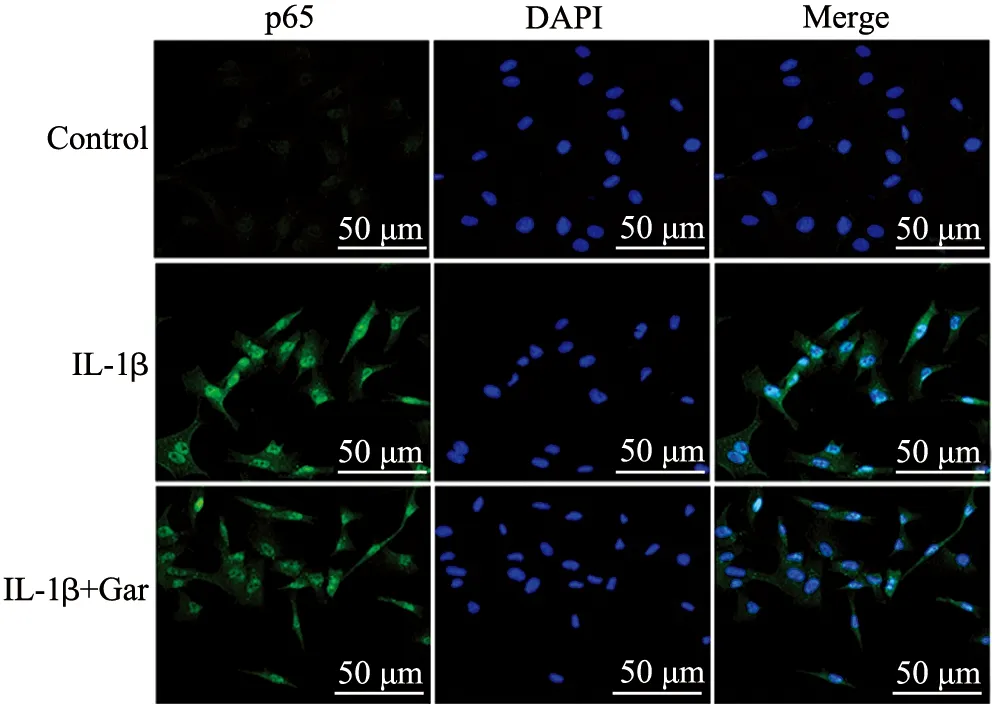
图6 免疫荧光观察p65核转移(绿色:p65;蓝色:细胞核)
3 讨论
IDD发生在自然衰老过程中,是中老年人下腰痛最常见的原因,会造成巨大的社会经济负担[3]。已有研究表明炎症及细胞外基质降解与IDD的病理过程有关[5,16]。基质蛋白的丢失伴随着基质分解酶的上调,从而减弱了细胞外基质的吸水性,导致髓核水分含量减少和椎间盘压力下降[17]。MMPs(MMP-1、MMP-3、MMP-7、MMP-9、MMP-13、ADAMTS-4和ADAMTS-5)在IDD过程中的蛋白水解酶作用是导致主要细胞外基质蛋白Col Ⅱ和Aggrecan降解的主要因素。MMP-3、MMP-9和MMP-13是IDD过程中导致Col Ⅱ降解的关键酶,而ADAMTS-4和ADAMTS-5是导致Aggrecan降解的关键酶[18-20]。在IDD过程中,IL-1β和其他促炎因子上调,促炎因子的表达触发了蛋白水解酶的产生,从而破坏了椎间盘内细胞外基质的稳态[21]。有研究表明,IL-1β可上调椎间盘中MMP-3、MMP-13、ADAMTS-4、ADAMTS-5等分解代谢酶的表达[21-22]。本研究发现,IL-1β通过增加MMP-3、MMP-9、MMP-13、ADAMTS-4和ADAMTS-5的表达来增强蛋白水解作用,而山竹醇则可使上述指标的表达下降;同时,山竹醇可上调IL-1β刺激后的髓核细胞主要细胞外基质蛋白(Col Ⅱ和Aggrecan)的基因表达。以上均表明,山竹醇可能在IL-1β刺激的髓核细胞中具有抗分解代谢作用,可保护基质蛋白免受降解。
有研究表明炎症与IDD的进展有关[23]。多种炎性细胞因子的表达增加与IDD变性的发生有关。在IDD过程中,促炎症因子IL-1β、TNF-α和IL-6刺激髓核细胞产生更多的炎症因子,导致细胞外基质降解酶升高,细胞外基质降解。促炎症因子,尤其是TNF-α和IL-1β,在IDD中起重要作用[24]。有研究表明,IL-1β能够上调细胞外基质降解酶,包括MMPs、ADAMTS,导致Ⅱ型胶原和蛋白多糖降解,最后髓核由于失去细胞外基质而严重降低保水能力,造成椎间盘内压力下降,功能受损[25]。在一项对猪的研究中发现,椎间盘内注射TNF-α可导致IDD[26]。而相关研究发现,山竹醇具有广泛的生物活性,包括抗氧化、抗炎、神经保护、抗菌[10-14]。饲粮添加山竹醇可通过提高仔猪的抗氧化能力,改善应激导致的脂质代谢情况,从而保护肝[13-14]。山竹醇可通过抑制小胶质细胞神经炎症因子的表达,治疗相关的神经病理性疼痛[11]。同时,山竹醇可通过抑制IL-1β诱导的软骨细胞炎症,治疗骨关节炎[10]。本研究结果显示,山竹醇可降低iNOS、COX-2、IL-6、IL-8和TNF-α表达水平,这提示山竹醇可抑制IDD过程中的炎症反应。
NF-κB是IDD进展过程中的关键分子。有研究发现,IL-1β可诱导NF-κB磷酸化[27-28]。NF-κB信号通路是IDD过程中一个重要的信号通路,具有诱导基质降解、促进炎症和抑制细胞外基质合成的能力[29]。NF-κB通常位于细胞质中,并与IκBα结合,IL-1β的刺激可释放NF-κB,并促进NF-κB从细胞质向细胞核转移,随后促进炎症因子(如MMPs、iNOS、COX2和IL-6等)的表达[30-31]。山竹醇可通过抑制NF-κB信号通路,从而抑制IL-1β诱导的软骨细胞炎症和骨关节炎[20]。本研究结果显示,山竹醇可通过抑制IκBα的降解,显著抑制IL-1β诱导的NF-κB激活,从而增加核内NF-κB的表达。这些结果表明,山竹醇能通过抑制NF-κB核移位和IkBα降解从而抑制IL-1β诱导的髓核细胞NF-κB活化。
综上,山竹醇可抑制IL-1β刺激下的髓核细胞炎症和细胞外基质降解,同时山竹醇可通过抑制NF-κB信号通路达到保护作用。因此,山竹醇对预防IDD有一定的作用,有望成为一种新的IDD治疗药物。