ASTL 抗体中和ASTL 对人宫颈癌ME-180细胞放射敏感性的影响
2021-03-22赵舒雅李航樊赛军
赵舒雅 李航 樊赛军
中国医学科学院北京协和医学院放射医学研究所,天津市放射医学与分子核医学重点实验室 300192
宫颈癌是世界上最常见的女性恶性肿瘤之一,居全球女性癌症患者病死原因的第二位[1],在发展中国家尤为常见。近年来,我国宫颈癌患者也逐渐增多,每年病死于宫颈癌的患者约有5 万例[2],且患者年龄呈年轻化趋势。从病因角度分析,约有95%的患者因人乳头瘤状病毒(HPV)感染罹患宫颈癌,部分感染者体内的人乳头瘤状病毒(HPV)随时间延长而被清除,还有部分患者因持续感染导致宫颈癌变[3]。放疗是治疗宫颈癌的常用方法,但约有30%的晚期宫颈癌患者经放疗后出现肿瘤复发和转移,导致预后不佳,严重影响患者的生存质量[4]。因此,如何有效增强宫颈癌细胞的放射敏感性,减少放疗对正常组织的放射损伤及放疗后的不良反应,提高放疗的疗效,成为亟待解决的问题。
龙虾肽酶样金属内肽酶(astacin-like metalloendopeptidase,ASTL)是一类与卵母细胞表面相关的锌基质金属蛋白酶。ASTL 基因编码含有431 个氨基酸、相对分子质量为46 000 的蛋白产物。生物信息学结构预测结果表明,ASTL 蛋白由N 端信号肽、含有催化位点模序的蛋白酶功能区和C 末端多肽组成[5]。ASTL 的基因序列在不同物种间相对保守(如人与小鼠的同源率高达75.2%),但基因的组织表达特异性显著,同时ASTL 蛋白可以在精卵相互作用时发挥功能,并在受精过程中阻止多精入卵[6]。有研究结果表明,ASTL 在肿瘤和正常细胞中存在表达差异,其表达水平与子宫癌、卵巢癌等癌症的发生发展相关,并可作为诊断子宫癌的生物标志物;同时由于膜蛋白易与抗体结合,加入蛋白抗体可促进ASTL 在溶酶体中的降解,进而影响子宫癌细胞的生长,因此ASTL还可以作为子宫癌免疫治疗的一种新型药物靶点[7-8]。本研究探讨ASTL 蛋白在人宫颈癌ME-180细胞抵抗辐射中的作用,旨在为宫颈癌及ASTL 与放疗增敏的相关临床与基础研究奠定理论基础。
1 材料与方法
1.1 试剂与仪器
DMEM 液体培养基、胎牛血清均购自以色列Biological 生物科技公司;青链霉素双抗购自美国Hyclone 公司;Hoechst 33342 反应液、二甲基亚砜、谷氨酰胺、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]溶液、RIPA 裂解液、蛋白加样缓冲液、Triton X-100、牛血清白蛋白、抗荧光衰减封片剂均购自北京索莱宝科技有限公司;Lipofectamine 3000、Trizol试剂均购自美国Invitrogen 生命技术有限公司;ECL超敏发光液购自白鲨生物科技公司;短发夹RNA(short hairpin RNA,shRNA)ASTL(sh-ASTL)质粒购自苏州金唯智生物科技有限公司;cDNA 合成试剂盒购自日本 TaKaRa 公司;实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒、聚偏氟乙烯(PVDF)膜均购自美国赛默飞世尔科技公司;兔抗人ASTL 抗体购自上海沪震生物科技公司;磷酸化蛋白激酶B(phosphorylated protein kinase B,pAKT)抗体、 甘油醛-3-磷酸脱氢酶(GAPDH)抗体均购自美国Proteintech 公司;AKT 抗体、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)1抗体、辣根过氧化物酶标记的山羊抗兔免疫球蛋白G 及荧光素异硫氰酸酯(FITC)标记的山羊抗兔免疫球蛋白G 均购自英国Abcam 公司;5-乙炔基-2′脱氧尿嘧啶核苷(5-ethynyl-2′-deoxyuridine,EdU)试剂盒购自南京恩晶科技生物有限公司;细胞膜蛋白和细胞质蛋白提取试剂盒均购自上海贝博生物科技有限公司。Gammacell®40 Exactor137Cs γ 射线照射源,剂量率为1 Gy/min,购自加拿大Best Theratronics 公司;RT-6500 酶标分析仪购自深圳雷杜生命科学股份有限公司;D3024R 离心机购自大龙兴创实验仪器北京股份公司;TCS SP5 激光扫描共聚焦显微镜购自德国徕卡公司。
1.2 细胞培养、分组和照射
人宫颈癌HeLa 细胞、ME-180 细胞均购自美国模式菌种收集中心。用含10%胎牛血清、1%青链霉素双抗的DMEM 液体培养基培养ME-180 细胞;用含10%胎牛血清、3%谷氨酰胺、1%青链霉素双抗的DMEM 液体培养基培养HeLa 细胞。培养条件为5% CO2、37℃恒温培养,细胞铺满培养瓶约80%时进行传代亚培养。
根据细胞处理方法的不同,按以下方式进行分组。(1)将ME-180 细胞分为4 组:对照组、照射组(4 Gy)、ASTL 抗体组和ASTL 抗体+照射组(4 Gy),采用EdU 染色、MTT 实验检测细胞的存活情况和增殖能力,并于照射后0、24、48、72 h采用免疫荧光、Western blot 实验检测ASTL 在细胞中的定位情况。(2)将ME-180 细胞分为2 组:照射组、ASTL 抗体+照射组,分别进行0、2、4、8 Gy 照射,并采用克隆形成实验检测每组细胞的增殖能力。(3)将HeLa 细胞分为2 组:对照组、ASTL 抗体组,分别进行0、2、4、8 Gy 照射,采用MTT 实验检测细胞的存活情况。(4)将ME-180 细胞分为2 组:短发夹RNA 对照组(sh-对照组)、短发夹RNA ASTL 转染组(sh-ASTL 组),采用qRT-PCR、Western blot 实验检测AKT 等靶基因的表达;同时,分别用0、5、10 nmoL/L 的抗体处理ME-180 细胞,采用Western blot 实验检测抗体中和对靶基因表达情况的影响。(5)将ME-180细胞分为2 组:对照组、照射组(4 Gy),采用Western blot 实验检测ASTL、AKT 等靶基因的表达情况。
以上除第(4)组实验提到的抗体浓度,其他实验所用抗体浓度均为5 nmoL/L。所有照射均使用137Cs γ 射线照射源,剂量率为1 Gy/min。
1.3 EdU 染色实验
将接受不同处理后且处于对数生长期的ME-180细胞,按1×103个/孔接种于96 孔板中,4 Gy 照射后24 h 进行EdU 染色实验。制备适量50 μmol/L的EdU 培养基,每孔100 μL,37℃孵育2 h;PBS洗2 次,每次5 min;加入50 μL 4%多聚甲醛室温固定30 min,固定完成后弃去细胞固定液;加入3%牛血清白蛋白洗2 次;加入100 μL 0.5%Triton X-100 的PBS,室温孵育10 min;加入100 μL PBS,脱色摇床洗5 min;加入100 μL 1×X Apollo®染色反应液,室温、避光条件下,脱色摇床孵育30 min;弃除染色反应液后,加入渗透剂(0.5%Triton X-100 的PBS),每孔100 μL,室温反应10 min,除去渗透剂;加入100 μL 的甲醇洗2 次,每次5 min;加入100 μL PBS 洗涤,5 min;加入100 μL 1×Hoechst 33342 反应液,摇床孵育30 min,注意避光,弃去反应液;加入100 μL PBS 清洗2 次。染色完成后,立即观察并获取图像。
1.4 MTT 实验
ME-180 细胞、HeLa 细胞接受不同剂量(0、2、4、8 Gy)的射线照射后,按3×104个/孔接种于96 孔板中,培养20 h 后,每孔加入20 μL 的 MTT溶液,于37℃的CO2恒温培养箱中培养4 h,加入100 μL 二甲基亚砜,摇床低速振摇10 min。使用酶标仪检测各组细胞在490 nm 处的吸光度。
1.5 克隆形成实验
ME-180 细胞接受不同剂量(0、2、4、8 Gy)的射线照射后,立即将约2000 个不同处理组的细胞接种至60 mm 的培养皿中。细胞连续培养3 周至出现肉眼可见的克隆时,弃掉培养基用甲醇固定30 min,加姬姆萨应用液染色30 min,流水洗净,计数细胞数≥50 个作为1 个克隆,计算克隆数。细胞克隆形成率=照射细胞克隆数/未照射同种细胞克隆数×100%。
1.6 免疫荧光实验
将1×105个ME-180 细胞接种到放置有盖玻片的6 孔板中,24 h 后进行4 Gy 照射4 min。(1)分别在照射后0、24、48、72 h 去掉培养基,PBS 清洗2 次,每孔加入1 mL 4%多聚甲醛,室温下固定15 min。(2)0.3% Triton X-100 室温下处理细胞15 min,5%牛血清白蛋白室温封闭2 h。(3)加入兔抗人ASTL 抗体(1∶400 稀释)30 μL,4℃孵育过夜,PBS 清洗 3 次,加入异硫氰酸荧光素(FITC)标记的山羊抗兔免疫球蛋白G(1∶1000 稀释) ,室温孵育1 h,PBS 清洗。(4)PBS 中摇晃清洗3 次,滴加50 μL 4′,6-二脒基-2-苯基吲哚(DAPI)染液于盖玻片,室温孵育30 min。(5)PBS 中摇晃清洗3 次,用30 μL抗荧光衰减封片剂进行封片,干燥后于荧光显微镜下观察。使用激光扫描共聚焦显微镜观察照射后不同时间点(0、24、48、72 h)ASTL 在细胞中的定位情况。
1.7 Western blot 实验
PBS 清洗处理后的ME-180 细胞,将150 μL/孔RIPA 裂解液加入6 孔板,并置于冰上裂解细胞2 h,10 000×g离心10 min,取上清液。加入等体积的2 倍浓度的蛋白加样缓冲液,沸水煮沸5 min,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳;电泳结束后转膜,将聚偏氟乙烯(PVDF)膜切成凝胶大小,在100%甲醇中预浸一下后浸泡在缓冲液中,保持膜和凝胶湿润;转膜结束后,用5%脱脂奶粉室温封闭2 h;依次加入兔抗人ASTL 抗体(1∶400稀释)、AKT 抗体、pAKT 抗体、ERK1 抗体(均为1∶1000 稀释),4℃孵育过夜;用TBST( tris buffered saline with tween)缓冲液洗3 次,每次15 min;辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(1∶2000 稀释)室温孵育1 h,TBST 洗3 次,每次15 min;用ECL(enhanced chemiluminescent)发光法检测蛋白的表达。
1.8 细胞转染和抗体处理
转染前1 d,将密度为1×105个/mL 的ME-180细胞接种于6 孔板中,使转染时的细胞密度保持在70%左右。用125 μL 无血清无抗生素的DMEM培养基分别与3.75 μL、7.5 μL 的Lipofectamine 3000混合,混匀后室温下孵育5 min,为A 液;用125 μL无血清无抗生素的DMEM 培养基稀释sh-ASTL,1 μg/孔sh-ASTL,混匀后孵育5 min,为B 液;将A、B 溶液混匀即为转染液,孵育30 min。转染时去掉6 孔板中的培养基,PBS 洗2~3 次,每孔加入约2 mL 无血清无抗生素的DMEM 培养基,将孵育后的转染液加入6 孔板中,轻轻摇晃混合;于37℃的CO2恒温培养箱中培养4~6 h 后换为含血清、青链霉素双抗的DMEM 培养基培养[9]。24 h后收集细胞,检测ME-180 细胞中AKT、ASTL等mRNA 与靶基因的表达情况。同时,分别用0、5、10 nmoL/L 的抗体处理ME-180 细胞,检测抗体中和对靶基因表达情况的影响。
1.9 qRT-PCR 检测AKT 表达
将700 μL/孔 Trizol 试剂加入6 孔板裂解细胞,提取细胞总RNA,将提取的RNA 按照cDNA合成试剂盒说明书反转录生成cDNA,将甘油醛-3-磷酸脱氢酶(GAPDH)mRNA 的表达量作为内参。进行qRT-PCR,分析其扩增曲线和融解曲线。扩增条件: 95℃预变性 30 s;95℃变性3 s,60℃退火30 s,72℃延伸30 s,循环40 次,数据采用 2-ΔΔCt法进行分析。 实验所需引物来源于GenBank(https://www.ncbi.nlm.nih.gov/genbank)以及miRBase(https://www.mirbase.org)数据库,通过Primer Premier 5 软件(购自美国PREMIER Biosoft公司)进行引物设计,具体序列见表1。

表1 mRNA 实时荧光定量PCR 引物序列Table 1 The primers for quantitative real-time PCR analysis of the mRNA
1.10 细胞膜和细胞质蛋白的提取
取5×106~10×106个经5 nmoL/L 兔抗人ASTL 抗体处理的ME-180 细胞,在4℃、500×g条件下离心3 min,小心去除培养基,收集细胞。用冷PBS 洗涤细胞2 次。按照细胞膜蛋白和细胞质蛋白提取试剂盒说明书提取蛋白。细胞样品中加入200 μL 冷的试剂A、 2 μL 蛋白酶抑制剂混合物、2 μL蛋白稳定剂,高速涡旋振荡15 s,置冰上10 min。再次高速涡旋振荡5 s,然后在4℃、13 000×g条件下离心5 min。快速将上清转移至另一预冷的干净离心管,37℃水浴5~10 min,37℃下2 000×g离心5 min,此时溶液分为两层(对着光线看),下层相约为20 μL,收集上层相,即为细胞质蛋白。用150~200 μL 冷的试剂B 稀释下层相,混匀后冰浴2 min,37℃水浴10 min,37℃下22 000×g离心5 min,此时溶液分为两层(对着光线看),下层相约为20 μL,用100 μL冰冷的试剂C 稀释下层相,即得细胞膜蛋白。
1.11 统计学分析
应用 IBM SPSS Statistics 21.0 软件进行统计学分析。数据均符合正态分布、方差齐性检验后,组间比较采用独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 ASTL 对宫颈癌细胞放射敏感性的影响
EdU 染色实验结果显示,ASTL 抗体组与对照组比较,差异无统计学意义(t=2.45,P>0.05),照射组(4 Gy)和ASTL 抗体组与ASTL 抗体+照射组(4 Gy)比较,细胞增殖的差异均有统计学意义(t=9.25、11.16,均P<0.05)(图1A)。MTT 实验结果显示,与对照组相比,照射后24、48、72 h 时照射组(4 Gy)和ASTL 抗体组ME-180 细胞增殖速度的差异均无统计学意义(t=2.16、2.33、2.57,均P>0.05;t=2.11、2.43、2.77,均P>0.05);而与照射组相比,ASTL 抗体+照射组(4 Gy)ME-180 细胞的生长速度明显降低,且差异均有统计学意义(t=5.17、10.32、14.27,均P<0.05)(图1B)。在HeLa细胞的MTT 实验中也得到同样的结果,与照射组相比,ASTL 抗体+照射组2、4、8 Gy 受照射细胞的生长受到显著抑制,差异均有统计学意义(t=4.27、9.66、15.71,均P<0.05)(图1C)。ME-180细胞的克隆形成实验结果显示,与照射组相比,ASTL 抗体+照射组能够显著抑制8 Gy 照射后ME-180 细胞的增殖,差异有统计学意义(t=7.63,P<0.05)(图1D)。以上实验结果表明,ASTL 抗体能够通过中和ASTL 抑制照射后ME-180 细胞的生长和增殖,初步揭示ASTL 在受到照射后的ME-180细胞的生长和增殖过程中发挥了重要的调控作用。

图1 ASTL 抗体对人宫颈癌ME-180 和HeLa 细胞放射敏感性的影响 A 为EdU 染色实验检测ME-180 细胞在接受不同条件处理后细胞的增殖情况,左图中从左到右依次为EdU 染色、Hoechst 活细胞染色及二者合并图,右图为阳性细胞计数结果,a 表示与ASTL 抗体+照射组比较,差异均有统计学意义(t=9.25、11.16,P<0.05);B 为MTT 实验检测ME-180 细胞在接受不同条件处理后的细胞存活情况,a 表示与照射组比较,差异均有统计学意义(t=5.17、10.32、14.27,均P<0.05);C 为MTT 实验检测HeLa 细胞在接受不同条件处理后的细胞存活情况,a 表示与照射组比较,差异均有统计学意义(t=4.27、9.66、15.71,均P<0.05);D 为克隆形成实验检测ASTL 抗体对不同剂量照射后ME-180 细胞增殖能力的影响,a 表示与照射组比较,差异有统计学意义(t=7.63,P<0.05)。ASTL 为龙虾肽酶样金属内肽酶;EdU 为5-乙炔基-2′脱氧尿嘧啶核苷;Hoechst 为赫斯特活细胞染色;MTT 为3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐Figure 1 Effect of astacin-like metalloendopeptidase antibody on radiosensitivity of human cervical cancer ME-180 and HeLa cells
2.2 ASTL 在照射后的ME-180 细胞中的表达水平及定位
免疫荧光、Western blot 实验结果显示,ME-180细胞经4 Gy 照射后,ASTL 蛋白在ME-180 细胞中的定位发生转移。照射后0 h 时,标记ASTL 蛋白的绿色荧光位于细胞膜;24 h 后,细胞膜绿色荧光强度降低,细胞质绿色荧光强度升高;照射后48~72 h,ASTL 重新定位在细胞膜上(图2A、B)。Western blot 实验结果显示,ASTL 抗体加入后,细胞总蛋白量下降,ASTL 蛋白在细胞质与细胞膜的定位数减少,照射后24 h,ASTL 蛋白在细胞质中的定位数增加,但低于照射组(图2C)。以上实验结果表明,照射后的ME-180 细胞中ASTL 蛋白水平上调,定位由细胞膜转移至细胞质,且发挥功能后又重新定位至细胞膜。重新定位后,ASTL 蛋白量与转移前无明显差异。
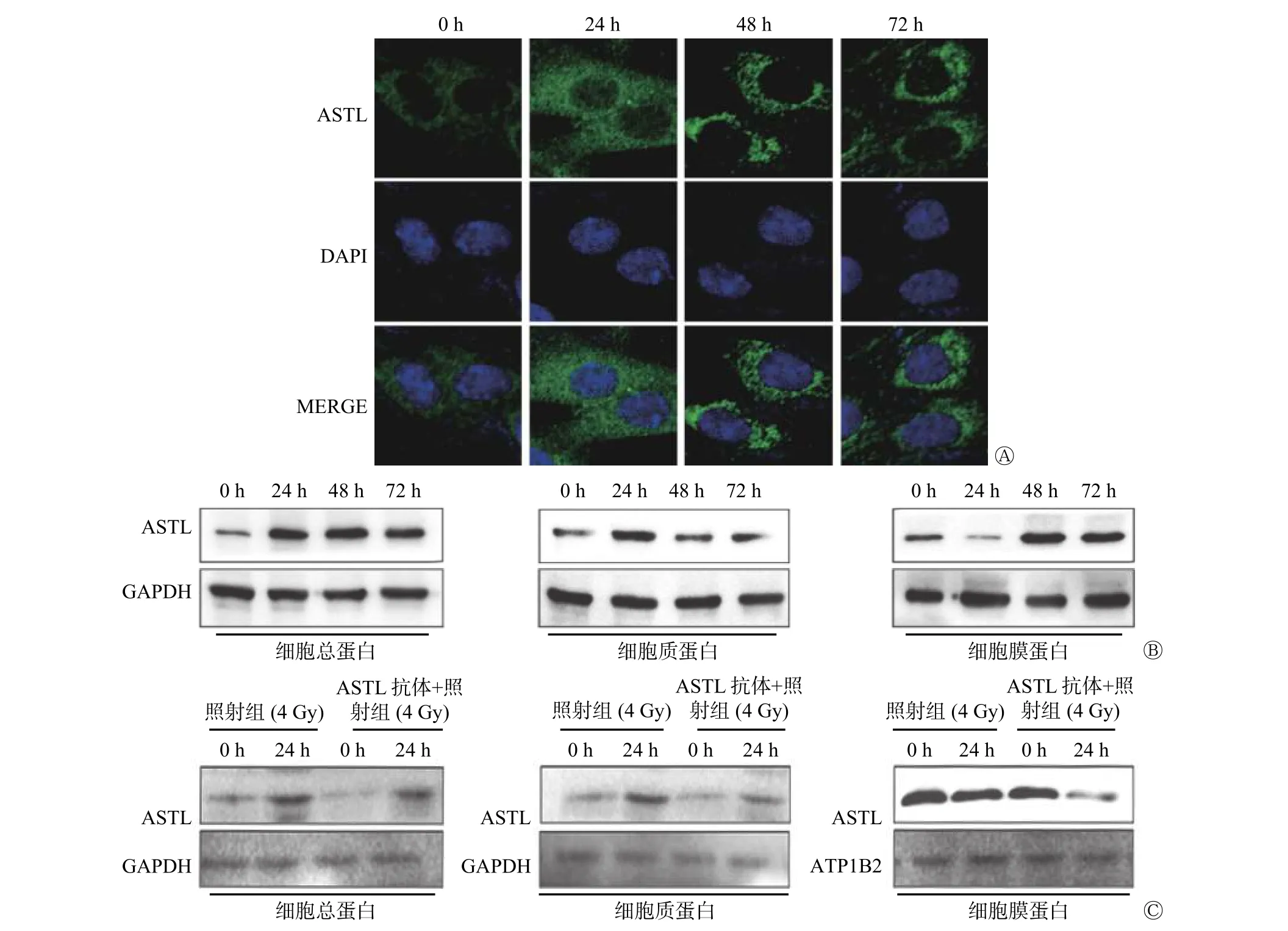
图2 4 Gy γ 射线照射对ASTL 蛋白在人宫颈癌ME-180 细胞中定位的影响 A 为免疫荧光实验检测ASTL 蛋白在照射后不同时间点的表达水平以及在细胞中的定位情况; B 为Western blot 实验检测照射后不同时间点ASTL 蛋白在细胞膜及细胞质中的表达水平;C 为加入抗体后Western blot 实验检测不同时间点ASTL 蛋白在细胞膜及细胞质中的表达水平。ASTL 为龙虾肽酶样金属内肽酶;DAPI 为4′,6-二脒基-2-苯基吲哚;MERGE 为合并后图像;GAPDH 为甘油醛-3-磷酸脱氢酶;ATP1B2 为钠钾三磷酸腺苷酶通道蛋白2Figure 2 Effect of 4 Gy γ-rays on the localization of astacin-like metalloendopeptidase protein in human cervical epidermal cancer ME-180 cells
2.3 ASTL 转移至细胞质后对AKT 等靶基因表达水平及其信号通路的影响
采用qRT-PCR 实验检测ASTL 干扰后细胞中与辐射抵抗相关的部分癌基因的表达水平变化情况,结果显示,ASTL 干扰片段转入后,ME-180细胞中与肿瘤发生相关的基因表达水平下降最明显的为AKT,差异有统计学意义(t=13.94,P<0.05)(图3A)。通过Western blot 实验进一步检测了ASTL 对AKT 信号通路中相关靶基因的调控作用,结果显示,ASTL 干扰或加入ASTL 抗体对辐射后ME-180 细胞的AKT等靶基因的表达水平下调作用显著(图3B)。ME-180 细胞接受4 Gy 照射后,结果显示,与对照组相比,照射组(4 Gy)ASTL、AKT 等靶基因的表达水平显著升高(图3C)。综上,ASTL 抗体或sh-ASTL 可通过中和ASTL 抑制AKT 信号通路,从而增强ME-180 细胞的放射敏感性。

图3 Sh-ASTL 或ASTL 抗体对人宫颈癌ME-180 细胞中AKT 等靶基因表达的影响 A 为qRT- PCR 实验检测ME-180 细胞中干扰ASTL 后相关基因的表达水平变化,a 表示与sh-对照组比较,差异均有统计学意义(t=13.94、6.37、9.16, 均P<0.05);B 为ME-180细胞接受4 Gy γ 射线照射后24 h 时,Western blot 实验检测ASTL 干扰或抗体中和对AKT 信号通路中相关基因表达水平的影响;C 为4 Gy γ 射线照射对ASTL、AKT 等基因表达水平的影响。AKT 为蛋白激酶B;ATM 为共济失调毛细血管扩张突变基因;PDK 为3-磷酸肌醇依赖蛋白激酶;ERK 为细胞外信号调节激酶;CHK 为沉默细胞周期检测点激酶;PTEN 为人第10 号染色体缺失的磷酸酶及张力蛋白同源基因;Survivin 为凋亡抑制蛋白存活素;ASTL 为龙虾肽酶样金属内肽酶;sh-ASTL 为用短发夹 RNA 敲降ASTL;pAKT 为磷酸化蛋白激酶B;GAPDH 为甘油醛-3-磷酸脱氢酶Figure 3 Effect of Sh-ASTL or ASTL antibody on the expression of protein kinase B gene and other target genes in human cervical cancer ME-180 cells
3 讨论
宫颈癌的基本治疗方法为放疗和手术治疗。放疗通过能量的释放阻止细胞生长并破坏癌细胞的生物学功能,从而达到抑制肿瘤生长,使其减小甚至消失的目的[9-10]。目前放疗已成熟应用于多种肿瘤治疗中。对于一些无法进行手术的晚期宫颈癌患者来说,放疗也能缓解疼痛,延长寿命,并提高患者生存质量[11-12]。目前,放疗在宫颈癌的临床应用中仍存在许多问题。尤其随着放疗过程的进展,宫颈癌患者的癌细胞的放射敏感性逐渐降低,肿瘤瘤体持续快速生长,发生浸润或转移,再次降低了患者的生存质量[13-14]。
在前期研究中,我们通过人蛋白质图谱(HPA)、癌症基因图谱(TCGA)及肿瘤芯片(Scotto Cervix)数据库获取了ASTL 基因在多种临床肿瘤组织中的表达情况,其中,ASTL 基因在宫颈癌中的异常表达最为显著,因此,我们选择人宫颈癌ME-180 细胞作为研究对象。通过人为加入ASTL 抗体中和膜蛋白ASTL,证实了ASTL 抗体对ME-180细胞的放射敏感性具有影响,且随着照射剂量的增大,实验组与对照组细胞的存活与增殖情况差异愈显著。随后转入ASTL 干扰片段,对ME-180 细胞中与宫颈癌发生相关的基因表达变化情况进行了研究,结果显示,AKT 等靶基因的表达水平下调显著。
磷脂酰肌醇-3-激酶(PI3K)/AKT 通路是癌症发展和治疗中最重要的激酶信号网络之一,AKT 是这一通路的中心介质,其异常激活与许多恶性肿瘤有关,包括肺癌[15]、肝细胞癌[16]、乳腺癌[17]、鼻咽癌[18]和宫颈癌[19]等。活化的AKT 可参与细胞的生长和增殖[20],调控细胞凋亡[21]进程,并与肿瘤的侵袭、转移和血管生成等相关,参与多种生物学进程。目前也有研究结果证实,AKT 与肿瘤化疗耐药[22]和辐射抵抗[20]相关,特别是其参与的信号通路在辐射抵抗中起关键作用[23]。本研究结果显示,γ 射线照射后,ASTL 干扰显著降低γ 射线照射后ME-180 细胞的存活与增殖能力,ASTL 抗体的增敏作用随浓度增加而增强,并伴随AKT 等靶基因的表达水平降低。这一结果提示,ASTL 通过影响AKT 信号通路介导宫颈癌细胞的辐射抵抗。且本研究结果发现,γ 射线照射后,ASTL 在细胞中的表达水平升高,并由细胞膜向细胞质转移。在今后的研究中,应进一步对照射后转移到细胞质的ASTL 蛋白功能开展研究,并且采用更为多样的实验方法进行评估,深入探究其机制。
综上所述,本研究结果证实ME-180 细胞的放射敏感性与ASTL 的表达水平相关,且照射后细胞的ASTL、AKT 表达水平升高,而人为中和ASTL后,ME-180 细胞抵抗辐射的能力降低,放射敏感性显著提高。因此,随着ASTL 对宫颈癌放射敏感性调控机制相关研究的深入,其或可作为治疗宫颈癌的新靶点,这具有非常重要的基础研究价值和临床意义,将为解决宫颈癌放疗中细胞辐射抵抗的难题奠定理论基础。
利益冲突本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明赵舒雅、李航负责实验的实施、论文的撰写;樊赛军负责课题设计的指导、论文的审阅与修改。
