基底节脑出血手术患者HbA1c、TNF-α、TIM-3 mRNA变化及其与预后的关系
2021-03-22范多娇董晓辉康燕婕李恒周
孙 鹏,范多娇,董晓辉,王 光,康燕婕,李恒周,范 涛
(1.保定市第二医院急诊医学科,河北 保定 071051;2.保定市第二医院科教科,河北 保定 071051;3.保定市第二医院神经外科,河北 保定 071051;4.保定市第二医院医务科,河北 保定 071051;5.首都医科大学三博脑科医院神经外科,北京 100093)
基底节是常见的脑出血部位之一,基底节脑出血约占脑出血的50%[1]。外侧裂入路手术是治疗出血量大于30 mL的基底节脑出血的有效方法之一,该方法能清除血肿,减轻血肿占位效应,提高患者生存率。但临床实践发现,外侧裂入路手术后不同患者预后效果存在较大异质性,因此明确其发生机制对于早期预测患者预后意义重大[2-3]。糖化血红蛋白(glycosylated hemoglobin,HbA1c)是红细胞中血红蛋白与血清中糖类相结合的产物,与蛛网膜下腔出血、缺血性脑卒中患者预后有关[4-5]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是一种促炎因子,在中风后预后不良患者中的表达高于预后良好的患者[6]。T细胞免疫球蛋白黏蛋白3(T cell immunoglobulin mucin domain containing molecules-3,TIM-3)是终末分化成熟的Th1细胞的跨膜蛋白,可调控Th1介导的免疫应答,在基底节脑出血患者超早期微创手术后表达降低,但是否与患者预后有关尚不明确[7-8]。目前关于基底节脑出血外侧裂入路手术患者围术期HbA1c、TNF-α、TIM-3 mRNA动态表达情况的报道鲜见,其对患者预后的影响仍有待观察。因此,本研究选取286例经外侧裂入路手术治疗基底节脑出血的患者,探讨HbA1c、TNF-α、TIM-3 mRNA动态变化及其与预后的关系,现报告如下。
1 资料与方法
1.1 临床资料
选取2015年6月至2020年3月保定市第二医院和首都医科大学北京三博脑科医院经外侧裂入路治疗的基底节脑出血患者286例进行研究。术后90 d采用改良Rankin量表(mRS)评估患者预后,并将其分为预后良好组(0~2分,n=234)和预后不良组(3~6分,n=52)。2组患者年龄、性别、BMI、发病至入院时间、饮酒史、吸烟史、入院时血压、合并疾病等基本资料均衡可比(P>0.05),见表1。纳入标准:①经影像学检查,脑出血位于基底节区;②拟行外侧裂入路手术治疗;③入组前未接受过脑出血相关治疗;④发病前无意识障碍、认知障碍。排除标准:①心、肝、肾功能不全;②中途更改手术方法;③由外伤、颅内肿瘤、颅内动静脉畸形等导致的继发性脑出血。本研究经两院伦理委员会审核通过,患者及家属对本研究知情并签署同意书。
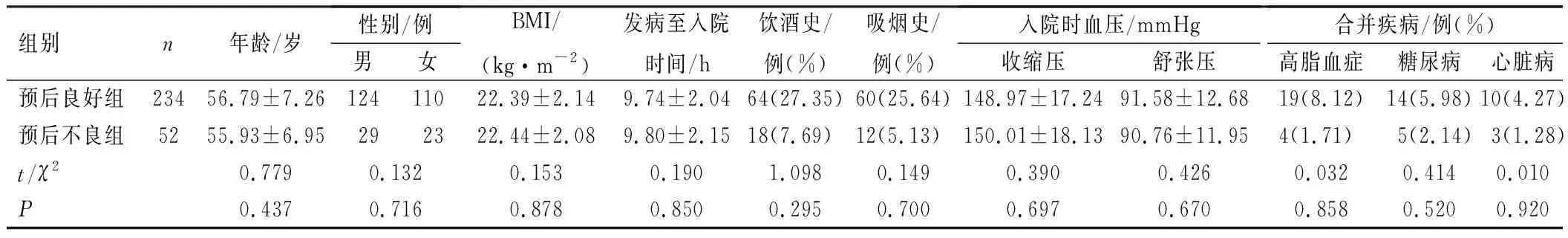
表1 患者临床资料比较
1.2 方法
血液指标检测:分别于术前、术后1 d、术后3 d、术后7 d采集患者肘部静脉血5 mL,采用免疫层析法检测HbA1c,采用酶联免疫吸附法检测血清TNF-α,采用实时荧光定量PCR法检测TIM-3 mRNA。
病情评估:采用美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)[9]评估患者神经功能缺损情况,评分范围为0~42分,分数越高,神经受损越严重;采用格拉斯哥昏迷评分(Glasgow coma scale,GCS)[10]评估患者意识状态,最高分为15分,分数越高,患者意识障碍越轻。
1.3 观察指标
比较2组患者术前、术后1 d、术后3 d、术后7 d的HbA1c、TNF-α、TIM-3 mRNA、NIHSS评分、GCS评分变化。采用Pearson相关分析法分析各血液指标与NIHSS评分、GCS评分的相关性。采用Logistic回归方程分析术前、术后7 d各血液指标与患者预后的关系。采用受试者工作特征曲线(receiveroperatingcharacteristic,ROC)及ROC下面积(areaunderthecurve,AUC)分析术前、术后7 d各血液指标预测预后的效能,以ROC分析各血液指标的截断值。采用卡普兰—迈耶(Kaplan-Meier,KM)生存曲线分析术前、术后7 d HbA1c、TNF-α、TIM-3 mRNA高危、低危患者的不良预后发生率,并采用LogRank(Mantel-Cox)进行检验。
1.4 统计学方法
2 结果
2.1 不同时间点HbA1c、TNF-α、TIM-3 mRNA比较
预后不良组术前、术后1 d、术后3 d、术后7 d的HbA1c、TNF-α、TIM-3 mRNA水平均高于预后良好组(P<0.05)。2组患者术前、术后1 d、术后3 d的HbA1c、TNF-α、TIM-3 mRNA水平均呈递增趋势,术后7 d预后良好组各指标较术前、术后1 d、术后3 d明显降低,预后不良组各指标则未见明显降低(P<0.05),见表2。
2.2 不同时间点NIHSS评分、GCS评分比较
预后不良组术前、术后1 d、术后3 d、术后7 d的NIHSS评分均高于预后良好组,GCS评分均低于预后良好组(P<0.05)。与术前相比,预后良好组术后1 d NIHSS评分、GCS评分无明显变化,术后3 d、术后7 d NIHSS评分呈降低趋势,GCS评分呈升高趋势(P<0.05),预后不良组各时间点NIHSS评分、GCS评分无明显变化(P>0.05),见表3。
表2 不同时间点HbA1c、TNF-α、TIM-3 mRNA比较
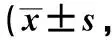
表3 不同时间点NIHSS评分、GCS评分比较分)
2.3 各血液指标与NIHSS评分、GCS评分的相关性
患者术前、术后1 d、术后3 d、术后7 d的HbA1c、TNF-α、TIM-3 mRNA水平与术前NIHSS评分均呈正相关,与GCS评分均呈负相关(P<0.05),但仅有术前、术后7 d的相关系数r>0.7,说明与其他时间点相比,术前、术后7 d各血液指标与NIHSS评分、GCS评分的相关性较强,见表4。
2.4 各血液指标与患者预后的关系
以预后不良为因变量,将Pearson相关性分析中r>0.7的各时间点HbA1c、TNF-α、TIM-3 mRNA水平作为自变量进行Logistic回归方程分析,结果显示,患者术前、术后7 d的HbA1c、TNF-α、TIM-3 mRNA水平较高与患者不良预后显著相关(P<0.05),见表5。
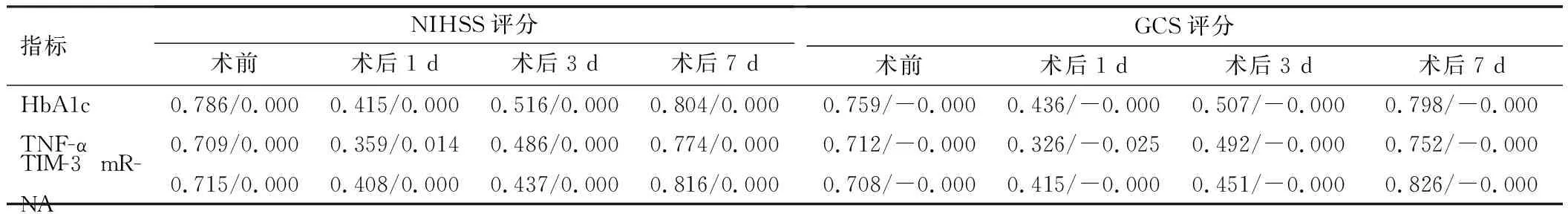
表4 各血液指标与NIHSS评分、GCS评分的相关性(r/P)
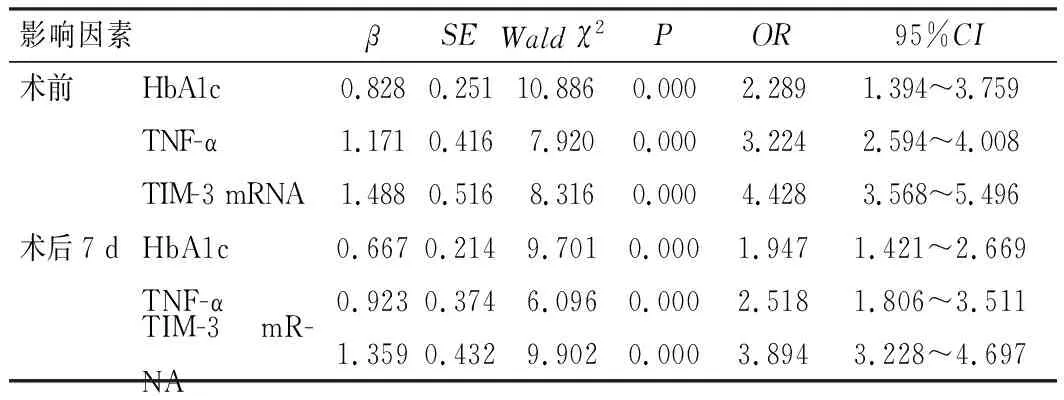
表5 各指标与患者预后关系的Logistic回归方程分析
2.6 术前、术后7 d各指标预测预后的价值
术前各指标联合预测不良预后的AUC为0.856,术后7 d各指标联合预测不良预后的AUC为0.881,术前HbA1c、TNF-α、TIM-3 mRNA预测预后的AUC分别为0.769、0.763、0.801,术后7 d分别为0.815、0.833、0.820,术前及术后7 d各指标联合预测结果高于任一单一指标的预测结果,差异具有统计学意义(P<0.05),见图1。
2.7 基于ROC曲线的预后分析
根据ROC分析HbA1c、TNF-α、TIM-3 mRNA最佳截断值,术前HbA1c>6.74%、TNF-α>82.84 pg/mL、TIM-3 mRNA>0.44的患者为高危患者,反之为低危患者;术后7 d HbA1c>7.28%、TNF-α>104.58 pg/mL、TIM-3 mRNA>0.55的患者为高危患者,反之为低危患者。KM生存曲线分析显示,术前高危患者不良预后发生率高于低危患者(χ2=28.474,P=0.000;χ2=13.336,P=0.000;χ2=12.372,P=0.000);术后7 d高危患者不良预后发生率高于低危患者(χ2=28.833,P=0.000;χ2=23.253,P=0.000;χ2=15.326,P=0.000),见图2。
3 讨论
3.1 研究意义
基底节脑出血具有发病率高、病情危重、致残率高、病死率高等特点,会极大程度降低患者的生活质量,危害患者生命健康[11]。近年来随着外侧裂入路等微创手术的发展,基底节脑出血患者术后病死率有所降低,但整体预后仍较差,因此有必要明确影响患者预后的相关因素及机制,以早期预测临床结局,并指导临床干预,最大程度改善患者预后。
3.2 围术期HbA1c变化及其与预后的关系
有研究发现,应激性高血糖与肝衰竭、2型糖尿病合并急性脑梗死等多种疾病的预后有关[12-13];王巧玲等[14]研究发现,血糖控制良好的高血压性基底节脑出血患者病死率低于血糖控制不良的患者;陈琰姝等[15]报道,与HbA1c低水平患者相比,HbA1c中、高水平患者术后90 d不良预后风险较高。以上研究均证实血糖会影响脑出血患者的预后。本研究对基底节脑出血患者HbA1c变化情况进行分析,结果显示,术前、术后1 d、术后3 d、术后7 d预后不良组HbA1c水平均高于预后良好组,且均与术前NIHSS评分呈正相关,与GCS评分呈负相关,提示HbA1c是基底节脑出血外侧裂入路手术患者不良预后的相关影响因素。且本研究发现,2组患者术前HbA1c较高,其原因可能是发病后急性期颅内压升高,下丘脑—垂体—肾上腺轴功能失调,促进皮质激素、皮质醇释放,影响机体糖代谢[16]。而术后1 d、术后3 d的HbA1c与术前相比均呈递增趋势,可能与手术引起的应激及病情综合作用有关。外侧裂入路手术后,持续升高的HbA1c可通过增加脑血管的血管源性脑水肿、促使机体代谢紊乱、增加血肿周围神经元凋亡等途径影响患者预后[17]。可见应重视脑出血患者围术期HbA1c的监测与控制,并给予恰当的干预,以改善患者预后。后续的ROC分析显示,术前、术后7 d HbA1c预测预后的AUC分别为0.769、0.815,提示监测HbA1c水平可预测预后,从而指导临床决策。
3.3 围术期TNF-α变化及其与预后的关系
中枢神经系统中,TNF-α多由炎症刺激单核细胞、巨噬细胞等产生,是一种重要的神经毒性递质[18]。基底节脑出血发生后,血肿周围神经细胞、血管等损伤诱发了炎症反应,造成TNF-α升高[19]。且基底节脑出血患者血脑屏障被破坏,大量TNF-α释放入血,会引起外周循环TNF-α的升高。术后早期受外侧裂入路手术创伤增加了炎症反应的影响,TNF-α进一步升高,至术后3 d基本达到峰值。本研究显示,预后良好组术后7 d TNF-α降低,而预后不良组未见明显降低,提示术后持续升高的TNF-α可能与患者不良预后有关,后续的相关性及Logistic分析均证实了这一结论。Zarruk等[20]报道,脑出血后预后不良的患者TNF-α高于预后良好的患者,本研究观点与之一致。其原因在于,过多的TNF-α会对脑组织造成炎症损伤,增加局部血管通透性和炎性细胞浸润,引起脑组织水肿,并诱导神经少突胶质细胞损害、神经细胞凋亡,从而影响脑出血患者的预后[21-22]。本研究显示,术前、术后7 d TNF-α预测预后的AUC分别为0.763、0.833,且以ROC分析最佳截断值,TNF-α高危和低危患者生存曲线差异显著,佐证了ROC分析数据预测预后的有效性,可为临床早期预测患者预后、制定治疗方案等提供参考。
3.4 围术期TIM-3 mRNA变化及其与预后的关系
TIM-3表达于Th1、CD8+T细胞、自然杀伤细胞等多种细胞表面,参与炎症相关疾病的发生与进展[23-24]。本研究显示,在校正了年龄、性别等因素影响后,术前、术后7 d TIM-3 mRNA仍与基底节脑出血外侧裂入路手术患者的不良预后有关。TIM-3 mRNA能通过激活Th1细胞增加巨噬细胞的数量和活性,提高巨噬细胞分泌TNF-α等炎症因子的能力,在脑出血早期,可在细胞毒性受体传递凝血级联反应与凝血酶作用下提高乳酸脱氢酶活性,增加血管内皮通透性和对血脑屏障的破坏,故在发病早期即升高[25]。Xu等[26]报道,自发性脑出血患者TIM-3 mRNA表达升高与其全身炎症反应和脑损伤有关。TIM-3 mRNA越高,介导的炎症反应越强,从而对脑组织的损伤越大;随着TIM-3 mRNA的递增,脑组织的坏死层、海绵层逐渐扩展至周围脑组织,使脑水肿范围扩大,并造成机械性压迫,引起局部压力增高、红细胞溶解,造成神经元毒性,从而影响患者预后[27-30]。因此重视基底节脑出血外侧裂入路手术患者围术期TIM-3 mRNA的监测,并采取一定措施,抑制炎症反应,降低TIM-3 mRNA,有助于改善患者预后。后续的ROC分析显示,术前、术后7 d TIM-3 mRNA预测预后的AUC分别为0.801、0.820,具有较高的预测价值。
3.5 结论
基底节脑出血病情复杂,变化迅速,通过某一时间点指标变化评估预后具有一定盲目性,故本研究对多个时间点进行动态观测,结果显示,基底节脑出血外侧裂入路手术围术期HbA1c、TNF-α、TIM-3 mRNA处于持续高水平状态的患者多存在预后不良的可能,且术前、术后7 d的HbA1c、TNF-α、TIM-3 mRNA水平与预后显著相关,术前及术后7 d检测患者的上述指标水平有望成为一个预测预后的可靠方法。此外,本研究发现,HbA1c、TNF-α、TIM-3 mRNA协同参与了病情的进展,并在围术期呈现出相似的变化特征,但受限于实际情况,尚未阐明HbA1c、TNF-α、TIM-3 mRNA的关联,且入组对象均为外侧裂入路手术患者,这一关系在其他手术入路中是否成立尚不明确,是本研究不足之所在,有待后续进一步探讨。