洛匹那韦/利托那韦致12 例新冠肺炎患者不良反应分析*
2021-03-20徐珽
曾 亚,徐珽
(四川大学华西医院药剂科,四川 成都 610041)
洛匹那韦/利托那韦(LPV/r =4 ∶1)为复方制剂,于2000年由美国食品药物管理局首次批准上市,2011年在我国作为人类免疫缺陷病毒(HIV)蛋白酶抑制剂上市,用于与其他抗反转录病毒药物联合治疗HIV 感染。洛匹那韦(LPV)通过抑制蛋白酶和阻止蛋白在感染细胞中的分裂而阻止HIV 病毒复制,从而导致病毒体功能丧失[1],其几乎全部由细胞色素P450 酶系CYP3A 代谢,单用血药浓度会迅速下降;利托那韦(RTV)不仅是蛋白酶抑制剂,还是强效CYP3A 酶抑制剂,可抑制LPV在体内的代谢,提高该药的血药浓度。与单用LPV 相比,400 mg LPV 与100 mg RTV 联用可使LPV 血药浓度时间-曲线下面积增加100 倍[2]。新型冠状病毒属β 属病毒,与2003年的严重呼吸急性综合征(SARS)病毒基因组序列有80%的相似度[3]。由此可推测,对SARS 病毒有效的治疗方案可能对新型冠状病毒肺炎(COVID-19)也有效。LPV 通过插入到SARS 病毒的蛋白,抑制其复制而发挥抗病毒作用。基于既往研究的快速系统评价结果发现,早期应用LPV/r 降低了SARS 患者的病死率,对于控制治疗后期并发症具有重要意义[4]。国家卫生健康委员会和国家中医药管理局联合发布的试行第三版至试行第七版《新型冠状病毒肺炎诊疗方案》[5 -9]均提出,可试用LPV/r 治疗COVID-19。但LPV/r 的药品不良反应(ADR)发生率较高,成为部分患者使用的限制因素,其ADR 表现为腹泻、恶心呕吐、三酰甘油(TG)升高、胆红素血症、肝药酶升高、皮疹等。为探讨LPV/r 致ADR 的规律和特点,本研究中回顾性分析我院2020年1月1日至3月15日使用LPV/r 的14 例COVID-19患者的临床资料,为临床合理用药提供参考。现报道如下。
1 资料与方法
1.1 资料来源
收集我院2020年1月1日至3月15日接受洛匹那韦利托那韦片(商品名克力芝,Abbvie Deutschland GmbH & CO.KG,进口药品注册证号H20170213,规格为每片含LPV 200 mg、RTV 50 mg)治疗出院的14 例COVID-19 住院患者的临床资料。其中,COVID-19 普通型13 例,COVID-19 轻型1 例,均规律服药,1次2片,1日2次。
1.2 ADR 评价方法及标准
根据2011年原国家食品药品监督管理局《药品不良反应报告和监测管理办法》(卫生部令第81 号)[10](以下简称《办法》)中的关联性评价标准,对发生ADR的病例进行关联性评价,将关联性评价结果为“肯定”“很可能”“可能”的病例纳入统计,并根据ADR 分类评价标准,分别统计新的、严重的ADR 病例。
1.3 统计学处理
采用Excel 软件统计、分析与归纳总结14 例患者在院期间的一般情况、用药情况、ADR 临床表现、实验室检查、ADR 处理及其转归等。
2 结果
2.1 患者一般资料
14 例使用LPV/r 的患者中有12 例发生ADR,均为已知ADR 类型,其出现与用药有合理的时间关系,停药后ADR 均消失或减轻,无停药后再次使用LPV/r 的数据。根据ADR 因果关系判断标准[10],12 例患者关联性评价结果为“很可能(100% )”。ADR发生率为85.71%(12/14)。12 例ADR患者的年龄为19 ~76 岁,平均(41.58±14.52)岁,41 ~50 岁患者的ADR 发生率最高。详见表1。12 例患者的用药疗程为3 ~20 d,平均(13.8±4.45)d,疗程超过10d 的患者占83.33%(10/12),不超过10 d 的患者占16.67%(2/12)。
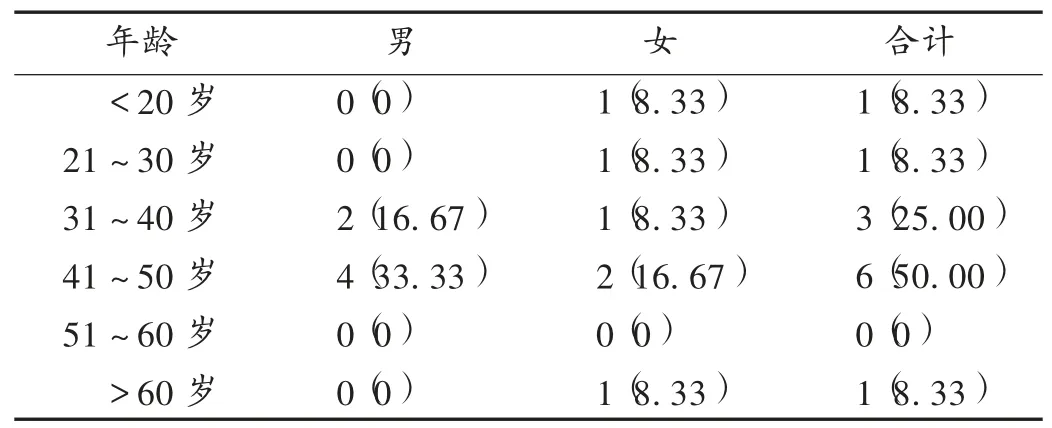
表1 不同年龄、性别患者ADR 发生情况[例(%)]Tab.1 Incidence of ADR in patients with different ages and genders [cases(%)]
2.2 ADR 累及系统/器官和临床表现
按照世界卫生组织《ADR 术语集累及系统/器官代码检索目录》[11]分类,12 例患者ADR 累及系统/器官包括皮肤及其附件损害、胃肠系统损害、肝胆系统损害、代谢和营养障碍。最常见的临床表现为高TG 血症(27.78% ),其次分别为腹泻(19.44%)、胆红素血症(13.89%)、恶心呕吐(11.11%)、肝药酶升高(11.11%)等。根据药品说明书和《办法》中的分类评价标准,未出现严重和新的ADR。详见表2。
2.3 ADR 临床表现
ADR 构成比≥10%患者的临床表现包括高TG 血症、腹泻、胆红素血症、肝药酶升高和恶心呕吐。其中,胆红素血症患者的平均年龄最小(19 岁),腹泻患者的平均年龄最大(76 岁);恶心呕吐患者的平均ADR 发生时间最短(2 例患者在用药后第2 天出现),高TG 血症患者的平均ADR 发生时间最长(1 例患者在用药10 d 后出现)。详见表3。
2.4 ADR 处理及其转归
ADR 处理包括停药、药物干预、停药并药物干预。12 例患者中,10 例患者在出院前治愈或好转,2 例患者在出院时血浆TG 仍高于正常值,无转归数据;超过1/2的患者在10 d 内治愈或好转。本研究中,药物干预包括胰酶肠溶片、蒙脱石散、双歧杆菌乳杆菌双联合菌、硫糖铝、法莫替丁、泮托拉唑、肝苏颗粒、非诺贝特;ADR 转归时间指从采取措施干预到ADR 转归的好转时间[10](包括实验室检查指标恢复正常或临床表现好转并稳定)。详见表4。

表2 ADR 累及系统/器官和临床表现(n =36)Tab.2 The involved systems/organs and clinical manifestations of ADR(n =36)
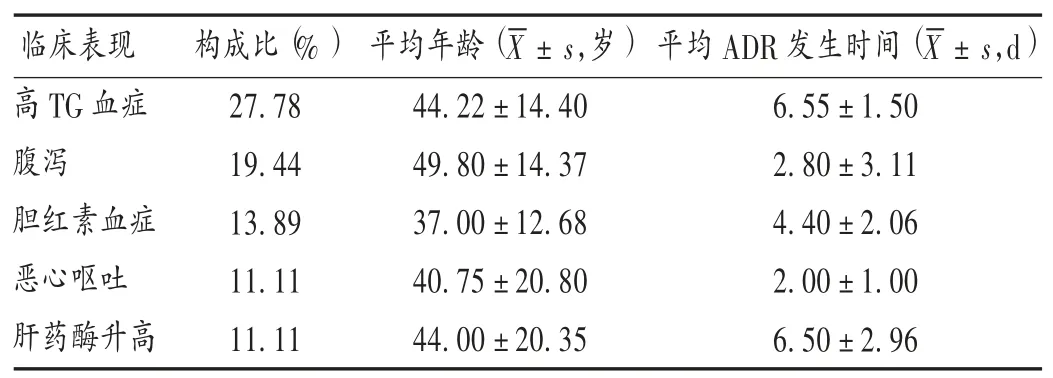
表3 ADR 构成比≥10%患者的基本情况(n =36)Tab.3 General data of patients with ADR constituent ratio ≥10%(n =36)
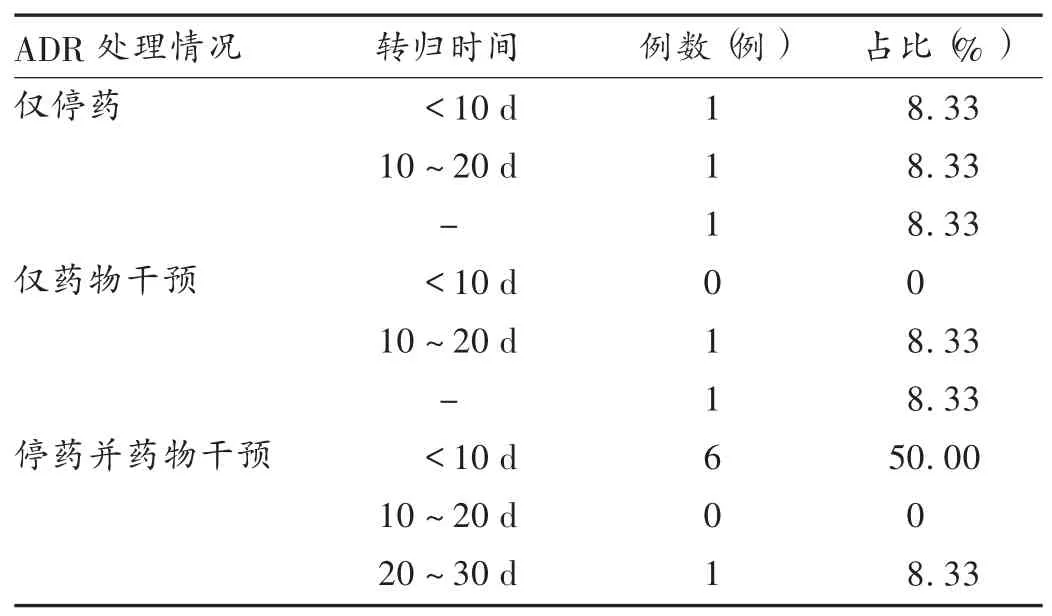
表4 ADR 处理及其转归情况(n =12)Tab.4 Treatment and outcome of ADR(n =12)
2.5 联合用药情况
12 例患者中,1 例患者仅使用LPV/r 单药治疗,2例患者联用1 种药物,1 例患者联用2 种药物,1 例患者联用3 种药物,7 例患者联用4 种及以上药物,最多联用8 种药物;联用最多的药物为抗感染药物。详见表5。因LPV/r 的使用与描述的ADR 出现有合理的时间关系,且符合该药已知的ADR 类型,停药后ADR 消失或减轻,故虽联用多种药物,但根据ADR 关联性评价[13],判定为LPV/r 所致ADR。
3 讨论
3.1 患者因素
由于收集到的ADR 病例数较少,本研究结果并不能得出LPV/r 致ADR 发生的人群特点。本研究中12例患者平均用药疗程为(13.8±4.45)d,1 例患者甚至用药20 d,使用LPV/r 的ADR 发生率为85.71%。余爱荣等[3]报道的中位疗程为6 d,ADR 发生率为27.8%。《新型冠状病毒肺炎诊疗方案》试行第六版[8]和试行第七版[9]均建议,LPV/r 使用疗程不超过10 d,故推测本研究中ADR 发生率较高可能与疗程过长有关。12 例患者平均年龄为(41.58±14.52)岁,高发人群集中在41 ~50 岁,可能与该疾病确诊患者年龄集中在40 ~60岁[14]、平均用药年龄为(47.67±16.20)岁[4]相关。男女比例为1 ∶1,提示ADR 发生率与性别无关。随着年龄的增长,肝、肾、心脏及骨髓造血功能下降,均会增加老年患者ADR 的发生率,且停药后转归较慢,故老年患者用药时必须严格遵照药品说明书用药,且应密切监护,出现不适应立即进行药物干预或停药。

表5 患者联合用药情况(n =47)Tab.5 Combination therapy for patients with ADR(n =47)
3.2 ADR 类型
代谢和营养障碍:LPV/r 引起的高TG 血症多在用药后2 周内发生[13]。本研究中平均发生时间为(6.55±1.50)d,最长的1 例在用药后第12 天出现。一项RTV对血脂水平影响的随机对照试验[13]发现,使用低剂量的RTV 联合LPV 等蛋白酶抑制剂引起的高脂血症比单用蛋白酶抑制剂更常见。使用LPV/r 出现高TG 血症可能大部分与RTV 相关。因此,推测其最可能的原因是由于极低密度脂蛋白及其残粒(颗粒更小的极低密度脂蛋白)增多。LPV 等蛋白酶抑制剂可能也与TG 增加有直接关系[15]。在使用LPV/r 前,建议先检测脂质基线水平,当基线TG >15.8 mmol/L、总胆固醇(TC) >31.3 mmol/L时,不建议使用LPV/r[16],故治疗过程中应密切监护血脂尤其是TG 的变化,若出现异常应及时处理。
肝胆系统损伤:LPV/r 引起的肝胆系统损伤多在1 ~8 周内发生[17]。本研究中胆红素血症平均发生时间为(4.40±2.06)d,肝药酶升高为(6.50±2.96)d。《肝毒性:药物性肝损伤的临床和研究信息》[18]详细描述了蛋白酶抑制剂的肝毒性主要有4 种表现形式,包括肝药酶、转肽酶、碱性磷酸酶等轻中度升高;胆红素轻度升高、黄疸;急性肝损伤,通常有自限性;慢性乙型或丙型肝炎恶化。产生原因可能是LPV/r 主要由细胞色素P450 系统代谢,可能产生了毒性中间产物。RTV 还是肝药酶抑制剂,可影响其他经肝药酶代谢的药物而产生毒性中间产物。肝毒性一般在停药后1 ~2 个月即可恢复,再次用药可能会复发。LPV/r 可加重乙型或丙型肝炎患者的病情,甚至出现急性肝衰竭或终末期肝病,应慎用。
胃肠系统损伤:LPV/r 较其他蛋白酶抑制剂更易引起胃肠系统损伤[18]。一项对92 例使用蛋白酶抑制剂治疗的获得性免疫缺陷综合征(AIDS)患者的随访研究发现,LPV/r 引起的腹泻是用药初期停药的主要原因[19]。本研究中腹泻平均发生时间为(2.80±3.11)d。药源性腹泻的可能原因包括胃肠道防御系统改变、肠道正常生理功能紊乱、肠道黏膜损伤及吸收不良。急性腹泻常为自限性,常在停药数天后停止,但严重腹泻对患者生活质量影响较大,可通过药物干预尽快改善,以提高患者用药依从性。
3.3 ADR 处理及转归
12 例患者ADR 的处理包括停药、药物干预、暂时观察及停药并药物干预,超过1/2 的患者在10 d 内治愈或好转。本研究中停药并药物干预的7 例患者中有6例在10 d 内好转,而仅停药或药物干预的5 例患者中仅1 例在10 d 内好转。可见,停药并积极药物干预对ADR 较快转归有帮助,但纳入例数太少,缺乏准确性。LPV/r 引起的高TG 血症、胆红素血症、肝药酶升高、腹泻、恶心呕吐等都是自限性的,若短时间使用,停药后可逐渐恢复正常水平[14,17,20],但用药期间持续腹泻、恶心呕吐对患者生活质量影响较大,为提高患者用药依从性,建议用药对症治疗。
3.4 联合用药
联合用药是导致患者发生ADR 的重要因素之一。联用种类越多,药物间发生相互作用的可能性越大,ADR 发生概率也增大[21]。本研究中91.67%的患者存在联合用药现象,与抗感染药联用的构成比达40.43%。6 例患者联用α-干扰素抗病毒治疗,6 例患者LPV/r 单药抗病毒治疗,与《新型冠状病毒感染的肺炎诊疗方案(试行第六版)》[8]中建议不同时使用3 种及以上抗病毒药物相符。一项随机双盲交叉对照试验[22]发现,小剂量RTV(200 mg)使1 mg 阿普唑仑的清除率降至单用阿普唑仑的41%,半衰期( t1/2)延长了2.3倍,提示应避免联用2 种药物。阿普唑仑主要经CYP3A4 代谢,而RTV 是CYP3A 酶的强抑制剂,两者联用时阿普唑仑血药浓度升高,可能出现严重的中枢神经系统抑制(过度镇静和呼吸抑制)。因此,临床用药过程中应密切关注LPV/r 的联合用药情况,尤其是与依赖CYP3A 代谢且治疗窗口较窄的药物联用时。
3.5 合理用药建议
目前尚无治疗COVID-19 的确切药物,国家卫生健康办公厅和国家中医药管理局办公室联合发布的《新型冠状病毒感染的肺炎诊疗方案(试行第七版)》[9]中推荐可试用的抗病毒药物仅有α-干扰素、LPV/r、利巴韦林(与α-干扰素或LPV/r 联合使用)、磷酸氯喹和阿比多尔。LPV/r 在COVID-19 治疗过程中的安全性与有效性[23]也得到认可,但其ADR 引起了临床重视。医师和药师应加强ADR 监测,严格掌握禁忌证与药物相互作用规律,明确患者基础疾病史、用药史及ADR 发生史,观察患者的临床表现,定期复查血脂水平、肝功能等指标,发生ADR 后及时处理,控制用药疗程,制订最佳治疗方案,以保障安全、合理用药。但本研究中样本量较少,后续将进一步收集病例并加以分析,为COVID-19的安全、有效治疗提供参考。
