特发性肺纤维化急性加重四例报道并文献复习
2021-03-19邹丽君范宇斌蒋国良孟婕
邹丽君 ,范宇斌 ,蒋国良 ,孟婕
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是临床最常见的一种特发性间质性肺炎,病变局限于肺部,组织病理表现为肺结构明显受损和纤维化,伴或不伴胸膜下蜂窝样改变;肺实质呈斑片状纤维化及出现纤维母细胞灶,患者主要临床表现为劳力性呼吸困难、干咳、Velcro啰音和杵状指[1]。IPF主要依据肺部高分辨CT(HRCT)和/或病理活检进行诊断,典型表现为普通型间质性肺炎(UIP)症状。IPF患者肺功能在1个月内急剧恶化称为IPF急性加重(AEIPF)。美国胸科学会(ATS)、欧洲呼吸学会(ERS)、日本呼吸学会(JRS)、拉丁美洲胸科学会(ALAT)声明提出,手术可导致AE-IPF发生[1]。参考2016年COLLARD等[2]修订内容,AE-IPF的诊断标准如下:(1)既往或目前诊断为IPF;(2)出现典型急性呼吸困难症状或症状恶化时间<1个月;(3)胸部CT检查提示UIP,并出现新的双侧磨玻璃影伴或不伴实变影:(4)可排除心力衰竭或液体超负荷。有研究表明,AE-IPF患者预后较差,生存期<1年,90 d内死亡率约为50%[3-5]。手术可引发AE-IPF,但目前国内仅报道3例[6-7]。本文通过报道4例AE-IPF患者的诊疗经过,并结合既往文献对AE-IPE进行分析,以提高临床医师对AE-IPF的认识。
1 病历简介
1.1 病例1 患者,女,59岁,因“咳嗽、气促1年余,再发加重1月余”于2018-12-18就诊于中南大学湘雅医院。患者于2018-10-22因咳嗽、气促于当地医院进行胸部HRCT检查,结果示UIP,见图1A;2018-10-26行外科胸腔镜下肺组织活检,病理结果示IPF,见图1B。故予以甲泼尼龙片20 mg、1次/d及吡非尼酮进行抗炎、抗纤维化等治疗。2018-11-14患者咳嗽、咳痰、气促明显加重,无发热、畏寒、寒战,为求进一步治疗就诊于本院。
患者入院时体温36.5 ℃、脉搏98次/min、呼吸频率23次/min、血压118/72 mm Hg(1 mm Hg=0.133 kPa),呈满月脸,急性病容,双肺呼吸音粗,可闻及Velcro啰音,杵状指。2009年曾行胆囊切除术,2015年曾行鼻息肉手术。无不良婚育史,无家族遗传病史。实验室检查:白细胞计数(WBC)10.3×109/L,中性粒细胞百分比(NE%)85.6%,淋巴细胞百分比(LYM%)6.1%;D-二聚体0.1 mg/L(参考范围<0.50 mg/L),C反应蛋白(CRP)、降钙素原(PCT)、红细胞沉降率(ESR)、N末端脑钠肽前体(NT-proBNP)、肌钙蛋白、心肌酶谱、1,3-β-D葡聚糖检测(G试验)、半乳糖甘露醇聚糖抗原检测(GM试验)、风湿及自身免疫性疾病检查未见明显异常,多次支气管灌洗液培养结果阴性,且复查胸部HRCT示双肺新发弥漫性磨玻璃影,见图1C,故诊断为AEIPF。予以甲泼尼龙琥珀酸钠240 mg、1次/d,治疗2 d后减量至80 mg、1次/d,持续治疗1周,吡非尼酮400 mg、3次/d。2018-12-29,患者复查胸部CT示双肺磨玻璃影较前吸收、好转,见图1D。患者病情稳定,于2018-12-31出院。出院后,患者继续口服泼尼松(1 mg/kg)并逐渐减量(每2周减量1片,后以5 mg/d维持),6个月后停用,患者2020年8月再发呼吸困难,于当地医院诊断为急性呼吸窘迫综合征,最终死亡。
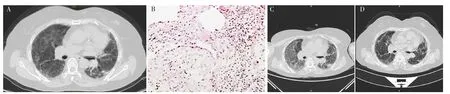
图1 患者1肺组织病理及胸部HRCT检查Figure 1 Pathological features of lung biopsy and chest HRCT examination of patient 1
1.2 病例2 患者,男,56岁,因“呕血、黑便9 d”于2019-09-11就诊于中南大学湘雅医院。患者9 d前无明显诱因出现呕血、黑便,于当地医院进行胃镜及病理活检,确诊为贲门唇腺鳞癌、胃窦低分化腺癌,故转入本院进一步治疗。患者入院时体温36.2 ℃,脉搏76次/min,呼吸频率15次/min,血压120/85 mm Hg,双下肺可闻及Velcro啰音。患者2年前确诊为IPF,但未进行治疗。吸烟史40年,20支/d,未戒烟。婚育史及家族遗传病史无特殊。胸部HRCT检查示UIP,见图2A,余检查未见异常。2019-09-25,患者行食管癌胃癌根治术;术后第3天,患者出现咳嗽、咳痰、呼吸困难,术后实验室检查:WBC 9.2×109/L,NE% 82.8%,LYM%10.5%;D-二聚体0.15 mg/L,CRP、PCT、ESR、G试验、GM试验、NT-proBNP、心肌酶谱、肌钙蛋白未见明显异常;多次支气管肺泡灌洗液培养及支气管灌洗液高通量测序结果均阴性,复查胸部HRCT示双肺新发广泛磨玻璃影,见图2B,考虑AE-IPF。予以环磷酰胺0.2 g、隔天1次+甲泼尼龙琥珀酸钠240 mg、1次/d+吡非尼酮200 mg、3次/d,但患者呼吸困难无明显好转,血氧饱和度逐渐下降,术后第20天氧合指数降至48 mm Hg,故给予气管插管+机械通气治疗,但患者症状及氧合仍无明显改善。2019-10-22,再次复查胸部HRCT示双肺磨玻璃影较前进一步扩大,见图2C。最终患者因呼吸衰竭于2019-10-27死亡。
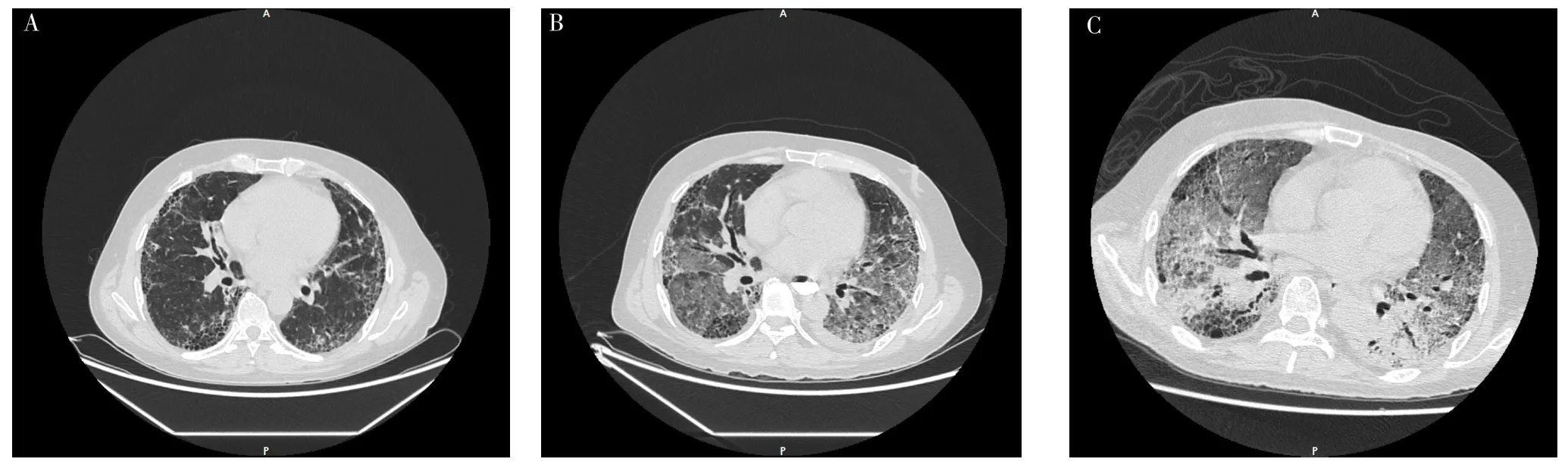
图2 患者2胸部HRCT检查Figure 2 Chest HRCT examination of patient 2
1.3 病例3 患者,男,72岁,因“胸痛1年余,发现右上肺肿块1个月”于2018-10-17就诊于中南大学湘雅医院。患者1年前无明显诱因出现胸背部间断钝痛,以右上部为甚,疼痛尚可忍受,与咳嗽、呼吸无关。伴活动后气促,偶有咳嗽,无咳痰、咯血、胸闷、心悸等不适,口服止痛药后缓解。1个月前患者胸痛加重,故就诊于本院。患者入院时体温36.0 ℃、脉搏78次/min、呼吸频率16次/min、血压128/87 mm Hg,双下肺闻及Velcro啰音,杵状指。既往有IPF病史1年,未用药治疗;吸烟史50年,30支/d,已戒烟1个月。婚育史及家族遗传病史无特殊。胸部HRCT检查示双下肺弥漫性网络状、蜂窝状改变,右上肺团片状密度增高影,见图3A、B,考虑肺癌。经皮肺穿刺确诊为角化型鳞癌,其他检查未见明显异常。2018-10-24,患者行胸腔镜下右上肺叶切除术,术后第5天患者憋喘明显并出现呼吸困难。术后实验室检查:WBC 10.7×109/L,NE% 76.2%,LYM% 15.8%;D-二聚体 0.08 mg/L,CRP、PCT、ESR、G试验、GM试验、NT-proBNP、心肌酶谱、肌钙蛋白未见明显异常;多次支气管肺泡灌洗液培养及支气管肺泡灌洗液高通量测序结果阴性。复查胸部HRCT示双肺新增广泛磨玻璃影,见图3C,诊断为AE-IPF。予以甲泼尼龙琥珀酸钠40 mg、1次/d,但患者出现呼吸困难进行性加重,术后第10天氧合指数降至56 mm Hg,故给予气管插管+呼吸机通气治疗。术后第12天,患者症状及氧合有所改善,复查胸部HRCT示双肺渗出灶吸收,见图3D。患者于2018-11-10出院,术后随访2年,患者病情平稳。
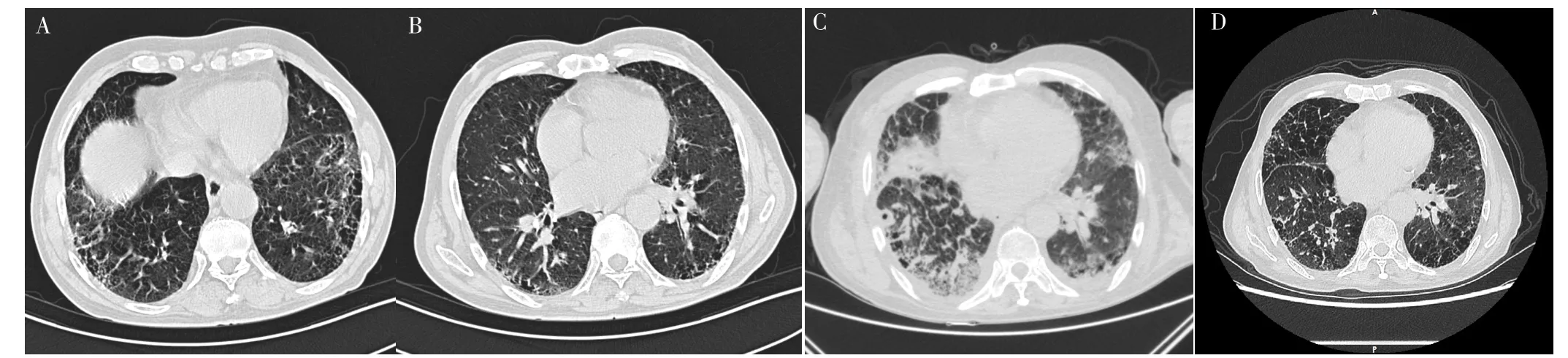
图3 患者3胸部HRCT检查Figure 3 Chest HRCT examination of patient 3
1.4 病例4 患者,男,62岁,因“发现肺结节17 d”于2019-05-27就诊于中南大学湘雅医院。患者17 d前体检时进行胸部CT检查,结果示右上肺结节,双下肺胸膜下可见条索影及网格影,见图4A、B,考虑早期IPF,为求进一步诊治就诊于本院。患者入院时体温36.2 ℃、脉搏73次/min、呼吸频率17次/min、血压120/77 mm Hg,双下肺可闻及少量Velcro啰音。既往有糖尿病病史8年、高血压病史10年。吸烟史40余年,60支/d,已戒烟2个月。婚育史、家族遗传病史无特殊。血、尿、便常规,肝肾功能,凝血四项,肺功能,心电图,心脏彩超等检查无明显异常,故于2019-05-29行胸腔镜下右上肺叶切除术。术后第4天,患者出现咳嗽、憋喘、气促,实验室检查:WBC 10×109/L,NE% 74.9%,LYM% 15.1%;D-二聚体 0.09 mg/L,CRP、PCT、ESR、G试验、GM试验、NT-proBNP、心肌酶谱、肌钙蛋白未见明显异常;多次支气管肺泡灌洗液培养及支气管肺泡灌洗液高通量测序结果阴性;复查胸部HRCT示双下肺网格影和弥漫性磨玻璃影明显增多,见图4C,诊断为AE-IPF。故予以甲泼尼龙琥珀酸钠40 mg、1次/d。患者呼吸困难及低氧血症无明显改善,术后第7天氧和指数降至103 mm Hg,故给予气管插管+呼吸机通气治疗。而后患者症状改善,胸部HRCT检查示磨玻璃影较前吸收,出现蜂窝样改变,见图4D。术后随访1年6个月,患者存在反复咳嗽、咳痰、气促,但并未入院治疗。
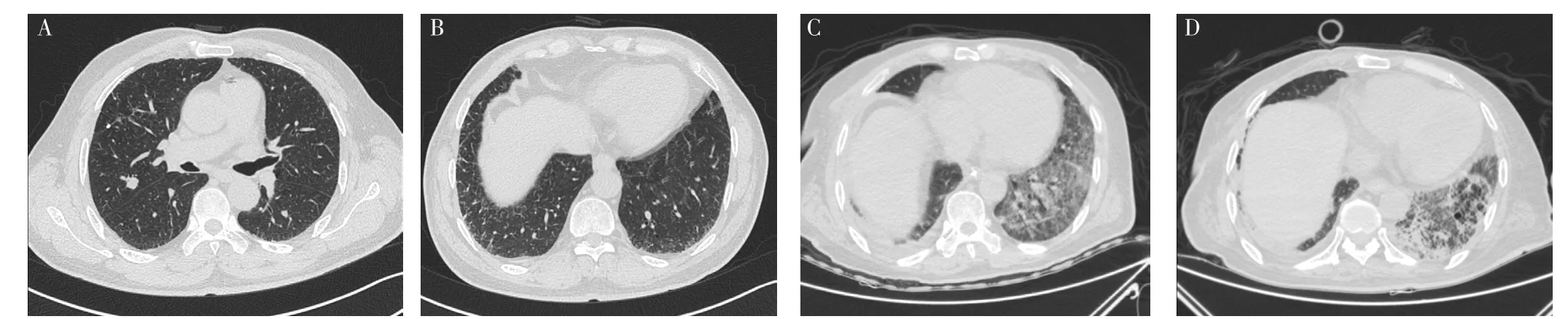
图4 患者4胸部CT及HRCT检查Figure 4 Chest CT and HRCT examination of patient 4
2 文献检索
以“急性加重”“特发性肺纤维化”“Acute exacerbation of idiopathic pulmonary fibrosis”为关键词,搜索中国知网、万方知识服务平台及PubMed数据库自建库至2020-12-30公开发表的AE-IPF病例。纳入临床资料较为齐全、符合IPF诊断标准且术后30 d内发生急性加重的病例,并排除有如肺部感染、胃内容物误吸、空气污染等明确诱因的病例,同时排除综述类、临床资料不全、重复发表的文献,最终纳入13篇文献[6-18],结合本文4例病例,共纳入45例患者,其中男43例,女2例;平均年龄(64.6±8.1)岁;手术类型包括肺部及非肺部手术;急性加重距手术时间为(9.0±8.1)d;死亡33例;死亡患者术后平均生存时间为(45.2±43.2)d,患者基本信息见表1。
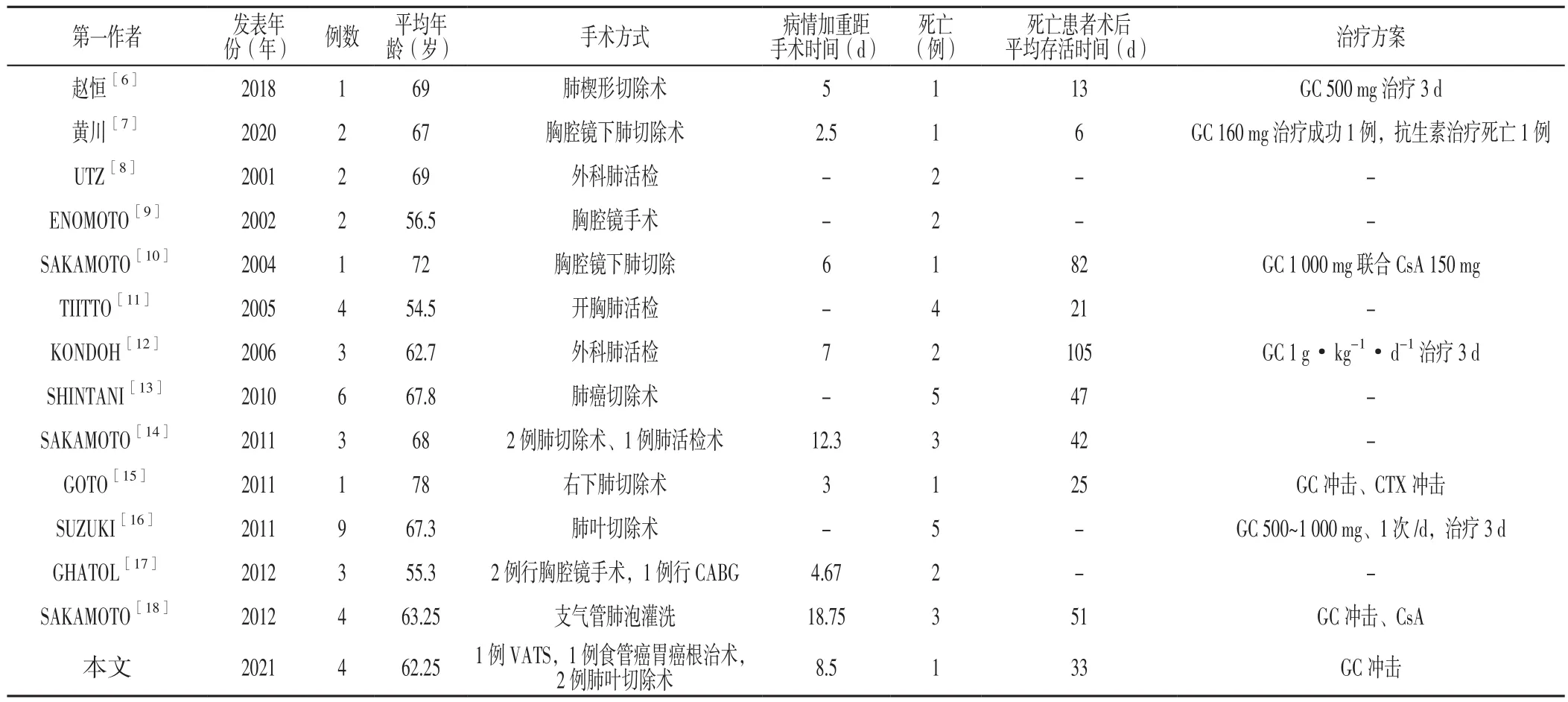
表1 AE-IPF患者基本信息Table 1 Basic information of AE-IPF patients
3 讨论
AE-IPF病因不明,临床表现为消化道症状在短期内出现急性、明显恶化。手术、感染、胃内容物误吸等可诱发AEIPF,其具体机制不明,可能与术中高气道压力对肺泡产生机械损伤有关[12,19]。本组患者1、2、3既往均有IPF病史,患者4于本院首诊IPF,术前均未行抗纤维化治疗,且4例患者支气管肺泡灌洗液培养和/或支气管肺泡灌洗液高通量测序结果均为阴性,故排除肺部感染,胸部影像表现可排除肺不张、肺水肿,且患者在病情加重时心肌酶、D-二聚体水平未升高,可排除心功能不全和肺栓塞的可能;术后1个月内出现明显呼吸困难、双肺新增广泛磨玻璃影,符合手术后AEIPF诊断。本组4例患者中女1例,无吸烟史;男3例,均有吸烟史,吸烟指数均>400;手术类型包括胸腔镜下肺活检、肺叶切除术、食管癌胃癌根治术。3例术前胸部CT表现为蜂窝肺,1例表现为网格影及索条影。急性加重新增磨玻璃影类型分为周边型、多灶型和弥漫型,其中周边型预后较好,多灶型次之,弥漫型预后最差[20]。本组患者1和患者2术后急性加重磨玻璃影为弥漫型,患者3为周边型,患者4为多灶型。患者1术后22个月再发AE-IPE死亡,患者2于围术期死亡,患者3、4存活。患者2死亡可能与基础肺纤维化程度重、单肺通气时间长、吸入氧浓度高、新增磨玻璃影范围大有关。本文文献复习结果显示,术后AE-IPF患者多为男性,多数在术后1周左右发病,且预后不良,多数在术后1年内死亡。
目前关于AE-IPF尚无推荐药物,有学者建议激素大剂量冲击治疗(甲泼尼龙≥0.6 mg/kg或1 000 mg/d,连用3 d),但糖皮质激素对AE-IPF患者预后无明显改善[21-22]。此外,也可选择甲泼尼龙联合免疫抑制剂治疗[23]。吡非尼酮为抗肺纤维化药物,一项Ⅱ期临床试验表明,围术期使用吡非尼酮(前2周600 mg/d,之后1 200 mg/d)可降低IPF患者肺癌术后急性加重发生率[24]。尼达尼布为一种酪氨酸酶抑制剂,可缓解IPF患者的肺纤维化进展及急性加重[25]。其他治疗包括抗菌药物的使用、多黏菌素B血液灌流、抑酸治疗等[26-27]。IPF稳定期可行肺移植治疗,急性加重状态下行肺移植风险大,且3年生存率较稳定期移植者低(90%比60%)[28]。应加强术中呼吸道管理,建议在适当麻醉下进行保护性机械通气[29]。与普通麻醉(PaO2维持100~300 mm Hg)相比,IPF手术时PaO2应尽量维持在100 mm Hg以下,潮气量控制在7~10 ml/kg,最大吸气压控 制在35 mm H2O(1 mm H2O=0.009 8 kPa)以下,这可预防机械通气引起的肺损伤[29]。围术期AE-IPF患者应尽量避免有创通气,建议采用高流量氧疗。俯卧位通气可改善氧合和防止呼吸机引起的肺损伤[30]。
研究表明,预测肺活量百分比<80.6%、一氧化碳弥散量(DLCO)<50%预测值、血清乳酸脱氢酶(LDH)>241 U/L、KL-6≥1 000 U/ml、既往有急性加重史及术前使用过激素类药物是术后AE-IPF发生的危险因素[13,31]。本组4例患者术前肺功能均正常,患者1术前有激素服用史,2次急性加重后死亡。
AE-IPF临床特点为术后1个月内患者出现快速进展的呼吸困难,胸部CT表现为在原有IPF影像改变基础上出现新的、双肺分布的磨玻璃影或实变影。对于IPF患者应充分做好术前准备及评估,严格遵循手术适应证,选择合适的手术方式,肺部手术应尽量减少肺野损伤范围。术后严密观察患者生命体征变化,如患者出现气促不适,应警惕AE-IPF的可能,及早干预治疗。可根据影像学评估患者预后,广泛的磨玻璃影、牵拉性支气管扩张及蜂窝状影提示预后不良[32]。目前术后AE-IPF的有效治疗方法尚需进一步研究探索。
作者贡献:邹丽君、孟婕进行文章的构思与设计;邹丽君进行文章的可行性分析,撰写论文;邹丽君、范宇斌进行文献/资料收集;邹丽君、蒋国良进行文献/资料整理;范宇斌、孟婕进行论文的修订;蒋国良进行英文的修订;孟婕负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。
