茶籽饼生物脱毒工艺的优化
2021-03-18管维詹逸舒李明红兰时乐管桂萍文金
管维 詹逸舒 李明红 兰时乐 管桂萍 文金


摘要 以茶籽饼中茶皂素降解率为主要指标,采用单因素试验和正交试验对嗜酸小球菌固体发酵茶籽饼的生物脱毒工艺条件进行了优化。结果表明,该菌适宜的生物脱毒工艺条件为茶籽饼粕85%、麦麸15%、葡萄糖3%、KH2PO4 0.1%、MgSO4·7H2O 0.15%、NaCl 3%、含水量70%、种龄24 h、发酵时间5 d、接种量20%、初始pH 6.0、发酵温度32 ℃,在此优化工艺条件下茶籽饼中茶皂素的降解率可达到68.42%,比优化前提高了57.13%。
关键词 嗜酸小球菌;茶籽饼粕;茶皂素;固态发酵
中图分类号 S816 文献标识码 A 文章编号 0517-6611(2021)04-0175-05
doi:10.3969/j.issn.0517-6611.2021.04.048
Optimization of Tea Seed Cakes Biological Detoxification Process
GUAN Wei1, ZHAN Yi-shu2, LI Ming-hong3 et al
(1. Market Supervision and Administration Bureau in Nanyue District of Hengyang City, Hengyang, Hunan 421900; 2.Livestock and Fisheries Affairs Center in Changning City,Changning, Hunan 421500; 3. Administration Bureau of Nanyue Hengshan National Nature Reserve, Hengyang, Hunan 421900)
Abstract Taking the degradation rate of tea saponin as the main index, the single-factor test and orthogonal test were used to optimize the biodetoxification process conditions of tea seed cake by solid fermentation of Pediococcus acidilactici. The results showed that the suitable detoxification process conditions of tea seed cake were as follows: 85% tea seed cake, 15% wheat bran, 3% glucose, 0.1% KH2PO4, 0.15% MgSO4·7H2O, 3% NaCl, 70% water content, seed age 24 h, inoculation amount 20%, initial pH 6.0, fermentation temperature 32 ℃.Under these conditions, the degradation rate of tea saponin in tea seed cake reached 68.42%, which was 57.13% higher than before optimization.
Key words Pediococcus acidilactici;Tea seed cake;Tea saponin;Solid state fermentation
作者简介 管维(1986—),女,湖南衡阳人,工程师,硕士,从事质量检验工作。
收稿日期 2020-06-15
茶籽饼,又称为茶粕、茶枯,是油茶果实榨油后剩下的渣滓[1]。据国家统计局统计,2010年我国油茶种植面积达到200余万hm2,年产油茶籽109万t,油茶籽粕70多万t[2]。但是,由于茶籽饼粕中含有茶皂素等毒性物质以及单宁、粗纤维等抗营养成分,限制了其在动物饲料中的应用范围。目前主要采用物理法、化学法、微生物发酵法[3-9]以及综合法对茶籽饼粕进行脱毒处理,常用的方法有化学法与微生物发酵法[10]。其中,茶籽饼粕微生物发酵脱毒国内外进行了研究。丁丽霞[3]以油茶粕为研究对象,以茶皂素含量为指标,利用黑曲霉对油茶粕进行固态发酵降解茶皂素,在最优工艺条件下降解率达到89.99%。练杰等[11]利用黑曲霉、枯草芽孢杆菌的混合菌对茶籽饼粕进行固态发酵,在最优工艺条件下可使茶籽粕的茶皂素降解率约为93.28%。黄浦[12]利用混菌液态发酵降解茶皂素,在最佳条件下进行混菌液态发酵试验,结果表明混菌降解茶皂素的降解率为(73.76±0.63)%。王小姣等[13] 对饲用嗜酸小球菌液体生料发酵工艺研究,结果表明液体生料发酵技术适合于饲用嗜酸小球菌的生产。
笔者以茶皂素降解率为考察指标,对茶籽饼进行微生物固体发酵脱毒工艺进行了研究,首先通过单因素试验法优化发酵培养基的组成(茶籽饼与麦麸的比例、葡萄糖添加量、KH2PO4添加量、MgSO4·7H2O添加量)及发酵条件(含水量、发酵时间、接种量、初始pH、种龄),然后选取对发酵影响显著的因素进行正交优化。该研究优化了茶籽饼生物脱毒工艺条件,为微生物发酵茶粕饲料提供了发酵工艺条件,为使茶籽饼成为一种优良的蛋白饲料资源打下了坚实的基础。
1 材料与方法
1.1 材料
1.1.1 菌种。
试验菌种为嗜酸小球菌(Pediococcus acidilactici),聯合湖南农业大学生物科学技术学院微生物实验室对衡阳市荆田湾农业开发有限公司提供的自然堆放的茶籽饼粕原料进行筛选所得的菌种。
1.1.2 主要试剂。
茶皂素标准品(98.2%茶皂素)购自陕西帕尼尔生物科技有限公司;茶籽饼、麦麸(市场购得,无霉变与虫蛀)、葡萄糖、NaCl、MgSO4·7H2O、MnSO4·4H2O、柠檬酸二铵、无水乙酸钠、吐温-80、香草醛、甲醇(AR级)、浓 H2SO4、牛肉膏、蛋白胨(BR级,上海盛思生化科技有限公司);酵母膏(BR级,上海天鹅啤酒有限公司);琼脂、酵母抽提粉。
1.1.3 主要仪器与设备。
紫外可见分光光度计(752型,上海光谱仪器有限公司);恒温水箱(SHHW21.420AII,天津市泰斯特仪器有限公司);台式低速离心机(TDZ4,湖南赫西仪器装备有限公司);高速多功能粉碎机(TYSP-400A,浙江省永康市红太阳机电有限公司);超声波清洗机(JCX-250W,山东济宁超声电子仪器厂);电子天平(KF型,浙江凯丰集团有限公司)。
1.1.4 培养基。
1.1.4.1
MRS培养基(培养嗜酸小球菌)。蛋白胨1%、牛肉膏1%、酵母膏0.5%、葡萄糖2%、吐温80 0.1 mL、K2HPO4 0.2%、醋酸钠0.5%、柠檬酸二铵0.2%、MgSO4·7H2O 0.058%、MnSO4· 4H2O 0.025%、蒸馏水100 mL,pH 6.2~6.6,115 ℃下灭菌25 min。
1.1.4.2
基础液体发酵培养基。茶皂素15.0 g、葡萄糖5 g、蛋白胨5 g、KH2PO4 2 g、MgSO4·7H2O 1 g、酵母抽提粉3 g,蒸馏水1 000 mL,pH 7.2~7.5,121 ℃下灭菌25 min。
1.1.4.3
基础固体发酵培养基。茶籽饼粕90%、麦麸10%、葡萄糖4%、KH2PO4 0.15%、MgSO4·7H2O 0.1% 、NaCl 3%,pH 7.5,固水比1∶0.5。
1.2 方法
1.2.1 种子液初步培养及固体发酵培养。
1.2.1.1
种子液初步培养。将斜面菌种接种于种子液培养基中,于30 ℃﹑160 r/min 条件下培养24 h,备用;嗜酸小球菌接种于MRS培养基中,在培养温度37 ℃的恒温培养箱中静置培养24 h,备用。
1.2.1.2
种子液固体发酵培养。在250 mL三角瓶中装入50 g 固体发酵培养基(以干基计),采用接种量为10%(V/w),将培养好的种子液接入基础固体发酵培养基中,32 ℃恒温培养5 d。
1.2.2
固体发酵样品茶皂素降解率的测定。采用香草醛-浓硫酸法[14-15]测定固体发酵样品茶皂素的降解率。按照以下公式计算茶皂素降解率:茶皂素降解率=(发酵后茶皂素浓度/发酵前茶皂素浓度)×100%。
1.2.3 固体发酵培养基的优化。
保持基础培养基其他组成不变,采用单因素试验法,依次改变培基的茶籽饼与麦麸的添加比例(95∶5、90∶10、85∶15、80∶20、75∶25)、葡萄糖添加量(2%、3%、4%、5%、6%)、KH2PO4添加量(0.05%、0.10%、0.15%、0.20%、0.25%)、MgSO4·7H2O添加量(0.05%、0.10%、0.15%、0.20%、0.25%),等量接种种子液培养液于固体发酵培养基中进行固体发酵。测定发酵前后茶籽饼中茶皂素浓度,以茶皂素降解率为指标,优化筛选不同茶籽饼与麦麸的比例、葡萄糖添加量、KH2PO4添加量、MgSO4·7H2O添加量等对菌种降解茶皂素的影响。每个处理3个平行。
1.2.4 固体发酵条件的优化。通过改变影响发酵的条件,测定发酵前后茶籽饼中茶皂素的浓度,以茶皂素降解率为考察指标,在“1.2.3”优化培养基的基础上,考察含水量、发酵时间、初始pH、接种量以及种龄对茶皂素降解率的影响,研究最佳固体发酵条件。每个处理3个平行。
在单因素试验的基础上,采用正交试验法[10]设计用含水量、初始pH、接种量、种龄等对嗜酸小球菌降解茶皂素影响较大的因素进行4因素3水平正交试验。正交试验因素与水平设计见表1。
1.2.5 数据处理。试验数据均使用WPS Office 软件进行误差分析。
2 结果与分析
2.1 茶籽饼茶皂素含量的测定
利用香草醛-浓硫酸方法绘制茶皂素标准曲线(图1),得到线性回归方程y=0.610 7x+0.010 5,R2=0.992 8,表明茶皂素浓度与吸光度的线性关系良好。采用香草醛-浓硫酸方法测得茶籽饼1 g中含茶皂素0.174 5 g,即茶皂素含量为17.45%。
2.2 固体发酵培养基的优化
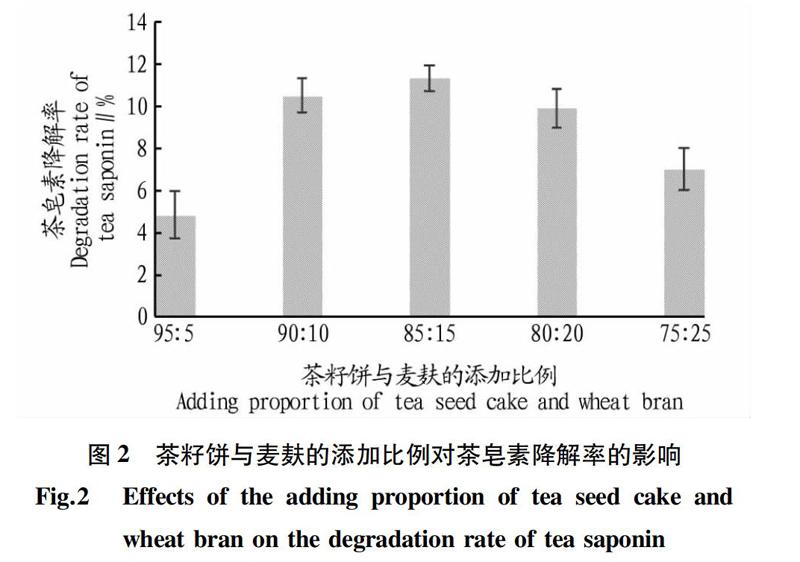
2.2.1 茶籽饼与麦麸的添加比例。
改变培养基中茶籽饼与麦麸的添加比例(95∶5、90∶10、85∶15、80∶20、75∶25)在其他條件不变的情况下,32 ℃恒温发酵5 d,80 ℃烘干后测定培养基中的茶皂素含量并计算茶皂素的降解率,结果见图2。从图2可以看出,当茶籽饼与麦麸的添加比例为85∶15时,茶皂素降解率最高(11.29%)。在一定范围内,茶皂素降解率随茶籽饼比例的增加而增大,说明茶皂素的增加在一定范围内能够加强菌体的生长繁殖能力,但当茶籽饼所占比例过大时,培养基中的茶皂素浓度高,对菌体的生长代谢起抑制作用,从而影响对茶皂素的降解率。因此,选择茶籽饼与麦麸的添加比例为85∶15,用于后续研究。
2.2.2 葡萄糖添加量。
在其他条件不变的情况下,改变培养基中葡萄糖的添加量,32 ℃恒温发酵5 d,80 ℃烘干后,测定培养基中的茶皂素含量并计算茶皂素的降解率,结果见图3。从图3可以看出,当葡萄糖添加量为2%~3%时,茶皂素降解率随葡萄糖添加量的增加而增加;当葡萄糖添加量为3%时,茶皂素降解率达到33.07%,但当葡萄糖添加量大于3%时,茶皂素降解率显著且持续下降。究其原因,可能是由于培养基中碳含量过高或过低,从而使培养基中的碳氮比例失调,导致菌体生长代谢能力下降。因此,选择3%作为葡萄糖的最佳添加量。
2.2.3 KH2PO4添加量。
在其他条件不变的情况下,改变培养基中KH2PO4添加量,32 ℃恒温发酵5 d,80 ℃烘干后测定培养基中的茶皂素含量并计算茶皂素的降解率,结果见图4。从图4可以看出,在一定范围内,茶皂素降解率随KH2PO4添加量的增加而增加,当KH2PO4添加量为0.1%时茶皂素降解率达到41.38%,但当KH2PO4添加量超过0.1%茶皂素降解率随着KH2PO4添加量的增加而下降。磷是微生物细胞中核蛋白、核酸、ATP、磷脂、辅酶等的重要原料,能保持细胞内ATP代谢的平衡,参与调节体内的酸碱平衡,参与体内能量的代谢。若培养基中磷含量不足,会影响微生物的代谢生长速度,但若磷含量超过微生物生长代谢的需要量,则会对微生物的生长起抑制作用。因此,选择0.1%作为KH2PO4的最佳添加量。
2.2.4 MgSO4·7H2O添加量。
改变培养基中MgSO4·7H2O的添加量(0.05%、0.10%、0.15%、0.20%、0.25%),其他條件保持不变,32 ℃恒温发酵5 d,80 ℃烘干后测定培养基中的茶皂素含量并计算茶皂素的降解率,结果见图5。从图5可以看出,在一定范围内,茶皂素降解率随MgSO4·7H2O添加量的增加而增加,当MgSO4·7H2O添加量为0.15%时茶皂素降解率最高(48.83%)。镁参与能量代谢、蛋白质和核酸的合成及催化酶的激活和抑制等。若培养基中镁含量过低,会导致细胞膜和核糖体的稳定性降低,对微生物营养的吸收与蛋白质的合成产生影响,从而影响机体的正常生长代谢;若镁含量过高,则会对微生物生长代谢起抑制作用。因此,选择0.15%作为MgSO4·7H2O的最佳添加量。
2.3 固体发酵条件的优化
2.3.1 含水量。在上述筛选出的培养基配方的基础上,改变培养基的含水量,培养后测定茶皂素含量并计算茶皂素降解率,结果见图6。从图6可以看出,当含水量为40%~70%时,茶皂素降解率随着含水量的增加而增加。当含水量为70%时茶皂素降解率最大,达到60.97%;当含水量超过70%时,茶皂素降解率显著降低。茶籽饼遇水易凝结,含水量过高的培养基易结块,菌体生长会受到抑制;当含水量过低时,培养基比较松散,不能给菌体提供适宜的生长环境。固体培养基的含水量是构成微生物生长代谢环境的重要因素,因此选择70%作为培养基的最佳含水量。
2.3.2 发酵时间。
不同发酵时间对茶皂素降解率的影响如图7所示。从图7可以看出,发酵初期随着时间的增加,茶皂素降解率逐渐增加,当发酵时间为5 d时茶皂素降解率基本不发生变化,即培养基经过5 d发酵后,茶皂素降解率趋于稳定。因此,选择5 d作为后续研究的发酵时间。
2.3.3 接种量。
不同接种量对茶皂素降解率的影响如图8所示。由图8可知,不同接种量对茶皂素降解率影响显著。当接种量为15%时,茶皂素降解率最大,达到66.19%;当接种量小于15%时,茶皂素降解率随接种量的增加而增加;当接种量大于15%时,茶皂素降解率随接种量的增加而降低。若接种量过大,发酵前期菌体总数大,菌体大量生长使营养物质消耗过快,且液体种子液的副产物过多,导致发酵延滞期延长,从而引起相同的发酵周期茶皂素降解率降低。因此,选择15%作为最佳接种量,用于后续研究。
2.3.4 初始pH。
不同初始pH对茶皂素降解率的影响如图9所示。从图9可以看出,初始pH对菌体生长代谢的影响显著,在一定范围内随着培养基初始pH的升高,茶皂素降解率随之增加。当初始pH为6.5时,茶皂素降解率最大,达到67.85%。不同的微生物都有适合生长的pH范围及最适生长pH,嗜酸小球菌的生长pH偏酸性范围,试验表明当初始pH处于酸性范围内时,培养基中的茶皂素降解率大于初始pH处于碱性范围内;若初始pH过高或过低则会影响菌体内酶的活性和稳定性,影响营养物质的溶解度及微生物对营养的吸收。因此,选择6.5作为培养基的最佳初始pH。
2.3.5 种龄。
不同种龄对茶皂素降解率的影响如图10所示。从图10可以看出,当种龄为24 h时,茶皂素降解率最大,达到68.65%。当种龄较低时,菌体处于延滞期,导致细胞增长速率过慢,从而延长了延滞期;当种龄偏高时,菌体老化,菌种活力减弱,代谢产物增多,从而延长了发酵周期。因此,选择24 h作为最佳种龄。
2.3.6 正交试验。
采用正交试验法,选择对茶皂素降解率影响较大的因素(含水量、初始pH、接种量、种龄)进行4因素3水平L9(34)正交试验。正交试验结果见表2。
由表2可知,根据极差R大小可知,各因素对茶皂素降解率的影响从大到小依次为含水量、初始pH、种龄、接种量。试验条件下最优组合为A3B1C3D2。发酵培养基的最优组合为茶籽饼85%、麦麸15%、葡萄糖3%、KH2PO4 0.1%、MgSO4·7H2O 0.15%、含水量70%,最佳培养条件为初始pH 6.0、接种量为20%、种龄为24 h、发酵时间5 d、发酵温度32 ℃。在此工艺条件下,茶皂素降解率达到68.42%,比优化前提高了57.13%。
3 结论与讨论
微生物发酵法是茶籽饼粕降解的主要方法,被认为是目前发展潜力最大的茶籽饼粕脱毒处理方法。其原理是在茶籽饼粕中添加微生物进行发酵,使添加的微生物在发酵培养基上大量生长并同时将茶皂素分解利用,从而降低茶皂素的含量,达到去毒的目的。微生物在发酵过程中产生包括酶、促生长因子以及抗菌物质等有益的代谢产物,同时降低了茶籽饼粕中的单宁和纤维素等抗营养因子,加上使用的发酵微生物菌种本身是动物益生菌,能起到改善动物肠道微生态平衡的作用。
该试验以茶籽饼为原料,对茶籽饼生物脱毒及其发酵工艺进行研究。通过单因素试验和正交试验考察了茶籽饼粕添加量、碳源、氮源、无机盐种类及添加量、含水量、初始pH、种龄、接种量、发酵时间等因素对茶皂素降解率的影响,优化了发酵培养基的组成及发酵条件,最终得到最佳脱毒工艺条件。
该试验结果表明,在茶籽饼脱毒过程中含水量与初始pH是影响茶皂素降解率的关键因素,茶籽饼与麦麸的添加比例85∶15、葡萄糖3%、KH2PO4 0.1%、MgSO4·7H2O 0.15%、含水量70%,最佳培养条件为初始pH 6.0、接种量20%、种龄24 h、发酵时间5 d、发酵温度32 ℃。在此条件下茶皂素降解率为68.42%。在此工艺条件下,固态发酵培养基配制完成后无需灭菌,这在一定程度上降低了能耗,且操作简单,对设备要求低,降低了生产成本,为茶籽饼生物脱毒技术的推广提供了技术支持。
参考文献
[1] 王娅玲,李维峰,桂花,等.超声辅助纤维素酶提取茶粕中茶皂苷的工艺研究[J].安徽农业科学,2017,45(2):97-99.
[2] 国家统计局.中国统计摘要[M].北京:中国统计出版社,2011.
[3] 丁丽霞.油茶粕中茶皂素的降解及其利用研究[D].长沙:中南林业科技大学,2012.
[4] 马力,陈永忠,彭邵锋,等.发酵油茶枯饼生产蛋白饲料的混合菌种的筛选[J].中国农学通报,2011,27(16):57-60.
[5] 李君君.高效降解茶粕纤维素菌株的筛选[D].合肥:安徽农业大学,2010.
[6] 田璨熙,吴永尧,娄立起,等.茶籽饼降解菌的筛选及降解条件优化与发酵效果的研究[J].湖南农业科学,2011(15):23-26.
[7] 王建濤.茶皂素降解菌筛选鉴定、降解条件优化及在发酵茶粕饲料中的应用[D].南昌:南昌大学,2012.
[8] 李萌萌.微生物发酵法脱除茶籽饼粕中茶皂素的研究[D].上海:华东师范大学,2014.
[9] 周浩宇,黄凤洪,钮琰星,等.发酵法与化学法改良油茶籽粕品质效果的比较[J].中国油脂,2010,35(9):40-43.
[10] 秦艳,李卫芬,黄琴.枯草芽孢杆菌发酵条件的优化[J].饲料研究,2007(12):70-74.
[11] 练杰,金青哲,王兴国.油茶籽粕微生物发酵研究进展[J].中国油脂,2012,37(7):24-26.
[12] 黄浦.混菌液态发酵降解茶皂素的试验研究[D].桂林:桂林理工大学,2016.
[13] 王小姣,杜全能,陈思宇,等.饲用嗜酸小球菌液体生料发酵工艺研究[J].中国饲料,2017(21):16-20.
[14] 陈莹,刘松柏,何良兴,等.油茶籽粕和茶皂素中皂苷的定量检测方法研究[J].中国粮油学报,2012,27(2):105-111.
[15] 谷子,文汉.用分光光度法测定油茶皂素的含量[J].安徽农业科学,2006,34(14):3262-3264.
