原水水质对输送管道中含氮污染物转化和生物膜的影响
2021-03-18薛如冰刘志刚周正协顾艳梅
薛如冰,刘志刚,周正协,陈 卫,许 航,顾艳梅
(1. 河海大学浅水湖泊综合治理与资源开发教育部重点实验室,江苏南京 210098; 2.河海大学环境学院,江苏南京 210098; 3.宁波市自来水有限公司,浙江宁波 315041)
含氮污染物是我国地表水源中主要的污染物之一。水源水中含氮污染物的组成复杂,有机氮与无机氮在化学、水生动植物或微生物作用下可以相互转化[1-2]。水中氮素的迁移转化包括硝化、反硝化、厌氧氨氧化、同化等,受微生物、pH、溶解氧(DO)、有机质含量、水温等多种因素的共同影响[3-4]。原水输送管道是城镇给水系统的主要组成部分,输送过程中含氮污染物之间的相互转化直接关系到水处理技术效能及其水质安全。
原水水质直接影响原水输送管道内微生物的新陈代谢,同时对管道内DO的消耗产生影响,从而进一步影响管壁生物膜的群落结构及管道内含氮污染物的转化。已有研究表明:在供水管网中,水中的磷浓度和UV254的增加会促进管壁生物膜中异养菌的生长[5-6];悬浮颗粒能够附着水中的营养物质,从而促进微生物的生长,因此,水体的浑浊度越高,管道中异养菌的数量也越多[7]。高炜[8]在对长度为45 km的原水管道中水质指标变化的研究后发现,原水在长距离输送过程中存在硝化反应,氨氮的平均去除率达75%,亚硝酸盐氮的含量下降60%左右,而反应生成的硝酸盐氮浓度上升约20%,同时,高锰酸钾指数(CODMn)的平均去除率在37%左右。陈桃源等[9]采用不同管材对原水管道进行模拟,研究发现,油漆内衬管中的硝化反应较水泥内衬管更为明显,且出水中的小分子溶解性有机氮(DON)更多,但管材对出水中DON的亲疏水性的影响不明显。
前人对管道中含氮污染物的转化规律已经做了初步研究,但大部分研究多集中于供水管道以及单一水源下原水管道中的污染物含量变化。因此,为了考察不同水质下成熟生物膜中生物量、生物相的区别,并探究不同水质条件下原水管道中含氮污染物的转化规律,本文使用实际水源水建立原水输送管道的模拟系统,分析水质对生物膜及其对含氮污染物生物作用的影响,为原水输送过程中水质净化和用水安全保障提供技术支持。
1 试验材料和方法
1.1 试验装置及水质
选用某市水源水A和水源水B为试验装置进水,采用2台正态水力模型的原水输送管道模拟装置对真实管道进行模拟,管材选用油漆内衬的钢管,如图1所示。通过控制电机和时控开关,使2台试验装置内的水流速度以及水力停留时间一致,水力停留时间均为6 h。对管道内的生物膜进行自然培养。装置连续运行5个月以上,使生物膜达到成熟。试验期间2种水源水的水质指标如表1所示。

图1 原水输送管道模拟装置图Fig.1 Analog Device Diagram of Raw Water Diversion Pipeline

表1 试验原水水质Tab.1 Raw Water Quality of Experiment
1.2 分析方法
1.2.1 水质指标测定
本研究所涉及的常规水质指标检测方法参考《生活饮用水标准检验方法》(GB/T 5750—2006)和《水与废水监测分析方法》(第四版)的相关分析方法析。DO浓度采用JPB-607 A 便携式DO分析仪进行测定,浑浊度采用HACH 2100P浊度仪测定,TP采用孔雀绿—杂钼多分光光度法,TN采用耶拿multi N/C ©3100 TOC/TN分析仪。
1.2.2 溶解性有机氮(DON)测定
DON的分子量分布和亲疏水性分别采用超滤膜法[10]和树脂吸附法[11]进行测定和计算。树脂采用Amberlite DAX-8和Supelite DAX-4树脂。
1.2.3 微生物指标测定
生物膜及水中的异养菌(HPC)计数采用R2A培养基培养法进行计数,分别以单位体积菌液中的细菌数(CFU/mL)和单位面积的细菌数(CFU/cm2)表示。
1.2.4 微生物种群检测
采集的管壁生物膜最初保存在4 ℃的条件下,将DNA在1 h内分离。采用OMEGA基因组提取试剂盒(D5626-01 E.Z.N.A.Soil DNA Kit)对生物膜样品的总DNA进行提取和纯化。利用DNA检测试剂盒Qubit 2.0对提取到的DNA精确定量,以确定PCR反应体系中应加入的DNA量。PCR所用引物融合了Miseq测序平台V3~V4区的通用引物,引物序列为341F:CCCTACACGACGCTCTTCCGATCTG (barcode) CCTACGGGNGGCWGCAG;805R:GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTACHV-GGGTATCTAATCC。采用2轮共30个循环进行PCR扩增。PCR扩增反应结束后,将PCR产物进行琼脂糖电泳,对DNA进行回收。然后,利用Qubit2.0 DNA检测试剂盒对回收得到的DNA精确定量,将样品按照1∶1等量混合后,采用Illumina MiSeq 测序平台对基因组进行测序。测序完成后,对数据进行分析处理。
2 结果与分析
2.1 生物膜中的生物量比较
生物膜中的生物量可以间接反映管道内污染物转化的程度。在管壁生物膜培养期间每4 d对2套模拟装置内生物膜中的HPC数量进行检测,数量变化如图2所示。由图2可知,培养期间,2套装置内管壁生物膜中HPC的生长趋势基本一致,均经历了适应期、对数生长期、脱落期和稳定期4个阶段,但其数量存在明显的差异。2套装置内生物膜中HPC的数量均在运行的50 d左右达到最大值,其中,装置1(以A水源水为进水)中HPC的最大值达到4.28×105CFU/cm2,装置2(以B水源水为进水)中HPC的最大值达到2.5×105CFU/cm2,随后生物膜进入脱落期。待管壁生物膜进入稳定期后,装置1内管壁生物膜中的HPC稳定于2.60×105~4.00×105CFU/cm2,装置2内管壁生物膜中的HPC稳定于1.35×105~2.16×105CFU/cm2。

图2 不同水质条件下管壁生物膜中HPC的数量Fig.2 Counts of HPC from Biofilm under Different Raw Water Quality Conditions
结果表明,原水输送管道中的原水水质会影响管壁生物膜中微生物的数量,原水营养水平高和悬浮HPC数量多的管道中微生物的数量也相应更高,但在2种水质下,管壁生物膜中的HPC数量处于同一个数量级,且差异不大。
2.2 生物膜中微生物群落差异
2.2.1 微生物种群组成
对2套模拟管道装置中成熟的生物膜(150 d)进行宏基因组测序,得到生物膜中微生物在门水平下的种群分布,如图3所示。其中,装置1代表以A水源水为进水的模拟管道装置,装置2代表以B水源水为进水的模拟管道装置。

图3 不同原水水质下管壁生物膜中细菌种群组成(门水平)Fig.3 Bacterial Communities in the Biofilm under Different Raw Water Quality Conditions (Phylum Level)

因此,在不同原水水质的情况下,原水输送管道内壁生物膜中优势菌门基本一致,但各菌门含量有所不同,功能菌门的存在水平可能会影响管道中含氮污染物的转化情况。
2.2.2 微生物群落多样性差异
稀疏曲线可以用来评估样品中微生物群落的多样性,2组模拟管道装置成熟管壁生物膜中的微生物稀疏曲线如图4所示。其中,样品1代表A水源水培养的成熟生物膜,样品2代表B水源水培养的成熟生物膜。

图4 成熟管壁生物膜中的微生物稀疏曲线Fig.4 Sparsity Curve of Microorganisms in Mature Biofilm

2.3 含氮污染物的转化

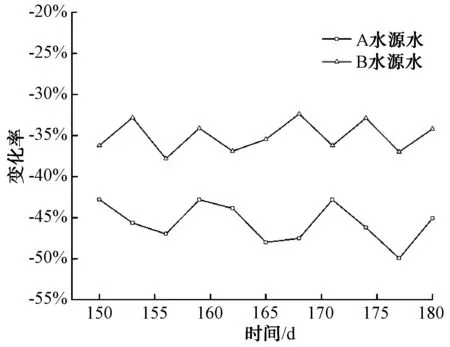
图5 不同原水水质下的含量变化Fig.5 Concentration Changes of under Different Raw Water Quality Conditions

图6 不同原水水质下的含量变化Fig.6 Concentration Changes of under Different Raw Water Quality Conditions

图7 不同原水水质下的含量变化Fig.7 Concentration Changes of under Different Raw Water Quality Conditions



2.3.2 DON含量的变化
管壁生物膜生长成熟期间,A水源水和B水源水中的DON浓度,即2组模拟装置的进水DON浓度分别为0.290~0.927 mg/L和0.050~0.413 mg/L。当管道生物膜成熟稳定后,2组装置出水中的DON浓度均有一定程度的增加,但增加量有所不同,浓度变化率如图8所示。模拟管道1出水中的DON浓度较进水增加了53.8%~78.6%,而模拟管道2出水中的DON浓度较进水增加了28.0%~43.6%。

图8 不同原水水质下DON的含量变化Fig.8 Concentration Changes of DON under Different Raw Water Quality Conditions
模拟管道出水中的DON含量比进水中高的原因之一在于,生物膜中的微生物在生长过程中,会产生大量的可溶性代谢产物(SMPs)[19],随着微生物代谢作用的不断加强,越来越多的SMPs被释放到水中,导致模拟管道出水中的DON含量上升。此外,微生物的胞溶作用也会向水中释放不可生物降解的DON(NBDON)[20]。给水系统中的一些研究表明,DON是含氮消毒副产物的重要前提物[21],也会促进微生物的生长,成为膜阻塞的重要原因[22]。由图2可知,装置1的管壁生物膜中HPC的数量明显高于装置2,因此,导致原水在输送过程中释放更多的DON。此外,由2.2.1的结论可知,装置1生物膜中拟杆菌门的含量为24.36%,高于装置2中的14.68%,而拟杆菌门具有将高分子有机物降解为小分子物质的能力[14],这也解释了模拟管道1的出水中具有更高比例的DON,此结果与Chen[18]的研究结果相符,即拟杆菌门的丰度与DON生成率之间存在正相关关系,即当拟杆菌门的丰度越高,越多的DON被释放。
2.3.3 DON分子量分布及亲疏水性差异
水源水中组成DON的有机物种类有所不同会使其分子量分布和亲疏水性存在差异,2套不同原水的模拟管道中进出水DON分子量分布及亲疏水性变化分别如图9和图10所示。由图9可知,A、B两种水源水中DON分子量分布均以中小分子(<5 kDa)为主,且小分子的DON所占比例相近,分别为62.2%~76.0%和65.1%~69.0%,这与我国微污染水源中DON的组成规律相符[23-25]。由图10可知,2种水源水中的DON多为亲水性,A水源水与B水源水中亲水性DON所占比例分别为57.6%~64.2%和55.5%~62.9%。

图9 不同原水水质下DON分子量分布的变化 (a)装置1;(b)装置2Fig.9 Molecular Weight Distribution for the Fractions of DON under Different Raw Water Quality Conditions(a) Device 1;(b) Device 2
通过研究模拟管道进出水中DON分子量分布变化,发现水质较差的装置1管道出水中小分子DON所占比例大幅度上升,达到84.6%~94.1%,而水质较好的B水源水管道出水中小分子DON所占比例为73.7%~84.3%。以A水源水为原水的管道出水中出现如此高比例的小分子DON与该管道生物膜中含有高丰度的拟杆菌门密切相关[14]。
通过对比进出水中DON亲疏水性变化,发现2套模拟装置出水中DON亲疏水性相差不大,亲水性DON的比例分别为72.8%~80.2%和69.3%~74.3%。研究显示,在管道输送的过程中,小分子亲水性DON比例的上升是由于藻类和细菌代谢产物的释放[26],而小分子亲水性DON也是含氮消毒副产物的重要前体物[27]。Amy[28]的研究也发现,藻类生长繁殖而分泌出的氨基酸、氨基糖、缩氨酸和蛋白质等亲水性物质使得水体中DON的亲水性组分有所增加。A水源水中的藻类物质较B水源水多,导致原水在输送过程中产生了更多比例的亲水性DON物质。
3 结论

当模拟装置中的管壁生物膜培养成熟并处于稳定期后,装置1(以A水源水为原水)内管壁生物膜中的HPC数量为2.60×105~4.00×105CFU/cm2,装置2(以B水源水为原水)内管壁生物膜中的HPC数量为1.35×105~2.16×105CFU/cm2,即原水水质影响管壁生物膜中微生物的数量,且原水营养水平高的管道中微生物的存在水平也相应较高。虽然原水水质条件有所不同,但管道内壁生物膜中优势菌门基本一致,然而各优势菌门的含量不同,功能菌门的存在水平可能会影响原水输送管道中含氮污染物的转化状况。在生物多样性方面,水质好的原水会促成原水管道内更为丰富的微生物多样性,管道内的生态系统也更为稳定。
