右美托咪定对体外循环后围术期神经认知障碍老龄大鼠海马HPA轴和BDNF-ERK-CREB信号通路的影响
2021-03-18綦欣竹毛安琼李正芬袁雪梅
綦欣竹,毛安琼,李正芬,袁雪梅,刘 庆,张 英
0 引言
1 材料与方法
1.1 动物选择 实验动物的应用及实验程序得到西南医科大学实验动物中心实验动物应用管理委员会同意。选择老龄健康雄性SD大鼠[生产许可证编码:SCXK(川)2013-17]120只,18~20月龄,体重400~550 g,采用随机数字表法分为4组(n=30):对照组(C组)、体外循环组(T组)、体外循环+右美托咪定组(D组)、体外循环+生理盐水组(NS组)。C组大鼠不做任何处理,T组大鼠仅建立体外循环模型,D组大鼠腹腔注射50 μg/kg右美托咪定后同T组,NS组大鼠腹腔注射等剂量的生理盐水后同T组。
1.2 建立体外循环动物模型 采用50 mg/kg戊巴比妥腹腔注射麻醉大鼠,待翻正反射消失后,行气管插管,调节呼吸机参数,监测大鼠生命体征。分离腹壁内前动脉、尾动脉和右颈内静脉,以腹壁内前动脉监测动脉血压,以尾动脉和右颈静脉建立CPB。CPB主要由蓄血器、滚泵和实验动物膜肺静脉组成。预充液为4 ml,由乳酸林格氏液、6%羟乙基淀粉、甘露醇、碳酸氢钠按11∶7∶1∶1的比例组成。当激活凝血时间(ACT)>480 s时,CPB开始。开始灌注流量为20~40 ml/(kg·min),逐渐增加至160~180 ml/(kg·min)。平均血流保持在100~120 ml/(kg·min),平均动脉压维持在60/100 mmHg。经过90 min的流动,停止CPB,剩余的机器预充血或胶体流体被返回。然后注射1 mg鱼精蛋白,拔除导管,缝合血管和切口。手术后,使用电热垫和温控灯使大鼠体温维持在37 ℃。
1.3 行为学测定 老龄大鼠于体外循环后3 d、5 d、7 d,进行行为学测定。
1.3.1 Morris水迷宫实验 参考文献[9]进行水迷宫实验。Morris水迷宫测试采用直径为160 cm、高度为50 cm的水池。水深31 cm,温度保持在23 ℃。水池被分成4个大小相等的象限,每个象限的墙壁上都有一个独特的彩色图案作为参考。在目标象限中心放置直径为9 cm、高度为30 cm的圆形平台,淹没在水面以下1 cm处。大鼠在导航试验前1天被放入水池中,游2 min以适应迷宫。在每一次试验中,大鼠都被引入一个迷宫,在4个指定的起点之一面对墙壁。迷宫上方放置了一台连接电脑的摄像头,记录游泳轨迹、总游泳距离和寻找平台的时间。如果大鼠在120 s内没有找到平台,则记录潜伏期为120 s。实验结束后,这些大鼠被放置在平台上15 s,以便学习和记忆。每只老鼠每天接受4次测试,每一次的起点都不同,试验之间有30 min的休息时间。实验持续5 d,记录平均潜伏期和总距离,使用上海吉亮动物行为分析系统进行分析。在最后一次位置导航测试24 h后,平台被移除,老鼠被允许自由游泳120 s,每只动物游1次。在120 s的时间框架内记录逃避潜伏期和穿越原平台次数。使用ANY-maze系统5.26 (Stoelting Co.,Wood Dale,IL,USA)对计算机上运行的行为指标进行实时自动记录时间和运动路线数据的分析。
1.3.2 穿梭箱实验 参考文献[10]进行穿梭箱实验。箱体由两个相等的隔间(50 cm×25 cm×25 cm)组成,中间有一个黑色的有机玻璃隔板,隔板底部有一个正方形的开口(9 cm×9 cm),可以在隔间之间自由移动。两个隔间都配备了位于上侧壁的光源(15 W)和网格地板,网格地板由19根不锈钢棒串联到主控制模块(Letica LI-2900,西班牙),能够在每个隔间中独立地提供连续的、紧急的电击。大鼠在连续15 d的10次试验中进行测试。每只大鼠置于同一个隔间里,在实验开始前有5 min的探索时间。每个试验包括1个10 s的警告信号和一个灯泡(条件刺激,CS),接着是1个3 s 0.3~0.5 mA的电击(非条件刺激,UCS)和25个50 s的试验间隔。在CS期间,大鼠移动到盒子的另一边即认为是做出了回避反应。那些在3 s UCS期逃脱电击的大鼠视为有逃脱反应。对主动回避反应次数、主动及被动回避反应潜伏期进行分析。
1.3.3 旷场实验 参考文献[11]进行旷场实验。使用高为45 cm、底为40~40 cm的黑色盒子,盒子中心上方有1个4 W的冷光源。动物活动记录使用上海吉亮动物行为分析系统(上海,中国)。慢病毒注射后1周进行行为测试。将大鼠置于野外中央,利用红外摄像系统和视频合成器记录其在光照条件下的活动。利用计算机分析系统分析运动轨迹。分析的行为变化包括总爬行距离、尾数和活动。每次实验后,用75%的酒精溶液清洗盒子内部,去除老鼠身上的气味,以免影响下一只大鼠的行为。每只大鼠实验结束后均将其粪便及尿液清理干净,并用75%酒精擦拭场地3次。
1.4 采用酶联免疫吸附测定法(ELISA)测定大鼠血浆中促肾上腺皮质激素释放激素(CRH)、促肾上腺皮质激素(ACTH)和皮质醇(CORT)浓度 各组大鼠行为学测试结束后,随机选取5只大鼠,抽取心脏血2 ml,置于肝素管内,6 ℃条件下3 000 r/min离心15 min后取血浆,分装置于-80 ℃保存待测。在室温下,将样品和稀释液加入孔中,生物素抗体加入孔中,洗涤后加入HRP和生物素显色液,最后加入终止液。在450 nm波长下测定各孔的吸光度(OD)。
1.5 采用蛋白印迹法(Western blot)检测大鼠海马BDNF、ERK及CREB蛋白的表达 各组大鼠行为学测试结束后,随机选取5只大鼠,采取静脉血后,取海马。随后,用10% SDS-PAGE分离蛋白。使用PageRuler Plus预染色蛋白梯子(Thermo Fisher Scientific,Inc.)作为蛋白标记加载,并估计样品的分子量。蛋白被转移到聚偏氟乙烯(PVDF)膜上。室温下5%脱脂乳封闭2 h后,将PVDF膜与以下一抗孵育,兔BDNF多克隆抗体(稀释度1∶1 000,Biorbyt公司,英国)、兔ERK多克隆抗体(稀释度1∶800,Santa Cruz公司,美国)、兔CREB多克隆抗体(稀释度1∶1 000,Biorbyt公司,英国)、β-actin(稀释度1∶2 000,Santa Cruz公司,美国),在4 ℃过夜。然后将膜与适当的辣根过氧化物酶(HRP)标记的山羊孵育,加入辣根过氧化酶标记的二抗(1∶6 000,北京中杉金桥科技公司)室温摇床孵育1 h,膜与化学发光底物孵育后显影照相,在室温下1 h。最后,用化学发光法观察条带。每个实验重复6次。用Quantity one 图像分析软件(美国Bio Rad公司)测定BDNF、ERK及CREB蛋白的表达。
1.6 采用免疫组化SP法检测海马BDNF、ERK及CREB的阳性神经元计数 各组大鼠行为学测试结束后,随机选取5只大鼠,取大鼠海马组织。参照说明书步骤进行操作:在海马区随机选择8个视野,用显微镜图像分析系统下的目镜,400倍显微计数,计算海马BDNF、ERK及CREB的阳性细胞的平均数。
北京城什剎海前海南头,煤灰土新垫就一片场坪,白日照着,有一圈没事可做的闲人,皆为一件小小热闹粘合在那里。

2 结果
2.1 Morris水迷宫测试逃避潜伏期和穿越原平台次数 与C组比较,T组、D组、NS组大鼠术后各时点逃避潜伏期延长,穿越原平台次数减少(P<0.05);与T组、NS组相比较,D组大鼠术后各时点逃避潜伏期缩短,穿越原平台次数增加(P<0.05);与术前比较,T组、D组、NS组大鼠术后各时点逃避潜伏期延长,穿越原平台次数减少(P<0.05);T组与NS组术后各时点逃避潜伏期和穿越原平台次数比较差异无统计学意义(P>0.05),见表1。

表1 四组大鼠术后各时点逃避潜伏期和穿越原平台次数的比较
2.2 穿梭箱实验测试主动回避反应次数及主动及被动回避反应潜伏期 与C组比较,T组、D组,NS组大鼠术后各时点主动回避反应次数减少,主动及被动回避反应潜伏期延长(P<0.05);与T组、NS组相比较,D组大鼠术后各时点主动回避反应次数增加,主动及被动回避反应潜伏期缩短(P<0.05);与术前比较,T组、D组、NS组大鼠术后各时点主动回避反应次数减少,主动及被动回避反应潜伏期延长(P<0.05);T组与NS组,术后各时点主动回避反应次数及主动、被动回避反应潜伏期差异无统计学意义(P>0.05),见表2。
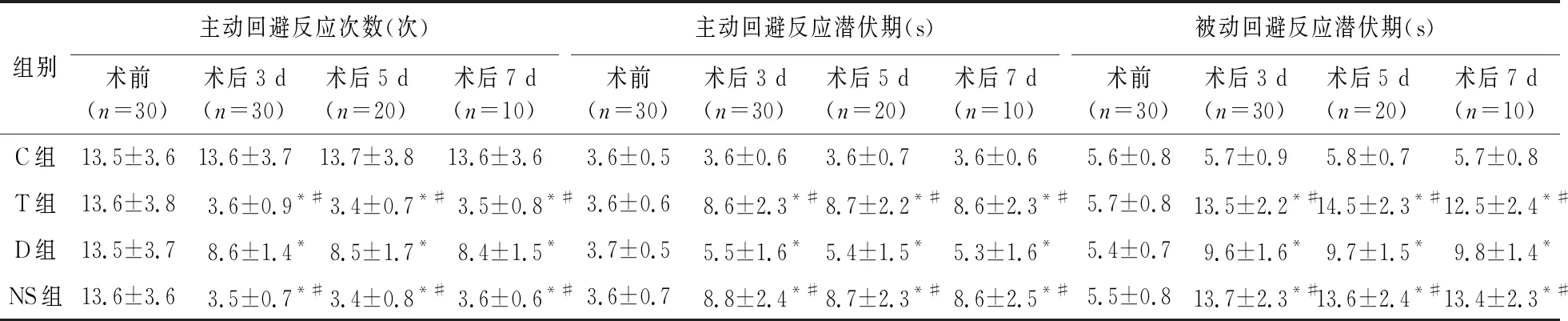
表2 四组大鼠术后各时点主动回避反应次数及主动、被动回避反应潜伏期比较
2.3 旷场实验测试直立次数和中央格停留时间 与C组比较,T组、D组、NS组大鼠术后各时点直立次数减少,中央格停留时间延长(P<0.05);与T组、NS组相比较,D组大鼠术后各时点直立次数增多,中央格停留时间缩短,差异均有统计学意义(P<0.05);与术前比较,T组、D组、NS组大鼠术后各时点直立次数减少,中央格停留时间延长(P<0.05);T组与NS组术后各时点直立次数和中央格停留时间差异无统计学意义(P>0.05),见表3。

表3 四组大鼠术后各时点直立次数和中央格停留时间比较
2.4 采用酶联免疫吸附测定法(ELISA)测定大鼠血浆中CRH、ACTH和CORT浓度 与C组比较,T组、D组、NS组大鼠术后各时点血浆中CRH、ACTH和CORT浓度升高(P<0.05);与T组、NS组相比较,D组大鼠术后各时点血浆中CRH、ACTH和CORT浓度降低(P<0.05);T组与NS组术后各时点血浆中CRH、ACTH和CORT浓度差异无统计学意义(P>0.05),见表4。
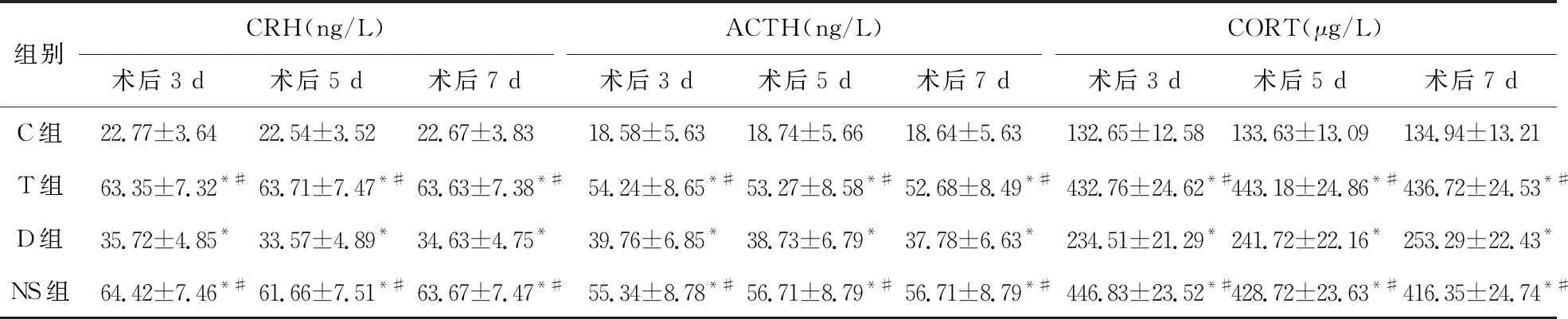
表4 四组大鼠术后各时点血浆中CRH、ACTH和CORT浓度的比较(n=5)
2.5 Western-blot检测大鼠海马BDNF、ERK及CREB蛋白的表达 与C组比较,T组、D组、NS组大鼠术后各时点海马BDNF、ERK及CREB蛋白的表达降低(P<0.05);与T组、NS组相比较,D组大鼠术后各时点海马BDNF、ERK及CREB蛋白的表达升高(P<0.05);T组与NS组术后各时点海马BDNF、ERK及CREB蛋白的表达差异无统计学意义(P>0.05)。见表5。
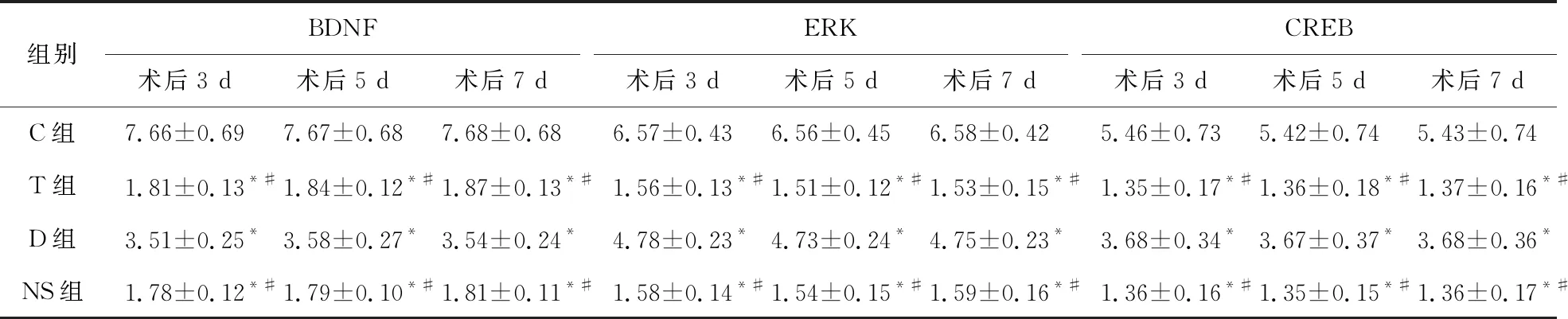
表5 四组大鼠术后各时点海马BDNF、ERK及CREB蛋白的比较(n=5)
2.6 采用免疫组化法检测海马BDNF、ERK及CREB蛋白的阳性神经元计数 与C组比较,T组、D组、NS组大鼠术后各时点海马BDNF、ERK及CREB蛋白的阳性神经元计数降低(P<0.05);与T组、NS组相比较,D组大鼠术后各时点海马BDNF、ERK及CREB蛋白的阳性神经元计数升高(P<0.05);T组与NS组术后各时点海马BDNF、ERK及CREB蛋白的阳性神经元计数比较差异无统计学意义(P>0.05)。见表6、图1。

表6 四组大鼠术后各时点海马BDNF、ERK及CREB蛋白阳性神经元计数结果的比较(个)
3 讨论
谵妄和术后认知功能障碍现统称为PND,已成为常规外科手术后最常见的并发症,尤其是老年人,预后较差,对于预先存在神经退行性变患者的PND的1年死亡率较高。目前,还没有行之有效的PND治疗方案。本研究参照文献[12]选择18~20月龄大鼠作为研究对象,模拟临床老年患者病理生理状态。本研究发现,大鼠体外循环术后3 d、5 d、7 d逃避潜伏期延长,穿越原平台次数减少,主动回避反应次数减少,主动及被动回避反应潜伏期延长,直立次数减少,中央格停留时间延长,表明大鼠体外循环术后出现围术期神经认知功能障碍,模型制备成功。

图1 大鼠海马BDNF、ERK及CREB蛋白免疫组化照片(400×)
大量的临床资料证实HPA轴基因与应激状态之间有联系。HPA轴激活后可使CRH的合成与释放。下丘脑区还分泌另一种应激激素-抗利尿激素,其与CRH协同作用,刺激ACTH分泌。PVN依赖其他下丘脑核(如弓状核、背内侧下丘脑核、视前区)和其他脑核(如杏仁核等)的输入,与CRH分泌的正性刺激整合在一起。另一方面,海马和前额叶皮层抑制PVN的活性,进而抑制HPA轴的活性[13]。HPA轴还可与其他应激相关的神经肽、胺和氨基酸系统相互作用,但人类HPA轴,尤其是CRH可能会被遗传或环境因素永久激活,使人容易受到环境压力的影响,从而在不同程度上进一步激活HPA轴。激活的HPA轴可能通过CRH的中心投射和/或皮质类固醇循环水平的增强来影响情绪,而HPA轴不同水平上的SNP可能是大脑对皮质醇敏感性变化的基础。有研究发现,HPA轴失调降低了第二信使环核苷酸(cGMP和cAMP)的水平,进而降低了CREB和BDNF的磷酸化表达,进一步加重了阿尔茨海默病患者记忆和学习障碍[14]。
BDNF在神经元的存活、生长和分化中起着重要的作用。BDNF水平的降低,尤其是在纹状体中,被认为在神经系统疾病发病机制中起着至关重要的作用。在亨廷顿氏舞蹈症患者死后脑组织中观察到脑内BDNF水平的降低[15]。越来越多的证据表明,BDNF在人脑中的多态性和BDNF表达的减少与AD的发病机制密切相关。BDNF基因的多态性(C270T和Val66Met)可引起BDNF的高表达从而减缓了AD患者的认知能力下降。这表明大脑BDNF水平可以作为一种新的评估AD进展的标志物。因此,可以考虑通过直接补充BDNF或间接刺激BDNF表达来增加BDNF水平,作为AD改善认知功能潜在的疾病治疗方法。此外,BDNF基因还可改善Aβ前体蛋白(APP)转基因小鼠学习和记忆能力。ERK和CREB信号分子参与认知功能。ERK属于丝裂原活化蛋白激酶家族成员,激活CREB,调节细胞过程,调节长期突触可塑性,稳定新记忆[16]。CREB是ERK的重要转录因子,与许多与学习、记忆和突触可塑性相关的神经元基因的启动子区域结合[17],其磷酸化促进了细胞周期蛋白依赖性激酶和细胞周期蛋白基因的转录表达。有丝分裂需要ERK活性,但如果在G2/M期ERK活性过高,则会阻止有丝分裂进入并导致细胞死亡。
本研究发现,右美托咪定预处理老龄大鼠体外循环术后3 d、5 d、7 d,血浆中CRH、ACTH和CORT浓度降低,海马BDNF、ERK及CREB蛋白的表达和阳性神经元计数升高,表明给予右美托咪定后,可以降低应激反应,上调海马BDNF、ERK及CREB蛋白的表达,从而改善围术期术后认知功能障碍。其机制可能是:体外循环应激刺激下,下丘脑室旁核处CRH表达上调,再以旁分泌或自分泌的方式作用CRH-R1,进一步促进自身分泌。同时刺激垂体前叶细胞ACTH释放入血,ACTH又促进肾上腺皮质的组织增生以及CORT的生成和分泌[18]。高血浆皮质酮可引起海马内BDNF下调,下调的BDNF蛋白可直接与TrkB结合抑制ERK蛋白表达,使得下游的转录因子CREB下调,导致认知功能障碍的发生[19]。有研究发现,右美托咪定由于激活延髓孤束核中突触后α2受体,导致交感神经发放冲动现象降低,交感张力抑制,从而降低应激反应[20],因此,本研究结果表明,右美托咪定可通过降低体外循环大鼠应激反应抑制下丘脑室旁核处CRH分泌,使得垂体前叶细胞ACTH释放入血减少以及CORT分泌减少,导致海马BDNF、ERK及CREB蛋白表达上调,从而改善围术期术后认知功能障碍,但右美托咪定是否通过其他信号通路改善围术期术后认知功能障碍,有待进一步研究。
综上所述,右美托咪定可改善体外循环后老龄大鼠围术期神经认知障碍,其机制可能与抑制HPA轴,激活海马BDNF-ERK-CREB信号转导通路有关。
