子宫内膜癌组织中SOCS-1、CUEDC2的表达变化及意义
2021-03-17戴如星高彩云杨俊郑雪群明芳
戴如星,高彩云,杨俊,郑雪群,明芳
柳州市人民医院,广西柳州545001
子宫内膜癌是常见的女性生殖系统肿瘤,发病率占所有女性恶性肿瘤的第8位[1]。近年来,其病死率呈逐渐上升趋势,严重影响女性健康[2]。肿瘤的发生与癌基因的激活及抑癌基因的失活有关。细胞因子信号传导抑制因子(SOCS1)基因位于16p13.13,此基因编码蛋白细胞因子信号转导(SOCS)家族的成员,是细胞因子诱导的细胞因子信号传导因子(STAT)负性调节剂。该基因编码蛋白在细胞因子受体的下游起负性调控作用[3]。近年研究发现,SOCS1在肿瘤中发挥抑癌基因的作用,在肝癌、卵巢癌等肿瘤中均存在表达下调现象,进而促进肿瘤的恶性进展[4]。CUE 结构域蛋白2(CUEDC2)基因位于10q24.32,该基因编码蛋白CUEDC2 具有CUE 结构域2,参与细胞周期调节和炎症等诸多生理和病理过程[5]。CUEDC2 在乳腺癌、卵巢癌、肝细胞癌等肿瘤中均存在异常表达现象,并通过影响肿瘤代谢促进肿瘤的发生发展[6]。本研究通过检测子宫内膜癌患者癌组织中SOCS1、CUEDC2 表达,初步探讨其临床意义。
1 资料与方法
1.1 临床资料 选择2016 年1月—2020 年3 月我院接受治疗的80例子宫内膜癌患者,纳入标准:①子宫内膜癌诊断以病理学检查为金标准;②均为初次诊治;③无放化疗等抗肿瘤治疗史。排除标准:①合并严重心肺肝肾等脏器功能异常;②合并有其他类型恶性肿瘤;③合并精神障碍性疾病或自身免疫系统疾病。患者年龄48~65(65.4±5.2)岁;肿瘤直径:≤5 cm者55例,>5 cm 者25例;组织分化程度:高中分化47例,低分化33例;肿瘤分期参考2009年国际妇产科联盟FIGO 标准[7]:Ⅰ~Ⅱ期60 例,Ⅲ~Ⅳ期20 例;伴肌层浸润32例,无肌层浸润48例;伴淋巴结转移19例,无淋巴结转移61例。本研究经患者及家属知情同意并签字,经我院伦理委员会审核批准通过。
1.2 癌及癌旁组织中SOCS1、CUEDC2 蛋白表达检测 采用免疫组化法。将癌组织及癌旁组织(经病理学检查明确为正常子宫内膜组织,距离癌组织>5 cm)甲醛固定过夜,石蜡包埋切片,切片75 ℃烤箱2 h;二甲苯Ⅰ液浸泡15 min;二甲苯Ⅱ液浸泡15 min;梯度水化:100℅乙醇浸泡5 min;100℅乙醇浸泡5 min;95℅乙醇浸泡3 min;95℅乙醇浸泡3 min;90℅乙醇浸泡2 min;80℅乙醇浸泡2 min;柠檬酸盐缓冲液加热煮沸15 min,自然冷却放至室温;3%双氧水去除内源性过氧化物酶30 min;一抗孵育过夜(SOCS1稀 释 比1∶500,CUEDC2 稀 释比1∶300),SOCS1、CUEDC2 抗 体 购 自Abcam 公 司,货 号ab9870、ab109649;二抗孵育2 h;DAB 显色3 min;苏木精复染30 s;梯度脱水封片。结果判定[8]:根据阳性表达部位的染色强度及细胞数对蛋白表达进行评估。不着色为0 分,颜色浅1 分,颜色深2 分。无着色细胞为0分,阳性细胞数<25%为1分,阳性细胞数25%~50%为2 分,阳性细胞数>50%为3 分。染色结果为染色强度评分与阳性细胞数评分的乘积。0~2 判定为阴性,3~9为阳性。
1.3 统计学方法 采用SPSS21.0 统计软件。计数资料用率(%)表示,组间比较采用χ2检验。SOCS1与CUEDC2 表达的相关性采用Spearman 秩相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 子宫内膜癌癌组织与癌旁组织中SOCS1、CUEDC2 表达比较 CUEDC2 阳性表达主要位于细胞质和细胞核。癌组织中SOCS1、CUEDC2 阳性表达率分别为18.8%(18/80)、63.8(51/80),癌旁组织中分别为58.8%(47/80)、7.5%(6/80)。癌组织中SOCS1 阳性表达率低于癌旁组织(χ2=21.791,P<0.05),而CUEDC2 阳性表达率高于癌旁组织(χ2=55.186,P<0.05)。
2.2 子宫内膜癌组织中SOCS1、CUEDC2 表达与患者临床病理参数的关系 子宫内膜癌组织中SOCS1、CUEDC2 表达均与肿瘤分期、淋巴结转移相关(P 均<0.05),而与年龄、肿瘤直径、肌层浸润及分化程度无关(P均>0.05)。见表1。
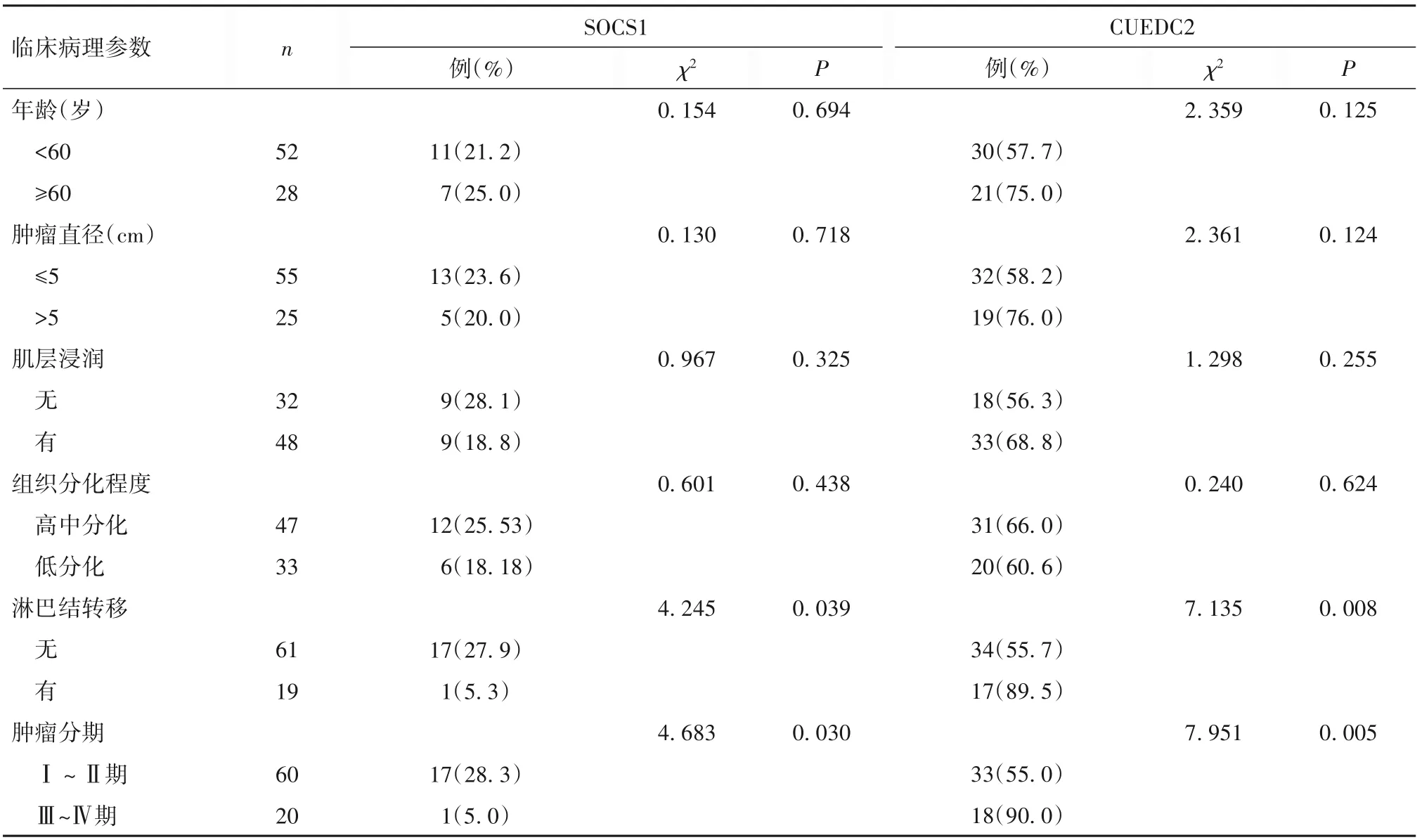
表1 子宫内膜癌组织中SOCS1、CUEDC2表达与临床病理参数的关系
2.3 子宫内膜癌组织中SOCS1 与CUEDC2 表达的相关性 Spearman 秩相关分析结果示,癌组织中SOCS1 与CUEDC2 表 达 呈 负 相 关(r=-0.598,P<0.05)。
3 讨论
子宫内膜癌起源于子宫内膜上皮组织的肿瘤,是女性常见的恶性肿瘤之一。近年来随着我国人民经济水平的提高,子宫内膜癌发病有年轻化趋势,发病率不断升高。子宫内膜癌的病因及发病机制尚不清楚,目前认为子宫内膜癌的发生是遗传因素、环境因素等共同作用的结果,而癌基因的异常激活及抑癌基因的失活是肿瘤发生的重要机制。深入研究影响子宫内膜癌发生发展的分子机制,寻找新的早期诊断及治疗的肿瘤标志物,有较高临床价值。
SOCS1是SOCS蛋白质家族的成员,该家族成员通过负反馈系统参与调控经典的Janus 激酶(JAK)/STAT 通路的调节。结构上,SOCS1具有一个保守的羧基末端结构域和SH2 结构域,SH2 结构域是SOCS1 结合Jak 激酶发挥功能的主要结构。研究表明,在乳腺癌、肝癌等肿瘤中存在SOCS1 异常表达降低的现象,并通过激活JAK/STAT 信号通路,促进肿瘤的发生发展[9]。本研究中,癌组织中SOCS1 表达下调,其机制目前尚不清楚,可能与肿瘤中微小RNA(miR),如miR-155对SOCS1基因的表达抑制有关。研究表明,miR-155 能与SOCS1 的mRNA 结合,并降低SOCS1 mRNA 的稳定性,进而抑制SOCS1 基因的表达[10]。本研究中,癌组织中SOCS1 的表达与肿瘤分期、淋巴结转移相关,其机制可能是肿瘤发生时,SRC 家族的非受体酪氨酸激酶(SFK)可使SOCS1 磷酸化,导致SOCS1 二聚化并抑制SOCS1 与p53 相互作用,进而导致p53 的抑癌功能减弱,促进肿瘤的增殖及转移等,导致肿瘤分期升高及淋巴结转移[11]。此外,肿瘤发生时SOCS1 基因启动子区域的CpG 岛处甲基化水平升高,引起SOCS1 基因表达沉默,进而导致Janus 激酶2 磷酸化水平升高,细胞因子信号转导因子1 表达上调,亦促进肿瘤的无限增殖及转移等恶性生物学行为[12]。
CUEDC2 是一种含CUE 结构域的蛋白质,结构上具有保守的泛素结合结构域。CUEDC2在多种真核细胞中表达,参与如细胞周期、分化及炎症等多种生物学过程[13]。近年来发现,CUEDC2 在多种实体肿瘤中,如乳腺癌、卵巢癌和脑癌等肿瘤中表达异常升高[14-16]。高水平的CUEDC2 能导致抑癌基因APC的编码蛋白功能失活,引起染色体错聚和非整倍性,促进肿瘤形成[17]。本研究发现,CUEDC2 在子宫内膜癌组织中表达明显增加,其原因可能与CUEDC2的转录后调控异常有关。有研究表明,miR-324-5p能结合CUEDC2mRNA 的3'非编码区,抑制CUEDC2的表达,而肿瘤发生时miR-324-5p 表达显著下调,导致CUEDC2mRNA 的稳定性降低,引起CUEDC2表达升高[18]。此外,肿瘤中CUEDC2 的表达还受到肿瘤微环境中巨噬细胞及淋巴细胞分泌的抗炎细胞因子白细胞介素17、肿瘤坏死因子α 的影响。研究表明,肿瘤中抗炎细胞因子分泌水平升高促进CUEDC2 表达,进而导致核因子κB 等信号通路的异常活化,促进肿瘤细胞的生长、抑制凋亡等生物学过程[19]。癌组织中CUEDC2的表达与肿瘤分期及淋巴结转移有关。其机制可能是CUEDC2 表达升高后,促进p38 的磷酸化,激活丝裂原活化的蛋白激酶途径,促进肿瘤细胞的恶性增殖及淋巴转移,导致肿瘤分期升高[20]。此外,CUEDC2 能通过促进肿瘤代谢促进肿瘤进展。有研究发现,CUEDC2 能上调两种关键的糖酵解蛋白,葡萄糖转运蛋白3 和乳酸脱氢酶A ,通过与糖皮质激素受体相互作用,促进肿瘤的无氧糖酵解及进展[21]。本研究中,癌组织中SOCS1表达与CUEDC2的表达呈负相关。目前在子宫内膜癌中两者相互作用的机制尚不清楚。有研究报道,在急性髓系白血病发生中,肿瘤细胞中CUEDC2 的过度表达能够促进SOCS1 蛋白的泛素化,导致SOCS1 蛋白稳定性降低,并通过泛素-蛋白酶体途径降解,引起SOCS1 蛋白表达下调[22]。动物实验中亦证实,CUEDC2 的基因敲除后的小鼠的总体生存率和无事件生存率显著延长。但二者之间的相互作用有待深入研究。
综上所述,在子宫内膜癌中SOCS1 表达下调,而CUEDC2表达上调,两者表达呈负相关,两者表达与肿瘤分期、淋巴结转移相关;检测二者表达有助于子宫内膜癌病情判断。
