加速溶剂萃取-固相萃取-高效液相色谱/三重四级杆质谱法测定土壤中6 种喹诺酮类抗生素残留
2021-03-16杨静
杨 静
上海市奉贤区环境监测站,上海 200499
喹诺酮类抗生素(Quinolone Antibiotics)是人工合成的含4-喹诺酮结构单元的广谱抗菌药,代表药物包括氧氟沙星、环丙沙星、诺氟沙星、洛美沙星、克林沙星等。 动物摄入的抗生素因无法完全代谢而排出,排泄物进一步作为有机肥料施用于农田土壤,势必会造成土壤污染,给生态环境和人类健康带来潜在风险。 目前,多种抗生素并存且持久存在于土壤中已成为土壤抗生素污染的一大特点[1-5],喹诺酮类抗生素更为普遍。 基于土壤中喹诺酮类抗生素污染的特点,寻求一种有效的检测方法至关重要。
土壤中的干扰物较多,且喹诺酮类抗生素的含量较低,对采用高效液相色谱/三重四级杆质谱法(HPLC/MSMS)开展喹诺酮类抗生素检测形成了极大挑战。 GUO 等[6]运用QuEChERS-液相色谱质谱联用法测定了猪粪中的抗生素,出现了喹诺酮类抗生素回收率较低且基质效应较强的情况,不利于检测的进行;曹胜男等[3]采用超声提取-固相萃取-高效液相色谱/质谱法测定了施粪肥土壤中抗生素的残留,萃取过程需反复进行,且获得的方法检出限偏高; 陈磊等[5]采用QuEChERS-超高效液相色谱/质谱法快速测定了土壤中19 种氟喹诺酮类抗生素的残留,虽提升了目标抗生素的回收率,但仍需要通过添加内标物校正的方式消除基质效应的影响。
因此,样品的前处理过程通常需要尽可能地降低基质效应的影响,才可以保证样品含量检测的准确性。 本研究选择先进行加速溶剂萃取(ASE),再搭配固相萃取小柱(SPE)进行净化与浓缩,最后通过HPLC/MSMS 进行检测,以期更为有效地满足目前对土壤中6 种常见喹诺酮类抗生素的检测与风险评估需求[7-10]。
1 实验部分
1.1 仪器和设备
高效液相色谱仪-电喷雾串联三重四级杆质谱仪(日本岛津,LCMS-8050),液相萃取仪(美国赛默飞世尔,ASE350),真空萃取装置(美国安捷伦,Vac Elut SPS 24),自动浓缩仪(瑞典Biotage,TurboVap II),超声波清洗器(上海声彦,SCQ-7201),高速台式离心机(上海安亭,TGL-10C),旋转蒸发仪(瑞士BUCHI,R-210),冷冻干燥机(北京四环,LGJ-10C)。
1.2 试剂和材料
100 mg/L 甲醇中氧氟沙星(农业部环境保护科研监测所,编号GSB05-3344-2016,生产日期2019-03)、培氟沙星(农业部环境保护科研监测所,编号SB05-274-2012,生产日期2019-03)、环丙沙星(农业部环境保护科研监测所,编号GSB05-3337-2016,生产日期2019-03)、恩诺沙星(农业部环境保护科研监测所,编号GSB05-3336-2016,生产日期2019-03)、恶喹酸标准溶液(农业部环境保护科研监测所,编号GSB05-3339-2016,生产日期2019-03),100 mg/L 乙醇中诺氟沙星标准溶液(农业部环境保护科研监测所,编号GSB05-3338-2016,生产日期2019-03),甲醇、乙腈、乙酸乙酯(美国Merck,色谱纯),甲酸(美国Honeywell,色谱纯),乙二胺四乙酸二钠、磷酸、磷酸二氢钾、磷酸氢二钠、一水合柠檬酸(国药集团,分析纯),石英砂(0.30~0.85 mm),硅藻土(美国赛默飞世尔),HLB 固相萃取小柱(美国安捷伦,500 mg/6 mL,Bond Elut Plexa),超纯水(美国Millipore,Milli-Q Inte A10),氮气(纯度≥99.999%)。
1.3 仪器分析条件
1.3.1 色谱条件
C18反相色谱柱(日本岛津,InertSustain),粒径3 μm,柱长50 mm,内径2.1 mm。 流动相为0.01%甲酸水溶液(A)和甲醇(B)。 梯度洗脱程序:0 min,20%B;0 ~2.0 min,20%B ~50%B;2.0 ~3.0 min,50%B ~95%B;3.0 ~3.5 min,95%B;3.5~3.6 min,95%B ~20%B;3.6 ~6.0 min,20%B。 柱箱温度40 ℃,流速0.4 mL/min,进样量10 μL。
1.3.2 质谱条件
样品检测采用电喷雾离子源(ESI)的正离子扫描多反应监测模式(MRM),离子喷雾电压为4.0 kV,接口温度为300 ℃,脱溶剂管温度为200 ℃,加热模块温度为400 ℃,雾化气流速为3.0 L/min,加热气流速为10 L/min,干燥气流速为10 L/min。 在抗生素检测过程中,通过不同特征离子对信息和保留时间进行定性和定量,最终优化得到的质谱参数如表1 所示。

表1 6 种喹诺酮类抗生素的色谱保留时间及优化后的质谱参数Table 1 Retention time and optimized MS parameters of 6 quinolone antibiotics
1.4 标准溶液配制
取一定量的氧氟沙星、培氟沙星、环丙沙星、恩诺沙星、诺氟沙星和恶喹酸标准溶液,用甲醇配置成500 μg/L(以恶喹酸浓度计)的6 种化合物的标准储备液。 将储备液置于-20 ℃条件下避光保存。
使用初始比例的流动相(20%甲醇溶液)对混合储备液进行稀释,分别得到浓度为0.1、0.2、0.5、1.0、2.0、5.0、10.0、50.0、100.0 μg/L(以恶喹酸浓度计)的混合标准系列溶液,并分别储存在棕色样品瓶中待测。
1.5 土壤样品的采集与保存
随机选取上海市郊区10 个点位的5 个表层(0 ~15 cm)土壤样品充分混合,采集过程中去除枝棒、叶子、石子和废金属等异物,最后装入具有聚四氟乙烯衬垫的棕色螺口玻璃瓶中,放置于-18 ℃以下条件中冷冻保存。 将土壤样品放入冷冻干燥机中进行脱水,然后研磨、过筛(≤1 mm)。空白土壤样品取自上海市奉贤区某农田表层土壤,在最优测试条件下未检测出6 种目标喹诺酮类抗生素。
1.6 样品前处理
1.6.1 加速溶剂萃取
称取5.0 g 土壤样品,加入硅藻土11 g,混合均匀后装入66 mL 萃取池。 选择0.1 mol/L EDTA-McIlvaine 缓冲液与甲醇(体积比1 ∶1)作为萃取溶剂。 萃取条件:温度60 ℃,压力1 500 psi(1 psi=6.895 kPa),静态萃取时间10 min,循环1 次,60%润洗体积,60 s 氮吹。 最终所得萃取液体积大约为100 mL。
1.6.2 固相萃取
萃取液经旋转蒸发(40 ℃)除去其中的有机溶剂,加超纯水稀释至100 mL,降低有机溶剂在萃取液中的含量,避免其对后续固相萃取产生影响。
分别用10 mL 甲醇和10 mL 超纯水利用重力作用缓缓通过HLB 固相萃取柱,使之活化。 将处理后的样品以5 mL/min 的流速通过HLB 柱,再用20%的甲醇溶液(10 mL)对小柱进行淋洗。 用甲醇(10 mL)进行目标物洗脱,收集洗脱液。 洗脱液经40 ℃氮吹至近干,用20%的甲醇溶液复溶至10 mL,然后上机检测。
2 结果与讨论
2.1 色谱条件的选择与优化
InertSustain C18型色谱柱具有较低硅醇基和金属离子残留的特点,有助于改善酸性及金属配位化合物的峰形,在适度保留样品的同时,还可确保具有高的分离度。 喹诺酮类抗生素易与金属离子结合,在该色谱柱上可实现较好的保留和峰形。
本研究选择在水相中分别添加0.00%、0.01%、0.05%和0.10%的甲酸,搭配有机相甲醇或乙腈进行流动相优化[11-12]。 除此之外,比较了不同初始有机相比例(5%、10%、20%、30%、40%、50%)和流动相流速(0.2、0.3、0.4 mL/min)下,50 μg/L 混合标液(以恶喹酸计)的峰面积。 结果显示,随着甲酸添加量的增加,所得目标物的质谱响应大幅度下降且低于水-甲醇体系,表明过多的甲酸对喹诺酮类抗生素的离子化存在抑制作用。因此,最终选择的最佳流动相体系为0.01%甲酸水溶液-甲醇,最佳初始流动相体积为20%,最佳流动相流速为0.4 mL/min。
2.2 质谱条件的选择与优化
分别配制浓度为1 mg/L 的6 种喹诺酮类抗生素标准溶液,采用流动注射模式(FIA)将其注入质谱检测器。 根据目标化合物的分子结构特征,统一选择正离子扫描模式,所得目标化合物的离子对参数和最优碰撞能量如表1 所示。
本研究选择50 μg/L(以恶喹酸计)的6 种喹诺酮类抗生素的混合标准溶液进行进样分析,分别对仪器的脱溶剂管温度(200 ~300 ℃)、加热模块温度(300 ~500 ℃)、雾化气流速(1.5 ~3.0 L/min)、加热气流速(5 ~15 L/min)和干燥气流速(15 ~5 L/min)进行优化。 结果显示,当脱溶剂管温度为200 ℃,加热模块温度为400 ℃,雾化气流速为3.0 L/min,加热气流速为10 L/min,干燥气流速为10 L/min 时,6 种喹诺酮类抗生素的质谱响应最佳。
2.3 前处理的优化
由于土壤基质中的干扰物较为复杂,往往会与待测的喹诺酮类抗生素在雾滴表面离子化过程中产生竞争,进而影响电喷雾接口处的离子化效率,即产生基质效应。 因此,为尽量避免基质效应降低测定方法的准确度,样品的前处理条件优化至关重要。
2.3.1 ASE 萃取条件优化
2.3.1.1 萃取溶剂的选择
称取5 g 石英砂作为空白土壤样品,进行20 μg/kg(以恶喹酸计)6 种喹诺酮类抗生素的加标。 参考6 种目标抗生素的酸度系数(pKa)及相关文献[13-14],选取甲醇、乙腈、乙酸乙酯、1%甲酸-乙腈、甲醇-水(1 ∶1)、甲醇-磷酸盐缓冲液(KH2PO4/H3PO4)(1 ∶1)、甲醇-McIlvaine 缓冲液(Na2HPO4/C6H8O7)(1 ∶1)作为萃取溶剂,在常温条件下进行6 种目标抗生素的加速溶剂萃取。 萃取压力为1 500 psi,静态萃取时间为10 min,润洗体积为60%,循环萃取1 次。 萃取液经固相萃取(1. 6. 2 节)后上机检测,所得回收率见图1。 图1 显示,选择纯有机溶剂为萃取溶剂时,除恶喹酸外,其余5 种目标抗生素的回收率均低于50%;在有机溶剂中加入50%的水,可较为明显地提升6 种抗生素的提取效率;甲醇-McIlvaine 缓冲液(1 ∶1)的提取效率最佳。

图1 不同萃取溶剂对加标石英砂萃取效果的影响Fig.1 Effects of different extraction solvents on the extraction efficiency of spiked quartz sand
2.3.1.2 离子螯合剂的选择
文献报道[3,5,15]显示,喹诺酮类抗生素易与土壤中的金属离子发生吸附位点的络合作用,强吸附于土壤。 因此,为使目标抗生素从土壤中游离出来,通常需要向土壤中添加能和金属离子形成稳定水溶性络合物的离子螯合剂——EDTA 盐。为防止萃取池堵塞并提升目标化合物的回收率,在甲醇-McIlvaine 缓冲液(1 ∶1)中添加0.1 mol/L的EDTA 盐溶液,然后进行萃取操作。
2.3.1.3 萃取温度的选择
加速溶剂萃取仪可通过提高萃取温度来减弱目标抗生素与土壤之间的相互作用,从而提升萃取效果,因此,萃取温度的选择尤为重要。 为防止温度过高导致目标抗生素不稳定,本研究优化了40 ~80 ℃条件下空白土壤加标20 μg/kg(以恶喹酸计)的回收率。
由图2 可知,氧氟沙星和培氟沙星在70 ℃下的萃取效果较优,恩诺沙星、环丙沙星、诺氟沙星和恶喹酸在60 ℃下的萃取效果较佳。 考虑到6种喹诺酮类抗生素的综合回收率,以及节约能源,本研究选择60 ℃作为最佳加速溶剂萃取温度。该温度略低于文献[4]和文献[8]中的温度,与文献[7]一致。
2.3.2 SPE 萃取条件优化
土壤经加速溶剂萃取后,仍含有大量杂质干扰物,且萃取液中含有磷酸盐、EDTA 盐等不挥发性盐。 为降低基质效应,便于上机检测并提高测定方法的灵敏度,需要使用SPE 萃取小柱进一步净化和富集。 本研究选择了一种HLB 固相萃取小柱进行6 种喹诺酮类抗生素的固相萃取。

图2 不同萃取温度对加标土壤萃取效果的影响Fig.2 Effects of different extraction temperature on the extraction efficiency of spiked soil
2.3.2.1 淋洗条件的选择
文献报道[16-19]中关于固相萃取小柱中抗生素的淋洗均简单地采用纯水,这势必导致基质效应的加重。 为改善土壤基质效应,确定最优固相萃取条件, 在不同比例有机溶剂条件下对50 μg/L(以恶喹酸计)标准溶液进行洗脱。 萃取小柱先后经10 mL 甲醇和10 mL 水活化后上样,之后将HLB 柱抽空干燥,去除柱内残余的水分。分别配制10 mL 0%、10%、20%、40%、60%、80%和100%的甲醇溶液,依次洗脱小柱并收集洗脱液。 洗脱液经40 ℃氮吹至近干,用20%的甲醇溶液复溶至10 mL,上机检测。 6 种喹诺酮类抗生素在HLB 小柱上的淋洗曲线如图3 所示。 由图3 可知,用20%的甲醇溶液进行小柱淋洗,可以在保留目标物的前提下最大限度地去除基质中的干扰物。

图3 6 种喹诺酮类抗生素在HLB 小柱上的淋洗曲线Fig.3 The elution curve of 6 quinolone antibiotics in HLB extraction column
2.3.2.2 洗脱试剂的选择
洗脱试剂的选择对固相萃取的回收率具有较大影响。 本研究选择100%甲醇、乙腈、甲醇-乙腈(1 ∶1)3 种有机溶剂进行HLB 小柱中目标化合物的洗脱。 通过对比目标化合物回收率可知,甲醇作为洗脱溶剂时的固相萃取回收率最佳。 该结果与文献报道[13,15-16]一致。 因此,本文选择20%的甲醇溶液进行基质干扰物淋洗,选择100%的甲醇进行目标化合物洗脱。
2.4 方法验证
2.4.1 基质效应
分别测定经前处理得到的空白基质中添加待测物、初始流动相中添加同样浓度待测物的离子响应强度,计算其比值,该比值即基质效应因子(MF),用来评价基质效应。 结果表明,经前处理后,6 种喹诺酮类抗生素的MF 值为0. 87 ~1. 04,除恶喹酸存在较弱的基质增强作用外,其余5 种抗生素均存在基质抑制效应。 6 种目标抗生素(按表1 顺序) 的MF 值依次为0. 93、0. 99、0. 99、0. 91、0. 87、1. 04,可以认定其基质效应不明显,进一步证明了本研究前处理方法的有效性。
2.4.2 线性范围与检出限
喹诺酮类抗生素在制作标准曲线时存在两大问题:一方面,土壤前处理过程往往较为繁复,配制空白基质提取液较为困难;另一方面,采用纯水或纯有机试剂作为溶剂进行标准曲线制作时,往往线性不佳,相关系数仅能达到0.99。 本研究经前处理优化,使得土壤基质效应极大程度地降低,从而摆脱了空白基质提取液在制作标准曲线时的束缚,因此,本研究采用初始流动相(20%甲醇)进行标准样品配制。 经试验,发现6 种抗生素标准样品的水溶液在玻璃瓶中存在一定的吸附现象。 将整个溶液配制及检测过程使用到的玻璃器皿均更换为塑料瓶后,线性相关系数可由原来的0.99 提高至0.999 以上。
在优化得到的色谱和质谱条件(1.3 节)下,将配制好的浓度分别为0.1、0.2、0.5、1.0、2.0、5.0、10.0、50.0、100.0 μg/L(以恶喹酸浓度计)的混合标准溶液,按照浓度从低到高的顺序进行上机分析。 浓度为100.0 μg/L 的混合标准溶液得到的总离子流(TIC)色谱图如图4 所示。 由图4可知,6 种喹诺酮类抗生素在1.4 ~3.0 min 出峰,峰形较佳,无明显前延和拖尾现象。
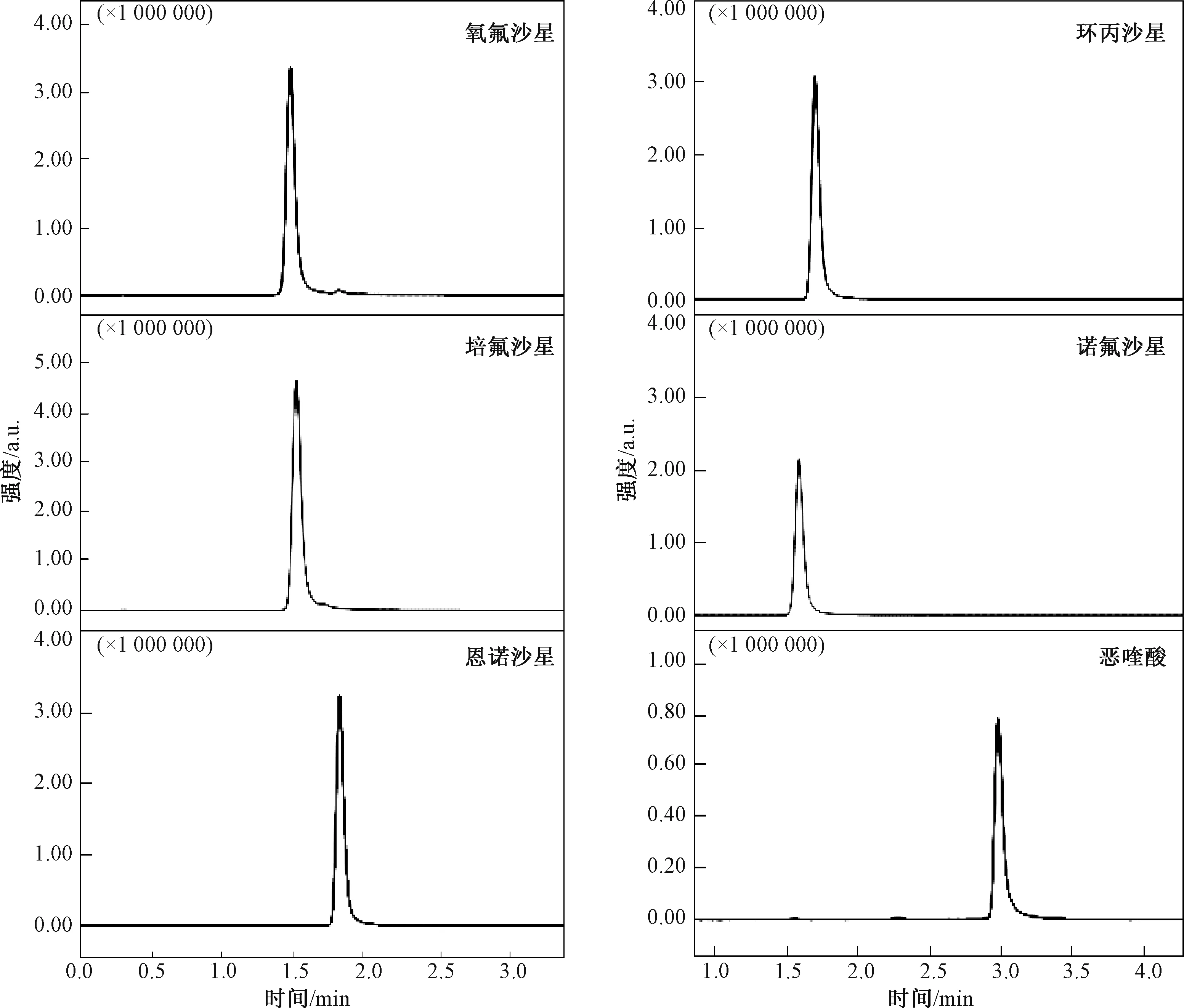
图4 6 种喹诺酮类抗生素的TIC 色谱图Fig.4 TIC chromatograms of 6 quinolone antibiotics
以6 种喹诺酮类抗生素的质量浓度(x)为横坐标,所得到的峰面积(y)为纵坐标绘制标准曲线。 根据《环境监测 分析方法标准制修订技术导则》(HJ 168—2010)[20]进行检出限的计算与检验。 在空白土壤中加入0.25 μg/kg(以恶喹酸浓度计)的目标抗生素进行提取,提取液平行测定8次,计算方法检出限,并以4 倍检出限为定量限。6 种喹诺酮类抗生素的线性方程、相关系数、线性范围、检出限、定量限结果如表2 所示。 由表2 可知,在0.2 ~100.0 μg/L(以恶喹酸计)质量浓度范围内,6 种喹诺酮类抗生素具有良好的线性关系,相关系数均大于0.999。 该方法的检出限和定量 限 分 别 为 0.09 ~0.75 μg/kg 和 0.36 ~2.98 μg/kg,略优于文献报道中的方法(检出限分别 为 0.5 ~1.1 μg/kg[3]、0.2 ~0.5 μg/kg[5]、0.45 ~1.9 μg/kg[15], 定 量 限 分 别 为 1.7 ~3.6 μg/kg[5]、1 ~2 μg/kg[15]),且样品加标量介于1 ~10 倍检出限,满足实验室痕量分析要求。
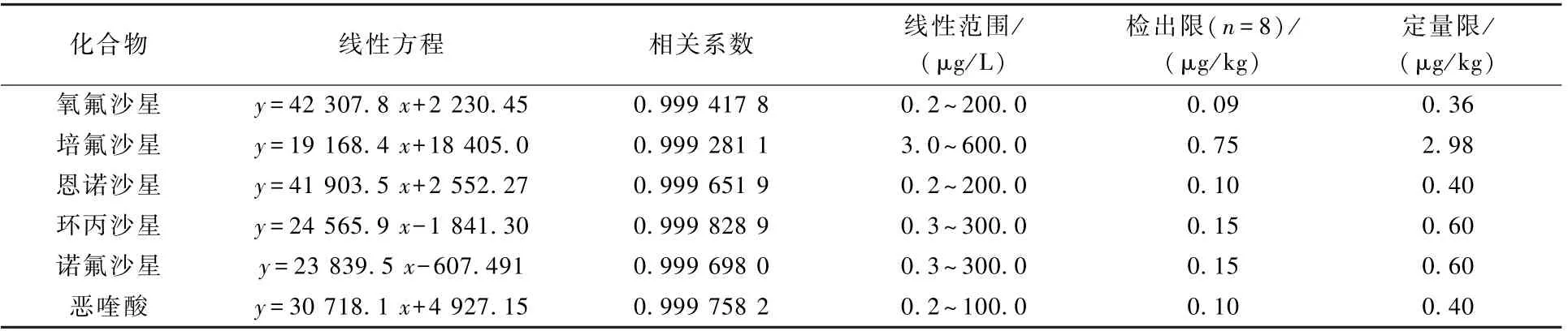
表2 6 种喹诺酮类抗生素的线性方程、相关系数、线性范围、检出限、定量限Table 2 Linear equations,correlation coefficients,linear ranges,MDL,and LOQs of 6 quinolone antibiotics
2.4.3 加标回收率和精密度
在优化得到的实验条件下,对空白土壤样品进行6 种喹诺酮类抗生素的加标实验,加标量分别为1.6、4、20 μg/kg,每一加标水平重复5 次(n=5)。 测定得到的加标回收率与相对标准偏差(RSD)如表3 所示。 结果表明,所测量土壤中的6 种喹诺酮类抗生素在3 种加标水平下的回收率为60.9%~89.9%,RSD 为1.0%~14.3%,基本满足《实验室质量控制规范 食品理化检测》(GB/T 27404—2008)中对回收率和RSD 的要求[21],说明该方法适用于实际样品中6 种喹诺酮类抗生素的检测分析。

表3 6 种喹诺酮类抗生素的加标回收率范围及相对标准偏差(n=5)Table 3 Recovery range and relative standard deviation of 6 quinolone antibiotics (n=5) %
2.5 实际样品检测
喹诺酮类抗生素因具有广谱性而被广泛使用,这就导致农田和禽畜养殖场周边土壤成为兽用抗生素的主要归宿,喹诺酮类抗生素在土壤中的残留风险日益增加[22]。 为探究禽畜养殖及农田施粪肥过程中,喹诺酮类抗生素残留对土壤环境的影响,本研究在优化得到的实验条件下测定上海市郊区10 个随机点位的土壤样品,其中包括5 个不同类型的农田土壤样品和5 个禽畜养殖场周边土壤样品。 经提取后上机检测,测得土壤中目标抗生素的检出率为100%。 农田土壤中6 种目标抗生素的总含量为10.4 ~105.3 μg/kg,其中:最主要的污染物为环丙沙星,检出率可达100%,平均检出量为26.7 μg/kg;其次为诺氟沙星、恩诺沙星、氧氟沙星,平均检出量分别为9.4、6.7、5.1 μg/kg;培氟沙星和恶喹酸的平均检出量在2 μg/kg 以下。 禽畜养殖场周边土壤中最主要的污染物为恩诺沙星、环丙沙星、诺氟沙星、氧氟沙星,检出比率可达100%,平均检出量分别为48.8、31.3、18.2、7.2 μg/kg;培氟沙星和恶喹酸的平均检出量在2 μg/kg 以下。 本研究所得农田土壤样品和禽畜养殖场周边土壤样品中目标抗生素的检测结果,与文献中关于上海市郊区不同类型农田土壤样品[5]和上海市崇明岛禽畜养殖场周边土壤样品[23]中氟喹诺酮类抗生素含量特征的研究结果一致。
3 结论
本研究系统、全面地优化了一种利用ASE- SPE-HPLC/MSMS 检测技术测定土壤中6 种喹诺酮类抗生素的分析方法。 该方法不仅具有提取效率高、重现性好和自动化程度高等优点,而且极大程度地降低了复杂土壤的基质效应,实现了污染土壤中目标化合物的高灵敏度检测,能够更好地满足目前对土壤中6 种喹诺酮类抗生素的检测与风险评估需求。
