解剖性切除与非解剖性切除治疗肝细胞癌患者疗效的Meta分析
2021-03-15雷彩宁李子汉李小飞韩彩文董保龙宋绍明龚世怡杨雯雯田宏伟杨克虎杨晓军郭天康
雷彩宁,李子汉,李小飞,韩彩文,董保龙,宋绍明,4,龚世怡,杨雯雯,4,田宏伟,杨克虎,杨晓军,7,8,郭天康,6
(1.甘肃中医药大学第一临床医学院,甘肃 兰州 730000;2.甘肃省人民医院 普通外科,兰州 730000;3.甘肃省张掖市第二人民医院 普外二科,甘肃 张掖 734000;4.兰州大学第一临床医学院,甘肃 兰州 730000;5.兰州大学循证医学中心,甘肃 兰州 730000;6.甘肃省循证医学与临床转化重点实验室,甘肃 兰州 730000;7.甘肃省外科肿瘤分子诊断与精准治疗重点实验室;甘肃 兰州 730000;8.甘肃省消化道恶性肿瘤防控工程研究中心,甘肃 兰州 730000)
肝细胞癌(hepatocellular carcinoma,HCC)是世界上第五大常见的恶性肿瘤,其病死率在我国高居第二位[1]。目前HCC的治疗方式主要有手术切除、肝移植、经导管肝动脉化疗栓塞(transarterial chemoembolization,TACE)、局部消融以及以索拉菲尼为代表的药物治疗等[2]。肝移植是虽然被认为是HCC潜在的根治性治疗方案,但供体短缺和费用高昂限制了肝移植的推广。TACE和局部消融在预后方面并不令人满意且适应证较为局限[3]。免疫治疗和靶向药物治疗虽取得了一些成果但尚未得到广泛探索[4]。所以手术切除仍然是目前治疗HCC的最有效和最常用的手段之一[5-6],主要包括解剖性切除(anatomic resection,AR)和非解剖性切除(non-anatomic resection,NAR)。
然而,多年来关于AR和NAR治疗HCC的争议不断。争议的核心焦点是两种术式的彻底性与安全性[5]。有学者[7-9]认为AR能最大程度地切除肿瘤,减少复发风险,因而倾向于选择AR。也有研究[10-11]表明NAR在手术安全性方面更具优势,保留足够肝组织对患者预后更重要。而坚持两种术式疗效无差异的研究[12-13]也不少。HCC手术切除后的高复发率和转移率是长期困扰临床医生、阻碍肝脏外科发展的难题,因此能否降低术后复发和转移也成为AR和NAR对比研究的重要成果之一[5-6]。此外,微血管侵犯(microvascular invasion,MVI)与HCC早期复发存在明显相关性[9,14],合并MVI的HCC有一定特殊性,预后更差,在手术切除方式的选择上也争议较大。
鉴于以上临床中亟待解决的问题,本研究通过纳入最新的随机对照试验[1]和队列研究[7,10-13,15-41],系统评价AR和NAR治疗HCC患者和合并MVI的HCC患者的近期及远期疗效,得出可靠结论,为临床实践提供理论指导。
1 资料与方法
1.1 纳入与排除标准
1.1.1 纳入标准⑴研究类型:随机对照试验(randomized controlled trial,RCT)或队列研究,无语种限制。⑵研究对象:接受AR 或NAR 的HCC 患者,其性别、年龄、种族不限。⑶干预措施:试验组采用AR 进行手术,对照组采用NAR 进行手术。⑷结局指标:主要结局指标包括:早期复发率、肝内局部复发率、肝内远处复发率、肝外转移发生率、无瘤生存率(disease-free survival,DFS)、总生存率(overall survival,OS);次要结局指标包括:手术时间、术中出血量、输血率、术后并发症发生率、住院时间。
1.1.2 排除标准⑴二次手术或转移性HCC 患者。⑵无法提取结局指标等有效数据的研究。⑶动物实验、综述、Meta 分析、病例报道、摘要、会议记录或专家意见等。⑷重复发表的文献。
1.2 文献检索策略
计算机检索Webof Science、PuMmed、Embase、Cochrane Library、CBM、WanFang Data和CNKI数据库,检索比较AR与NAR在治疗HCC疗效的临床研究,检索时限均为建库至2020年9月。采用主题词与自由词结合的检索方式进行文献检索。中文检索词:肝癌;肝细胞癌;肝脏恶性肿瘤;解剖性切除;非解剖性切除;肝切除术。英文检索词:Hepatocellular Carcinoma;LiverCell Carcinoma;Liver Neoplasms;Anatomic Resection;Non-anatomic Resection;Hepatectomy。
1.3 文献筛选与数据提取
由2 名研究者独立筛选文献、提取资料并交叉核对。如遇分歧,则通过讨论或与第三方协商解决。文献筛选时首先阅读文题,在排除明显不相关的文献后,进一步阅读摘要和全文以确定是否纳入。资料提取内容包括:⑴纳入研究的基本信息:第一作者姓名、研究类型、发表年份等;⑵研究对象的基线特征和干预措施;⑶偏倚风险评价的关键要素;⑷所关注的结局指标和结果测量数据。
1.4 文献质量评价
由2 名研究者独立评价纳入文献的偏倚风险并交叉核对结果。对于队列研究,采用纽卡斯尔-渥太华量表(The Newcastle-Ottawa Scale,NOS)[42]评价偏倚风险,总分为9分,≥7分为高质量文献,纳入文献要求≥6 分;对于RCT,采用Cochrane 手册5.1.0推荐的RCT偏倚风险评估工具[43]评价偏倚风险。
1.5 统计学处理
采用RevMan 5.3软件进行Meta分析。计量资料采用均数差(mean difference,MD)为效应分析统计量,二分类变量采用比值比(odds ratio,OR)为效应分析统计量,各效应量均计算其95% CI。通过I2定量判断研究间的异质性大小。若各研究间无明显异质性(I2<50%,P>0.10),则采用固定效应模型进行Meta分析;若各研究结果间存在明显异质性(I2>50%,P<0.10),进一步分析异质性来源,并采用亚组分析或敏感度分析等方法进行处理,若异质性仍无法消除,则采用随机效应模型进行Meta分析。
2 结果
2.1 文献筛选流程及结果
初检共获得相关文献2251篇,经逐层筛选,最终纳入33个研究,包括1个RCT[1]和32个队列研究[7,10-13,15-41],共6132例患者,其中AR组3029例,NAR组3103例。具体文献筛选流程及结果见图1。
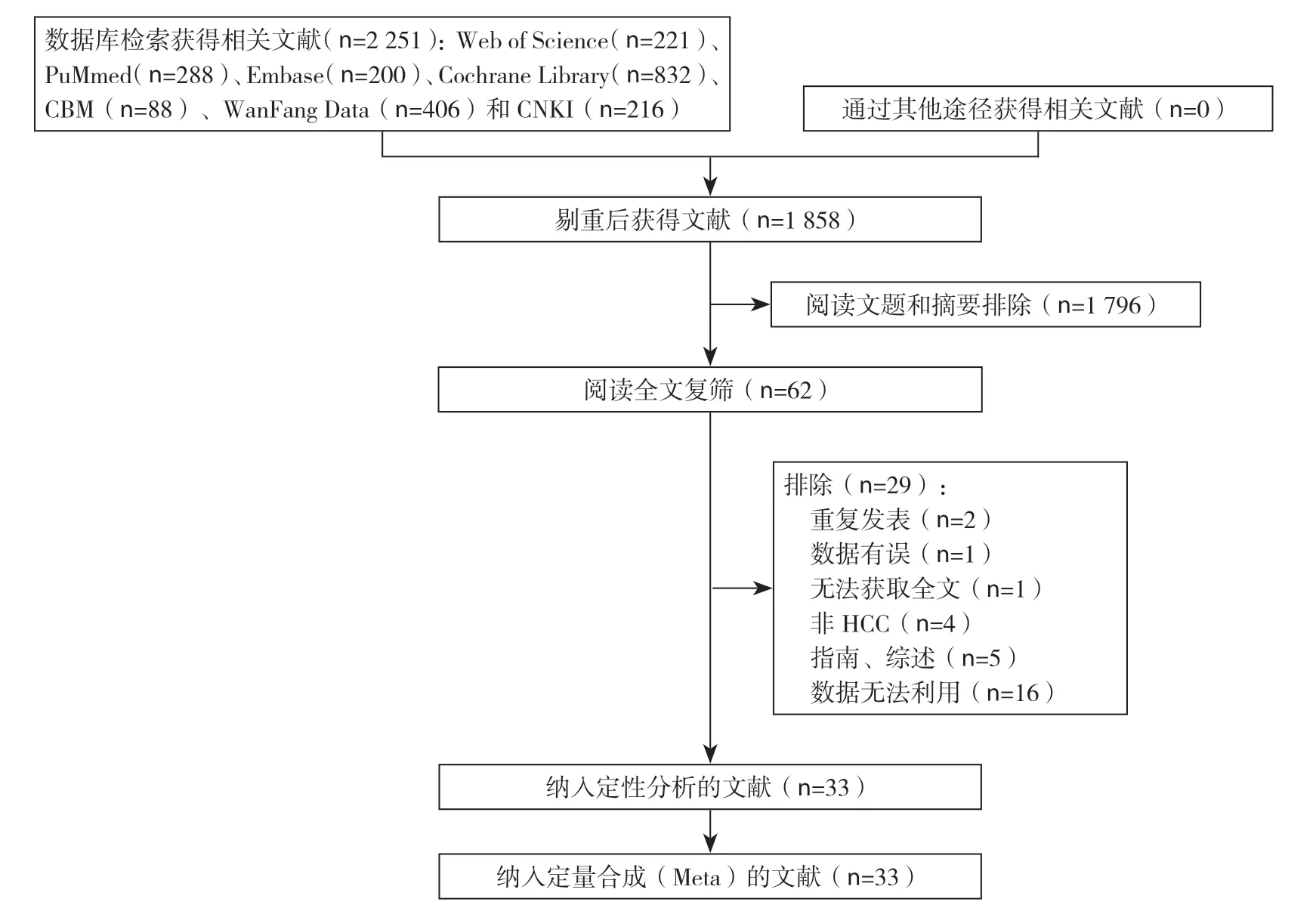
图1 文献筛选流程及结果Figure 1 Literature screening process and results
2.2 纳入研究的基本特征及偏倚风险评价结果
纳入研究的基本特征见表1。队列研究的偏倚风险评价结果见表2;RCT的偏倚风险评价结果见表3。
2.3 Meta 分析结果
2.3.1 早期复发率共12 个研究报道了早期复发率[1,12-13,15,19-20,22,24,32,37-38,41]。异质性检验显示各研究间有异质性(P=0.0002,I2=69%),采用随机效应模型。Meta 分析结果显示:与NAR 比较,AR 能减少患者术后早期复发率(OR=0.67,95% CI=0.49~0.92,P=0.01)(图2)。
2.3.2 肝内局部复发率共9 个研究报道了肝内局部复发率[1,10,15-17,26-27,29,32]。异质性检验显示各研究间有异质性(P=0.04,I2=50%),采用随机效应模型。Meta 分析结果显示:与NAR 比较,AR 能明显减少患者术后肝内局部复发率(OR=0.35,95% CI=0.20~0.59,P=0.0001)(图3)。

表1 纳入研究的基本特征Table 1 General characteristics of the included studies

表2 纳入队列研究的偏倚风险评价Table 2 Assessment of risk of bias of the included cohort studies

表3 纳入RCT 的偏倚风险评价Table 3 Assessment of risk of bias of the included RCT
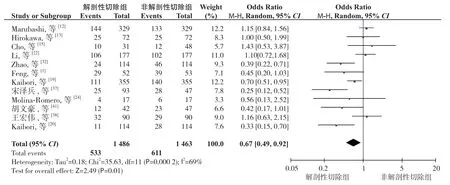
图2 早期复发率Figure 2 Early recurrence rate
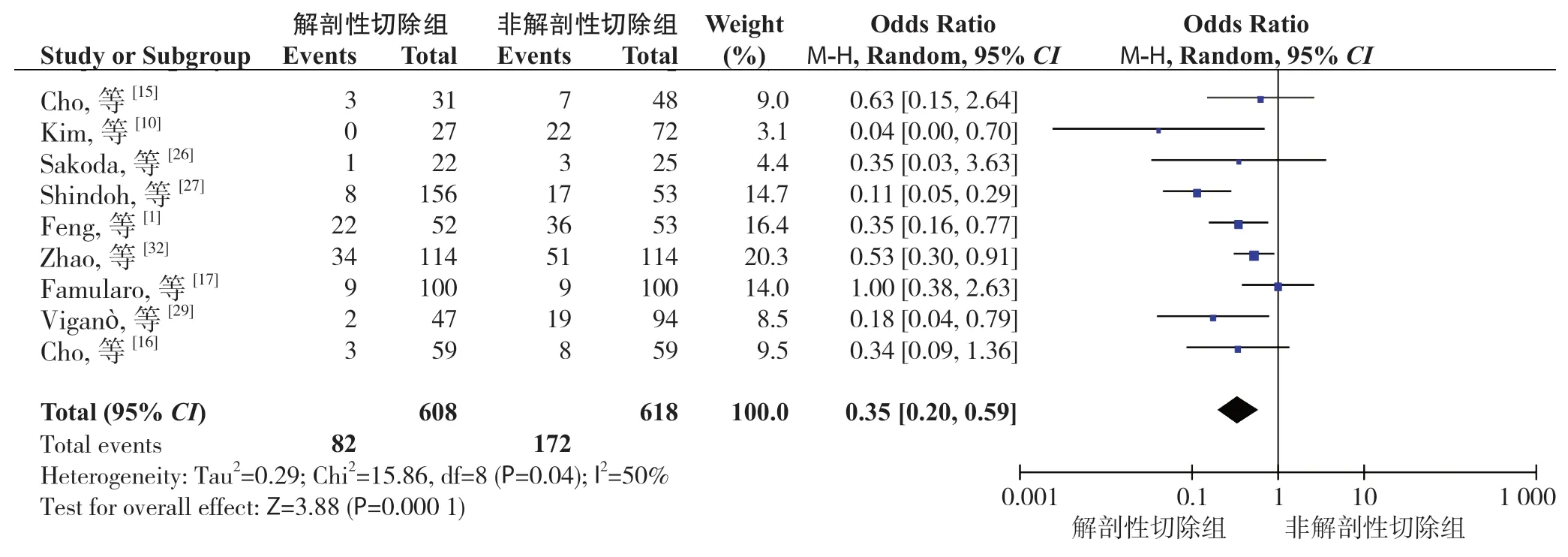
图3 肝内局部复发率Figure 3 Intrahepatic local recurrence rate
2.3.3 肝内远处复发率共7 个研究[1,10,15-17,26,32]报道了肝内远处复发率。异质性检验显示各研究间无明显异质性(P=0.14,I2=38%),采用固定效应模型。Meta 分析结果显示:AR 与NAR 术后肝内远处复发率差异无统计学意义(OR=1.11,95% CI=0.80~1.54,P=0.54)(图4)。

图4 肝内远处复发率Figure 4 Intrahepatic distant recurrence rate
2.3.4 肝外转移发生率共15 个研究报道了肝外转移发生率[1,10,12-13,15-17,19,20,22,26,30,32,34,36]。异质性检验显示各研究间无明显异质性(P=0.26,I2=17%),采用固定效应模型。Meta 分析结果显示:AR 与NAR 术后肝外转移发生率差异无统计学意义(OR=0.97,95% CI=0.78~1.22,P=0.83)(图5)。
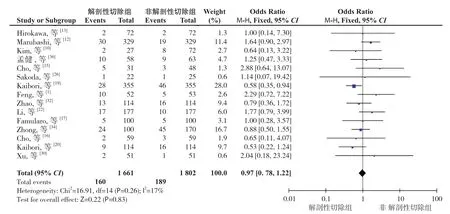
图5 两组肝外转移发生率比较Figure 5 Comparison of extrahepatic metastasis rates between the two groups
2.3.5 1、2、3、5年DFS分别有32个研究[1,7,10-13,15-35,37-41]、29 个研究[1,7,10,12-13,15-24,27-35,37-41]、32 个研究[1,7,10-13,15-40]、26 个研究[1,7,10-13,15-21,23-29,31-33,37-38,40]报道了第1、2、3、5年DFS。异质性检验显示各研究间均无明显异质性(P=0.05,I2=31%;P=0.05,I2=32%;P=0.04,I2=33%;P=0.38,I2=6%),均采用固定效应模型。Meta 分析结果显示:与NAR 比较,AR 能明显提高患者术后1、2、3、5年DFS(OR=1.26,95% CI=1.12~1.42,P=0.0001;OR=1.31,95% CI= 1.17 ~1.46,P<0.00001;OR=1.32,95% CI= 1.19~1.48,P<0.00001;OR=1.40,95% CI= 1.23~1.58,P<0.00001)(图6)。
2.3.6 1、2、3、5年OS分别有31个研究[1,7,10-13,15-16,18-35,37-41]、27 个研究[1,7,10,12-13,15-16,18-24,27-33,35,37-41]、31 个研究[1,7,10-13,15-16,18-40]、27 个研究[1,7,10-13,15-16,18-21,23-29,31-34,37-40]报道了第1、2、3、5年OS。异质性检验显示各研究间均无明显异质性(P=0.78,I2=0%;P=0.78,I2=0%;P=0.47,I2=0%;P=0.03,I2=37%),均采用固定效应模型。Meta 分析结果显示:AR 与NAR 术后1、2、3年OS 差异均无统计学意义(OR=1.01,95% CI=0.85 ~1.22,P=0.88;OR=1.15,95% CI=0.99 ~1.33,P=0.06;OR=1.13,95% CI=1.00~1.28,P=0.06)(图7A-C)。但与NAR 比较,AR 能提高患者术后5年OS(OR=1.16,95% CI=1.03~1.31,P=0.02)(图7D)。
2.3.7 手术时间等结局指标除手术时间外其余次要结局指标差异均无统计学意义(表4)。
2.4 亚组分析结果
按照研究来源(国内、国外)和是否合并MVI进行亚组分析。亚组分析显示,1年DFS和2、3、5年OS结局指标在国内研究与国外研究中差异较大,具体表现为国内研究2年OS和3年OS在AR组中更高,国外研究1年DFS和5年OS两组中差异无统计学意义。再次复核数据提取无误后,分别做出漏斗图发现,国外研究5年OS和国内研究2年OS可能存在发表偏倚,其余结局指标未见明显发表偏倚。国内研究1年DFS和国外研究5年OS存在一定异质性,分别剔除宋泽兵等[37]和Kaibori等[20]研究异质性均明显降低但结果未发生方向性改变。此外,国内研究质量评价偏低,以6分为主,也可能是出现上述差异的原因之一,但目前尚无研究表明不同种族或地域会造成不同肝切除术后出现预后差异,有待进一步探索。固定效应模型Meta分析结果显示:合并MVI的研究间异质性降低,AR组在1、2、3、5年DFS及2、3、5年OS均高于NAR组,差异均有统计学意义(表5)。

图6 两组DFS 比较 A:1年DFS;B:2年DFS;C:3年DFS;D:5年DFSFigure 6 Comparison of the DFS between the two groups A:1-year DFS;B:2-year DFS;C:3-year DFS;D:5-year DFS
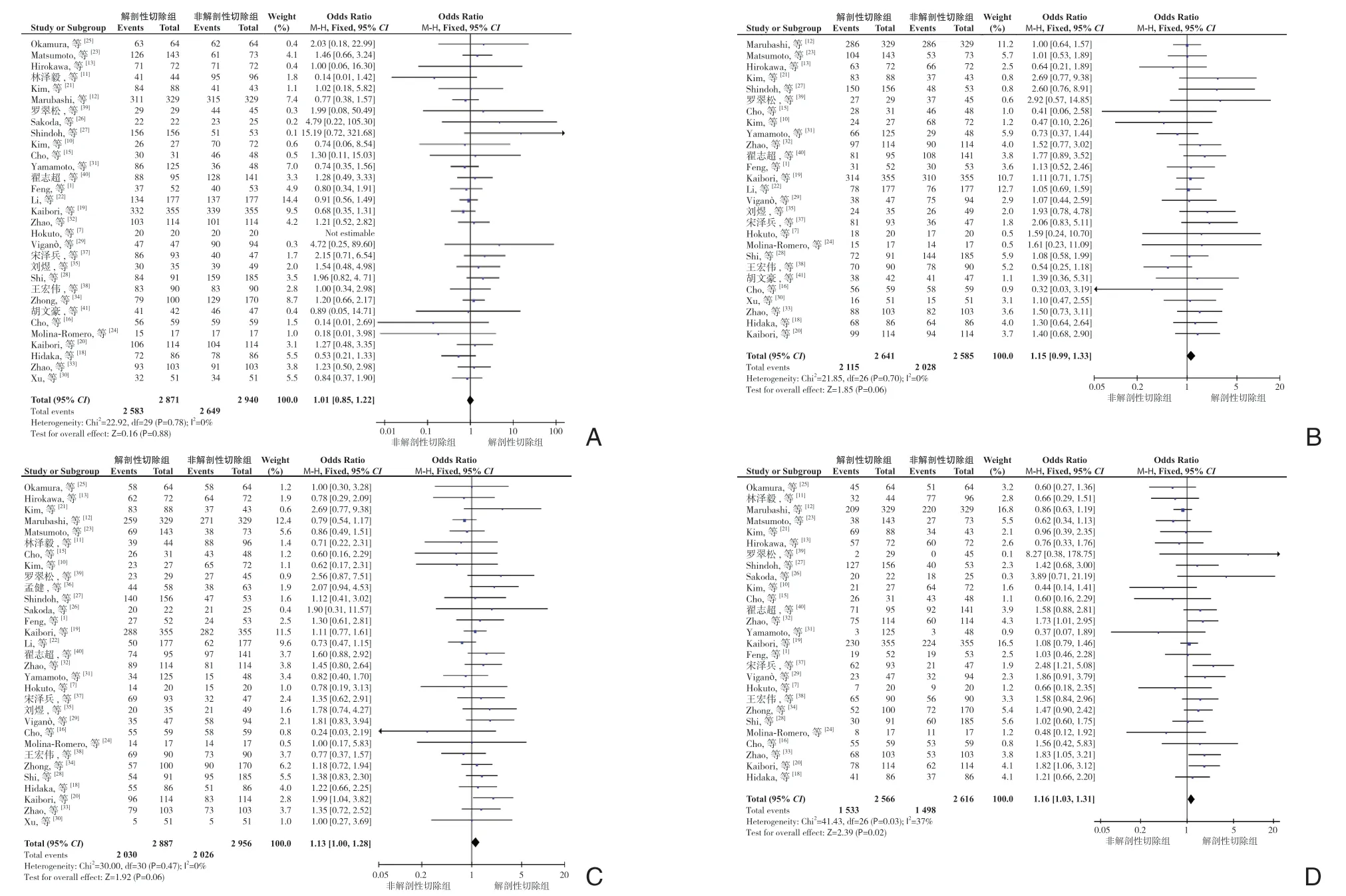
图7 两组OS 比较 A:1年OS;B:2年OS;C:3年OS;D:5年OSFigure 7 Comparison of the OS between the two groups A:1-year OS;B:2-year OS;C:3-year OS;D:5-year OS
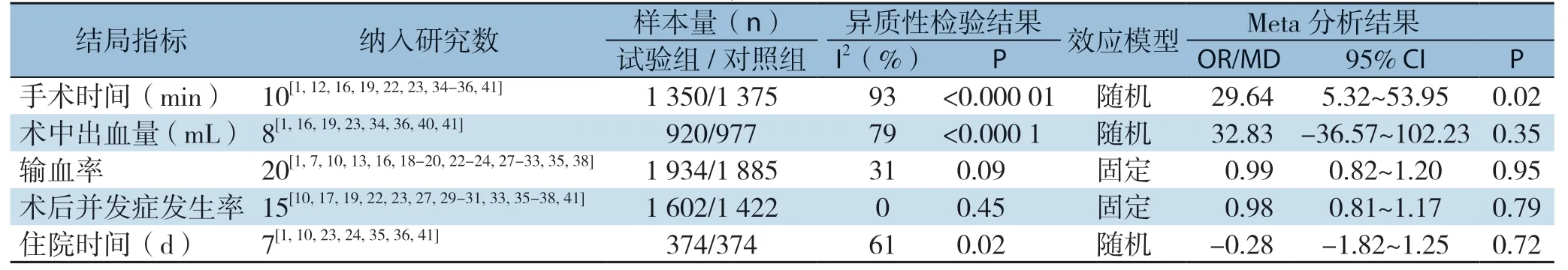
表4 其他指标的Meta 分析结果Table 4 Meta-analysis results of other variables
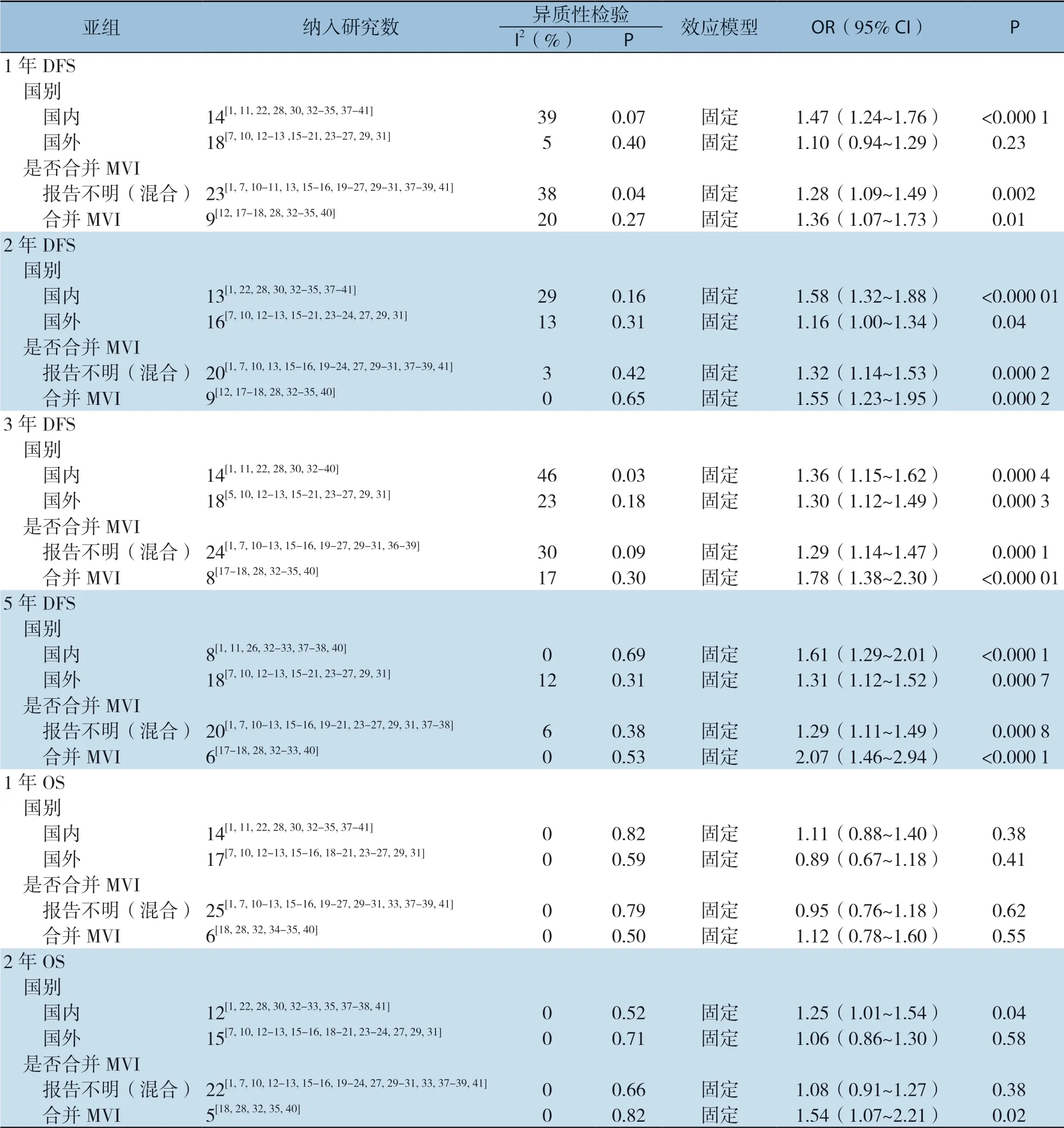
表5 亚组分析Table 5 Subgroup analysis
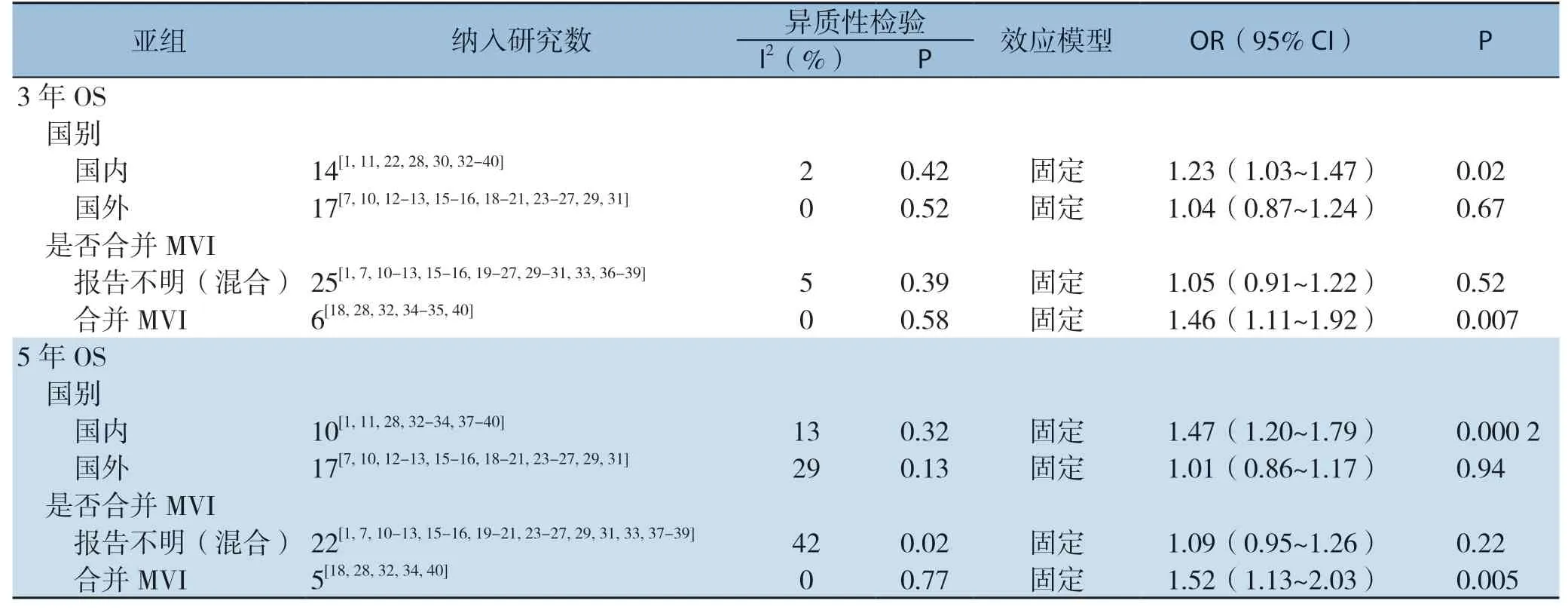
表5 亚组分析(续)Table 5 Subgroup analysis (continued)
2.5 敏感度分析结果
对异质性较大(I2>50%)的结局指标(早期复发率、肝内局部复发率、手术时间、术中出血量、住院时间)采用逐一剔除纳入研究的方法进行敏感度分析,以检验相关结果的稳定性。对于早期复发率和住院时间,逐一剔除研究后发现I2值变化不明显,提示结果较稳定;对于肝内局部复发率,剔除Shindoh等[27]研究后异质性明显降低(P=0.31,I2=16%),且研究结果未发生方向性改变(OR=0.45,95% CI=0.29~0.69,P=0.0002);对于手术时间,剔除孟健等[36]研究后异质性明显降低(P=0.0003,I2=72%),且研究结果未发生方向性改变(MD=20.95,95% CI=7.35 ~34.54,P=0.003);对于术中出血量,剔除胡文豪等[41]研究后异质性降低(P=0.02,I2=62%),且研究结果未发生方向性改变(MD=61.85,95% CI=-8.49~132.19,P=0.08)。
2.6 发表偏倚分析
发表偏倚通过漏斗图进行评估。选用纳入研究较多的3年OS这一结局指标为例,结果显示如下:各研究基本呈分布对称,提示无明显发表偏移(图8)。

图8 基于3年OS 的漏斗图Figure 8 Funnel plot based on 3-year OS
3 讨论
HCC治疗性切除术始于1891年,经历了从“盲目”肝切除到“精准”肝切除的发展[5]。1954年法国医生Couinaud提出的肝脏八段法为AR奠定了解剖学基础。1985年Makuuchi等[44]提出并最早实践了AR对HCC的治疗,因此目前公认的AR概念也由此而来,即切除病灶并同时切除荷瘤肝段(亚肝段)及供应荷瘤肝段(亚肝段)的门静脉和肝动脉的主要分支。与之相对的NAR仅对切缘阴性有要求(一般≥1 cm),无关肝内解剖情况,能够保留较多的肝组织[5]。显然,AR在理论上强调完全切除肿瘤及荷瘤肝段,清除微小潜在病灶。
本研究表明,在手术彻底性方面,AR组术后肝内局部复发(同一肝段)率和早期复发(<2年)率较NAR组低,术后DFS和远期OS较NAR组高,表现出更好的治愈彻底性。HCC细胞易侵犯癌旁静脉系统,具有沿荷瘤肝段的门脉形成卫星灶进而早期复发和转移的生物学特性[45-47]。AR将荷瘤肝段及相应脉管系统一并切除,有效避免了沿门脉系统播散的卫星灶所致的早期局部扩散和转移,从而提高患者术后无瘤生存时间和远期总生存时间,减少了局部复发和早期复发[19,48]。Kaibori等[49]的研究也支持这一理论。但本研究也显示,在术后肝内远处复发(不同肝段)和肝外转移两术式无明显差异。其可能原因是HCC的起源是多中心的[50-51],即使切除了肝内宏观病灶,患者依然面临着远处转移和多中心复发的风险[1],而这种风险无法通过单纯的解剖性切除得以避免[52],同时通过局部扩散途径导致的远处复发在此时可以认为是微不足道的[53],因次AR的理论优势此时并未得到体现。本研究显示两种术式在近期(1、2、3年)OS中无明显差异。虽然AR减少了术后局部复发,但也降低了肝癌复发的抢救性治疗机会。同时本研究中肿瘤基本都处于早期,不同的术式对近期OS影响并不大,而AR对于OS的优势在远期才得以凸显[51,54]。不可忽略的一点是循环肿瘤细胞的全身迁移也是近期无瘤生存时间缩短和肿瘤肝外转移的原因[55],单纯解剖性切除尚不能阻止这一进程。上述结果,尤其近期与远期总生存率与之前Meta分析[56]的结果不一致,可能原因是其存在较大选择偏移[57],另外本研究纳入较多最新研究。对结论的解释尚需更多前瞻性的随机对照试验证实。
微血管是癌细胞克隆性增生首当其冲的侵袭部位,癌细胞形成的微癌栓增大、脱落并随血液全身迁移,是HCC患者术后复发和转移的重要原因[58]。MVI是影响HCC患者预后的独立危险因素[9,50,59]。有研究[60]报道合并MVI的HCC患者比非MVI患者中位生存期缩短30.4个月,累计生存率也差异明显。种种迹象表明,MVI是HCC细胞恶性程度增加、侵袭性增强的标志之一[58]。本研究显示,对合并MVI的HCC患者,AR较NAR在提高DFS和近远期OS均有明显优势。这与Famularo等[54]研究结论不同。基于将荷瘤肝段及其脉管系统全部切除的AR能最大限度地清除微小潜在病灶,降低患者肿瘤残留率和术后复发,因此在近期和远期生存率均显示出明显优势。该结论也很好地验证了AR的理论优势,并将这种优势转化为现实,应推荐合并MVI的HCC患者首选AR。值得注意的是,在上述一般HCC患者中,AR并没有在近期OS显示出优越性,这进一步从侧面凸显了AR对合并MVI的HCC患者的适用性和有效性。对合并MVI的HCC患者这一特殊人群的分析在一定程度上破解了之前多个研究在没有细化和分层的基础上探讨AR和NAR对患者DFS和OS的影响而结论不一的局面。但MVI是病理学诊断,术前不易获得,早期难以明确,限制了临床可操作性。近来,Lin等[61]提出了MVI术前预测模型,对预测MVI阳性的患者进行AR并取得一定成效。但至今尚未见独立预测指标的有关报道,这将是当下乃至未来一段时间研究的方向之一。
在手术时间和安全性方面,本研究显示,AR组的手术时间较NAR组长,其可能原因是:⑴AR操作难度大及术中辅助技术的引入需要花费较多时间;⑵不同中心对手术时间的定义未达成统一,可能造成两组手术时间差异;⑶分析表明,涉及手术时间的研究间异质性很大,因此手术时间的差异存在一定偏倚。但在术中出血量、输血率、术后肝衰竭等并发症发生率以及住院时间两术式均无统计学差异,在现有指标下表明AR安全可行。
本研究的局限性:⑴由于HCC合并MVI的原始研究较少,在亚组分析解释结果和推论时可能存在偏倚风险;⑵纳入研究中以小肝癌居多,涉及大肝癌的研究偏少,可能存在选择偏倚;⑶本研究中绝大部分患者肝功能Child-Pugh分级为A,另有少部分患者经过短期药物治疗后可从B恢复到A,因此结论限于肝功能良好的HCC患者;⑷纳入研究中仅有1篇RCT,结论尚需更多高质量前瞻性研究佐证。
综上所述,肝癌的手术切除是最大程度切除肿瘤侵犯区域和保留足够功能性肝组织间的精准平衡,即是彻底性和安全性的统一。在早期复发率居高不下的背景下,AR凸显出更好的治愈彻底性。尤其对合并MVI的HCC患者,AR术后近期和远期疗效均优于NAR,因此推荐在临床中实践。
