TIP30在肝内胆管癌中的表达及意义
2021-03-15刘继升刘河刘浩YUXing李浩
刘继升,刘河,刘浩,YU Xing,李浩
(1.湖南师范大学附属第一医院/湖南省人民医院 肝胆外科,湖南 长沙 410005;2.浙江省温州市中心医院/上海大学附属第二医院 大肠外科,浙江 温州 325000;3.湖南师范大学 医学院,湖南 长沙 410005)
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)起源于肝内二级分支以下的胆管上皮细胞,约占原发性肝脏恶性肿瘤的10%~15%,仅次于肝细胞癌,且发病率逐年升高[1-2]。目前ICC的治疗主要依赖手术切除,但由于高度恶性的生物学行为,导致术后复发率和转移率较高,患者5年生存率仅为 15%~20%[3-5]。因此,研究ICC发生、发展的相关机制意义重大。
抑癌基因HIV-1 Tat相互作用蛋白2(HIV-1 Tat interactive protein 2,TIP30)是首个利用RNA差异表达技术发现的抑癌基因[6],其表达下调或缺失被发现与胃癌、肝癌、胆囊癌、结直肠癌和肺癌等多种恶性肿瘤有关[7-12],但在ICC中未见明确报道。既往研究表明TIP30基因的作用受微小RNA(microRNA,miRNA)的调节,如血管平滑肌细胞高表达miR-10b可诱导TIP30表达水平下调,并启动脯氨酸蛋白激酶B(protein kinase B,Akt)信号通路促进细胞增殖[13];Ouyang等[14]也报道了miR-10b可抑制TIP30基因表达并促进表皮生长因子(epidermal growth factor,EGF)和转化生长因子β(transforming growth factor β,TGF-β)的作用来增强胰腺癌细胞的侵袭。本研究旨在探索TIP30在ICC中的表达及相关临床意义,并探究在ICC中可能调控TIP30表达水平的miRNA,为ICC的诊断、治疗及预后评估提供新的思路。
1 材料与方法
1.1 临床标本
收集我院2013年1月—2014年12月期间手术切除的51例ICC患者的癌组织及癌旁组织(距肿瘤边缘2 cm)。所收集病例均有详细且完整的临床病例资料;术前未行放化疗等相关抗肿瘤治疗;行手术切除,且切缘为阴性;经病理确诊为ICC;为首次确诊且未合并其他肿瘤。术后通过门诊或电话随访。本研究经医院伦理委员会批准,并取得每位患者或家属的知情同意。
利用生物信息学方法,筛选TCGA(https://tcga-data.nci.nih.gov/tcga)和SEER(https://seer.cancer.gov)数据库中具有TIP30表达资料及随访资料的ICC病例,剔除其中临床随访数据缺失或不全、年龄>80岁或<18岁、行放化疗、合并其他肿瘤及非主动随访的患者,共纳入94例患者,其中53例行根治性手术切除。所有患者均纳入预后分析。
1.2 主要材料
人ICC系(ICC-9810、SSP-25和HuH-28)购自中国科学院上海细胞库。兔抗人TIP30抗体购自北京天根生物技术有限公司。羊抗兔第二抗体购自北京百奥莱博科技有限公司。免疫组化试剂购自北京中杉金桥公司。改良伊格尔培养基(Dulbecco's Modified Eagle's medium,DMEM)、胎牛血清、逆转录试剂盒购于美国Thermo Fisher Scientific公司。Lipofectamine2000、TRIzol试剂购自美国Invitrogen公司。
1.3 免疫组化检测
组织标本经固定、包埋、切片后行免疫组化。免疫组化实验步骤按试剂盒说明书步骤进行。组织石蜡切片于67 ℃烘片2 h,经二甲苯和梯度酒精脱蜡至水。抗原修复方法采用柠檬酸盐缓冲液微波煮沸修复,自然冷却后加入阻断剂阻断内源性过氧化物酶活性,磷酸盐缓冲液(phosphate buffer saline,PBS)清洗3次。3%牛血清蛋白封闭1 h 后直接滴加一抗稀释液(1:100),4 ℃孵育过夜,漂洗3次。37 ℃孵育二抗1 h,PBS清洗3次。二氨基联苯胺试剂染色。根据阳性细胞百分比及染色深浅分级,表达强度用组织学评分(∑pi)表示:p代表阳性细胞百分率,阳性细胞百分数<10%为0,10%~30%细胞染色为1,30%~60%细胞染色为2,>60%细胞染色为3;i代表染色深浅或染色强度,不染色或染色不清为0,浅黄色为1,棕黄色为2,深褐色为3。将所有ICC组织标本按评分高低分为高表达组及低表达组,评分总和≤3分为低表达组,>3分为高表达组。
1.4 细胞培养及转染
人ICC细胞(ICC-9810、SSP-25和HuH-28)于含10%小牛血清、100 IU/mL青霉素、100 μg/mL链霉素的DMEM培养液中,37 ℃、5%CO2条件下传代培养。取对数生长期的细胞(ICC-9810、SSP-25和HuH-28)分别接种于六孔板中,培养至细胞融合率达到80%以上,根据Lipofectamine 2000说明书分别转染TIP30-shRNA及阴性对照、miR-124-3p模拟物及阴性对照序列。培养4 h后更换新鲜完全培养基,继续培养48 h以备后续实验。
1.5 软琼脂克隆形成实验
取对数生长期TIP30-shRNA转染后的ICC细胞(ICC-9810、SSP-25和HuH-28)及其阴性对照组细胞,以每组103个细胞接种至顶层含0.3%、底层含0.6%琼脂糖的软琼脂上,置于37 ℃、5%CO2的培养箱中培养2周,收集各组细胞,于显微镜下观察,统计克隆形成数。克隆形成率=(形成的克隆数/接种的细胞数)×100%。
1.6 调控TIP30 表达的miRNA 预测
从美国国家生物信息中心(NCBI)数据库检索到人类TIP30 的Gene ID 为“10553”。在miRBD数据库(http://www.mirdb.org)中,选定检索类型为“Search by gene target”,输入TIP30的Gene ID,得到相关检索结果。在Ensembl 75数据库(http://feb2014.archive.ensembl.org/index.html)中,查询到TIP30的Ensembl ID为“ENSG00000109854”,在TargetScan(http://www.targetscan.org)数据库中利用该Ensembl ID检索到多个转录本,选取最具代表性的一个,得到检索结果。根据两数据库的预测结果,取二者交集,选定目标miRNA。
1.7 qRT-PCR 检测
使用TRIzol试剂从标本组织和培养的细胞中提取总RNA,使用逆转录试剂盒根据制造商说明书进行cDNA合成和聚合酶链反应扩增,TIP30及其内参照β-actin、miR-124-3p及其内参照U6的正向和反向引物根据NCBI基因文库用Primer Premier 5.0 软件自行设计。TIP30引物序列,正向:5'-GTG TTG GGT TCT GTT GCC-3',反向:5'-TCA TAG TTG AGT TCC CTT CG-3';内参照β-actin引物序列,正向:5'-GAT TGC CTC AGG ACA TTT CTG-3',反向:5'-GAT TGC TCA GGA CAT TTC TG-3'。miR-124-3p引物序列,正向:5'-CGT AAG GCA CGC GGT GAA-3',反向:5'-AGT GCA GGG TCC GAG GTA TT-3';内参照U6引物序列,正向:5'-GTA GAT ACT GCA CTA CG-3',反向:5'-ACT GCA TGA CGT ACC TGA GC-3'。采用2-ΔΔCT 法计算相对表达量。
1.8 统计学处理
采用统计学软件SPSS 20.0进行统计分析,实验数据以均数±标准差(±s)表示,统计处理采用独立t检验对组间进行比较;计数资料采用χ2检验。患者总生存率和累积复发率均采用Kaplan-Meier分析。P<0.05为差异有统计学意义。
2 结果
2.1 TIP30 在ICC 和癌旁组织中的表达
免疫组化结果显示,TIP30蛋白主要表达于细胞膜与细胞质。TIP30蛋白在癌组织与癌旁组织中均有表达,相对比癌旁组织,TIP30在ICC组织中表达降低(图1)。同时,根据51对ICC组织及对应癌旁组织的免疫组化结果构建的热图亦反应了这种表达差异(图2)。
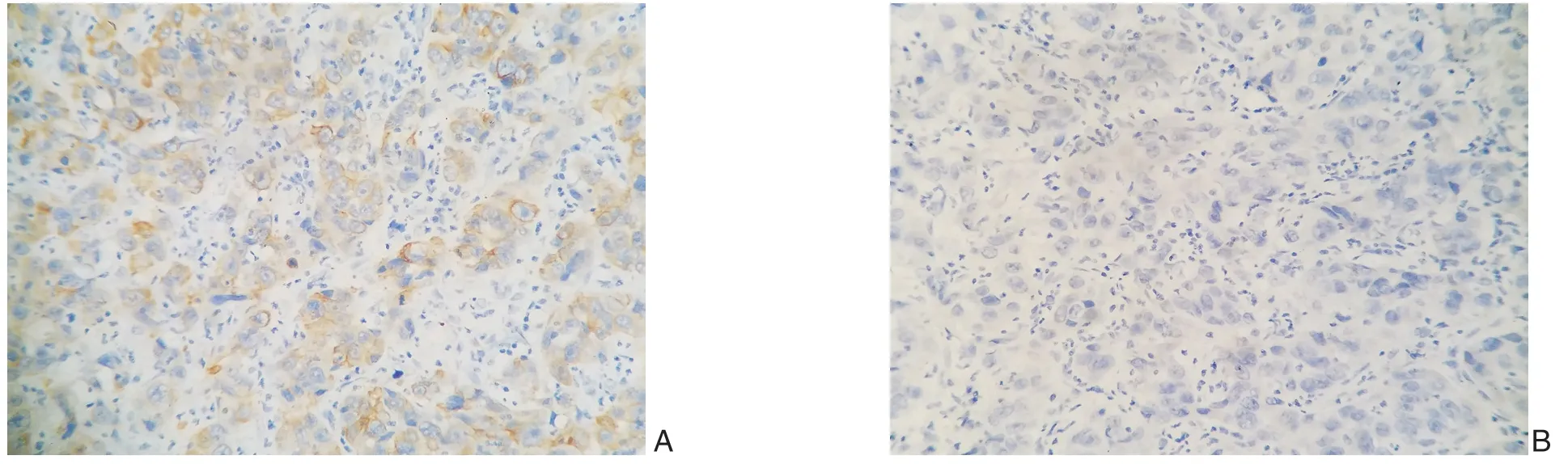
图1 免疫组化检测TIP30 的表达(×400) A:癌旁组织;B:癌组织Figure 1 Immunohistochemical staining for the expression of TIP30 (×400) A:Adjacent tissue;B:Cancer tissue
2.2 TIP30 表达与ICC 患者临床病理参数的关系
分析我院51 例ICC患者的临床病理参数,发现TIP 30的低表达与患者淋巴结转移有关(P=0.008),而与患者性别(P=0.543)、年龄(P=0.351)、TNM分期(P=0.513)、分化程度(P=0.221)、肿瘤大小(P=0.061)、肿瘤数目(P=0.112)、CA19-9水平(P=0.306)无关(表1)。

图2 TIP30 在ICC 组织及癌旁组织中的表达热图(红色:表达上调;绿色:表达下调)Figure 2 Heat map of TIP30 expression in ICC tissues and adjacent tissues (red:up-regulated expression;green:down-regulated expression)
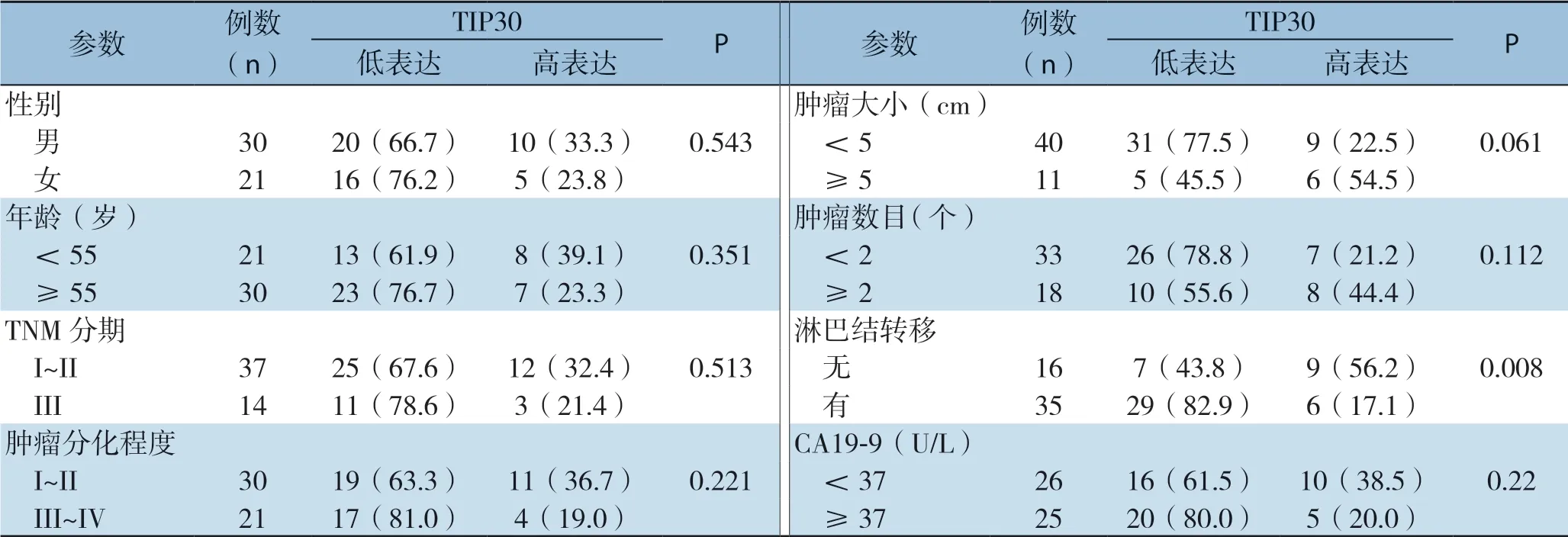
表1 TIP30 表达与ICC 患者临床病理参数的关系[n(%)]Table 1 Relations of TIP30 expression with clinicopathologic variables of ICC patients[n (%)]
2.3 TIP30 表达与ICC 患者预后的关系
根据患者的随访资料构建累积复发率和总生存率Kaplan-Meier曲线。结果显示在行根治性手术治疗的104例患者中,TIP30高表达组患者5年累计复发率低于TIP30低表达组患者(P=0.0374);在所有行TIP30检测的145例ICC患者中,TIP30高表达组患者的5年总生存率高于TIP30低表达组患者(P=0.0412)(图3)。

图3 Kaplan-Meier 曲线分析 A:总生存率曲线;B:累积复发率曲线Figure 3 Kaplan-Meier curves analysis A:Overall survival curves;B:Cumulative relapse curves
2.4 TIP30 对ICC 细胞增殖的影响
实验结果表明,与阴性对照组(NC)相比,由TIP30-shRNA转染的ICC细胞(ICC-9810、SSP-25和HuH-28)形成的集落数明显增加(均P<0.001)(图4),表明TIP30表达降低在体外可促进ICC细胞增殖。
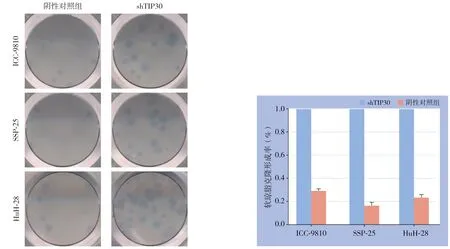
图4 软琼脂克隆形成实验Figure 4 Soft agar colony formation assay
2.5 调控TIP30 的miRNA 预测
根据TargetScan、miRDB数据库的预测结果构建Venn图,两数据库预测可能调控TIP30表达水平的miRNA分别有10个、33个,取二者交集得出miR-124-3p调控TIP30的表达可能性较大(图5)。
2.6 miR-124-3p 对TIP30 表达的潜在调控
运用qRT-PCR检测我院51对ICC组织和癌旁组织中miR-124-3p的含量,结果显示m i R-124-3 p 在癌组织中的相对含量高于癌旁组织(P<0.001)(图6)。在miR-124-3p转染的ICC细胞系(9810、SSP-25和HuH-28)中TIP30的表达水平明显低于各自的阴性对照组(均P<0.05)(图7)。初步推断ICC中TIP30的表达水平可能受miR-124-3p的负向调控。

图5 调控TIP30 的miRNA 的预测与分析Figure 5 Prediction and analysis of the miRNAs regulating TIP30

图6 miR-124-3p 在ICC 和癌旁组织中的表达Figure 6 The expressions of miR-124-3p in ICC tissue and tumor-adjacent tissue
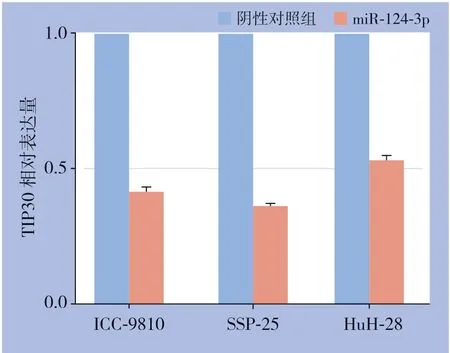
图7 转染miR-124-3p 后ICC 细胞中TIP30 的表达Figure 7 Expression of TIP30 in ICC cells transfected with miR-124-3p
3 讨论
ICC是5年存活率最低的恶性肿瘤之一,手术切除是首选治疗方式,但由于早期难于诊断、疾病进展迅速等特点,只有10%~15%的患者适合手术治疗[15],因此迫切需要寻找早期诊断及预后判断指标并发展有效的靶向治疗手段。
TIP30基因是一种公认的抑癌基因,定位于人类第11号染色体短臂上(11p15.1),包括6个外显子,编码242个氨基酸残基的开放读码框架,其可以特异性地作用于Tat蛋白活化区域而对基因的转录进行调节[16-17]。既往研究认为,TIP30抑癌效应主要包括以下方面:⑴通过上调 p53基因表达来阻滞肿瘤细胞周期自G1期向S期转变,从而抑制肿瘤细胞生长[18];⑵诱导B淋巴细胞瘤2基因相关凋亡促进因子(Bcl-2 associated death promoter,Bad)和凋亡诱导因子p53基因依赖性活化,与核膜物质运输相关蛋白结合调控核内外信号交流,促进肿瘤细胞凋亡[19];⑶在肝细胞癌中下调骨桥蛋白(osteopontin,OPN)的转录和翻译,抑制血管内皮细胞生长因子依赖性肿瘤转移和新生血管生成[20]。此外,在参与DNA损伤修复[21]、参与肿瘤细胞能量代谢[22]等方面亦发挥重要作用,同时TIP30还能协同其他药物发挥抗癌作用[23]。
TIP30在多种肿瘤中存在表达下调或缺失,并且与患者的预后不良密切相关。樊丽伟等[10]发现TIP30在正常结直肠黏膜组织中表达明显高于结直肠腺瘤与结直肠癌组织,且在不同病理类型的腺瘤中,随着结直肠腺瘤绒毛成分的增加,腺瘤恶变率增加,TIP30的表达也随之降低。Li等[24]发现TIP30的过表达能够抑制膀胱癌细胞的增殖、迁移、侵袭并促进细胞凋亡,并有研究认为TIP30表达下调可能是膀胱癌预后标志物,与预后不良相关[25]。Xu等[26]开展的一项纳入多种肿瘤的Mata分析显示,在具有良好总体生存率的肿瘤患者中,TIP30的高表达与较高的无复发生存率之间存在显着相关性,认为TIP30的高表达与肿瘤患者预后良好相关。
本研究通过免疫组化发现TIP30在ICC中的表达较癌旁组织低,差异具有统计学意义,并且这与TIP30在人体多种肿瘤中的表达情况一致。分析TIP30的表达水平与ICC患者临床病理因素的关系,发现TIP30的低表达与性别、年龄、TNM分期、分化程度、肿瘤大小、肿瘤数目、CA19-9水平无关(P>0.05),与患者淋巴转移有关(P=0.008),而淋巴转移是ICC主要的转移方式,这说明TIP30的表达差异对患者预后产生影响。在预后分析中,本研究利用生信分析挖掘了公共肿瘤数据库的部分病例来扩大研究样本量,结果显示 TIP30的低表达与患者更低的总生存率及更高的累积复发率相关。
本研究通过软琼脂克隆形成实验初步探讨了TIP30对ICC细胞生物学行为的影响。通过将TIP30-shRNA转染到正常生长的ICC(ICC-9810、SSP-25和HuH-28)细胞系中,发现与对照组细胞相比,实验组各ICC细胞系形成的集落数均较对照组明显增加(所有P<0.001),这表明TIP30表达降低在体外可促进ICC细胞增殖。
miRNA是一类由17 ~25 个碱基组成的单链RNA分子,广泛存在于生物体内,通过碱基互补配对原则与mRNA特异性结合来降解靶基因或抑制其翻译,参与肿瘤细胞的增殖、分化及凋亡等生物学过程[27-28]。已有研究发现miR-124-3p在多种肿瘤中发挥了重要的作用。在肝细胞癌中,miR-124-3p水平与40 kD大小的富含Akt底物蛋白(prolin-rich Akt substrate of 40 kD,PRAS40)蛋白和磷酸化水平呈负相关,miR-124-3p缺失引起的PRAS40高表达有助于PRAS40的过度磷酸化和肝癌的发生[29];另有研究表明,miR-124-3p在口腔舌鳞状细胞癌中可以靶向高迁移率族蛋白A2(high mobility group protein A2,HMGA2)以抑制肿瘤细胞的增殖、侵袭和转移[30],miR-124-3p可以靶向p62抑制神经胶质瘤的进展[31]。本研究利用生信方法预测miR-124-3p可能是TIP30的上游调控因子,并通过qRT-PCR检测了51对ICC组织与癌旁组织中miR-124-3p的相对表达量,结果表明miR-124-3p在癌组织中的表达较癌旁组织明显升高(P<0.001);同时,与阴性对照组相比,经miR-124-3p转染的各细胞系中,TIP30的表达均下调。研究推断ICC中TIP30的表达下调可能与miR-124-3p有关,但仍需通过进一步抑制或过表达细胞株中miR-124-3p表达后检测TIP30的变化,使结论更可靠。
综上所述,TIP30在ICC组织中表达下调且与患者不良预后相关,该基因可能用于ICC的预后评估并为临床诊治提供新思路。此外,TIP30在ICC中的表达可能受miR-124-3p的调控,但有待后续进一步研究。
