上调lncRNA SNHG12与miR-199a-5p/FZD6轴对肝细胞癌细胞增殖、侵袭和上皮-间质转化的影响
2021-03-15周京涛刘佳努尔买买提阿米都拉闫军寇旭东张鸽文
周京涛,刘佳,努尔买买提·阿米都拉,闫军,寇旭东,张鸽文
(1.新疆医科大学第七附属医院 普通外科,新疆 乌鲁木齐 830000;2.新疆维吾尔自治区第八人民医院 急诊科,新疆乌鲁木齐 830000;3.中南大学湘雅医院 肝脏与甲状腺外科,湖南 长沙 410008)
肝细胞癌(HCC)是临床上常见的恶性肿瘤之一。据估计,每年约有50万至100万新病例被诊断为HCC,其病死率在癌症中居第三位[1]。侵袭、转移和术后复发是导致HCC患者死亡的主要原因,而且肝癌患者通常诊断为晚期,具有较高的致命性[2]。因此深入研究肝癌发生发展的分子机制至关重要。研究表明HCC的发生发展是一系列基因改变的多期过程,这些基因改变在肝细胞的恶性转化中起着至关重要的作用。目前,越来越多的研究报道了长链非编码RNA(long non-coding RNAs,lncRNA)在癌症发生中的作用。lncRNA是一类长度超过200个核苷酸的RNA分子,不编码蛋白质,但具有调节基因表达的能力[3]。研究表明,lncRNA影响多种生物如发育、分化和致癌调控过程[4-5]。此外,lncRNA的失调可能与各类癌症的发生和转移有关[6]。例如,lncRNA HOXA11-AS通过调节上皮-间质转化(epithelial-mesenchymal transition,EMT)促进乳腺癌的侵袭和转移[7]。另外发现长链非编码RNA SchLAH通过与FUS相互作用,抑制HCC的转移[8]。lncRNA MLK7-AS1在结肠癌中高表达,其高表达可以促进结肠癌细胞增殖[9]。最近研究揭示了HCC细胞中异常表达的lncRNA,如lncRNA RUSC1-AS1在HCC中表达上调,其可通过靶向调控miR-326的表达促进HCC细胞的恶性生物学行为[10]。lncRNA MIF-AS1在HCC中表达升高,其表达水平与HCC患者恶性临床病理特征及不良预后差密切相关,其作用机制可能通过促进EMT过程有关[11]。lncRNA小核仁RNA宿主基因12(small nucleolar RNA host gene 12,SNHG12)作为重要的一种lncRNA,研究发现其与胃癌、骨肉瘤和非小细胞肺癌等癌症发展密切相关[12-13]。有研究表明,lncRNA SNHG12在HCC组织表达明显上调,但lncRNA SNHG12调控HCC发展的作用机制尚不清楚。因此,本研究拟探究lncRNA SNHG12在HCC发展过程中的作用,为进一步阐明HCC的进展机制提供理论基础。
1 材料与方法
1.1 主要材料
HCC细胞H epG2和人肝内胆管上皮细胞HIBEC购自上海钰博生物科技有限公司;DMEM培养基购于美国HyClone公司;胎牛血清(fetal bovine serum,FBS)购于美国Gibco公司;Turbofect Transfection Reagent、点突变试剂盒和双荧光素酶活性检测试剂盒为购于美国Thermo公司;PrimeScript™ RT reagent Kit with gDNA Eraser购于大连Takara公司,辣根过氧化物酶标记的羊抗兔、辣根过氧化物酶标记的羊抗鼠抗体购自美国圣克鲁斯生物科技有限公司;GAPDH、E-cadherin、N-cadherin抗体购自北京康为世纪生物公司;阴性对照质粒(siRNA NC)、SNHG12下调质粒(SNHG12 siRNA)、SNHG12过表达质粒(pcDNA-SNHG12)、模拟物对照组(mimics NC)、miR-199a-5p模拟物(miR-199a-5p mimics)、抑制剂对照组(inhibitor NC)、miR-199a-5p抑制剂(miR-199a-5p inhibitor)、FZD6下调质粒(FZD6 siRNA)、FZD6过表达质粒(pcDNA-FZD6)由上海生工生物有限公司合成。
1.2 方法
1.2.1 细胞培养在含10% FBS 和1% 青霉素和链霉素的DMEM 培养基中培养HepG2 细胞和HIBEC 细胞,于37 ℃、5% CO2的湿化培养箱中培养,取对数生长期的细胞按相应密度接种于6 孔板或12 孔板中,用于后续实验。
1.2.2 细胞转染取对数生长且状态良好的细胞,细胞长满后,加入胰酶消化,用含10% FBS 的DMEM 培养基重悬细胞,按1×105个/孔的密度将细胞铺于12 孔板中,细胞密度汇合达75% 时,细胞培养液替换为新鲜10% FBS DMEM,采用Turbofect 转染试剂按照说明书转染各组重组质粒,于37 ℃、5% CO2培养箱中培养48 h 后收集各组细胞RNA 样和蛋白样进行后续实验检测。
1.2.3 细胞增殖测定取对数生长且状态良好的细胞,当细胞密长满时,用胰酶消化细胞,弃胰酶,加入含10% FBS DMEM 培养基重悬细胞,将细胞铺于96 孔板中,细胞长到70%~80% 时,加入Turbofect 试剂转染质粒,每组重复8 个,于37 ℃、5% CO2培养箱中培养48 h 后,PBS 洗2 次,每孔加10 μLCCK-8 工作液,孵育4 h,在酶标仪上读取各孔在450 nm 处的吸光值(OD),并计算细胞活性。
1.2.4 细胞侵袭实验-20 ℃保存的Matrigel 取出后置于4 ℃冰箱中融化,Matrigel 中加入无FBS DMEM 培养基使其浓度为1 mg/mL,将100 μL 稀释后的Matrigel 添加于每个上室中,共同孵育5 h凝成胶状。取对数生长期的细胞,细胞长满后,PBS 洗两次,加入胰酶消化,添加适量无FBS的DMEM 培养基重悬细胞,使细胞悬液密度为5×105/mL,细胞悬液添加到Transwell 小室中,下室中添加10% FBS 的DMEM 培养基,置于37 ℃、5% CO2培养箱继续培养48 h 后,取出小室,PBS洗涤小室2 次,多聚甲醛固定20 min,0.1% 结晶紫染色15 min,随机选取5 个视野细胞放在显微镜下观察并记数。
1.2.5 双荧光素酶报告基因活性检测用生物学信息软件miRanda 和TargetScan 分别预测SNHG12 和miR-199a-5p 潜在结合基因,PCR 扩增SNHG12 全长片段及FZD63'UTR 片段后,构建SNHG12 wt、FZD6 wt 载体。SNHG12 wt、FZD6 wt 载体再通过点突变试剂盒构建SNHG12和FZD6 突变体。取对数生长且状态良好的细胞,用Turbofect 试剂转染各组重组质粒至细胞中,采用双荧光素酶活性检测试剂盒检测细胞的荧光素酶活性。
1.2.6 qRT-qPCR收取细胞RNA 样,样品中加入TRIzol 试剂从细胞中提取总RNA,测定RNA浓度及纯度后,通过Takara 反转录试剂盒反转录RNA 为cDNA,程序为第一步42 ℃,2 min;37 ℃ 15 min,第二步85 ℃ 5 s,反转录得到的cDNA 为实时荧光定量PCR 的模板,进行RTqPCR,使用2-△△Ct法分析定量结果。实验所用的引物见表1。
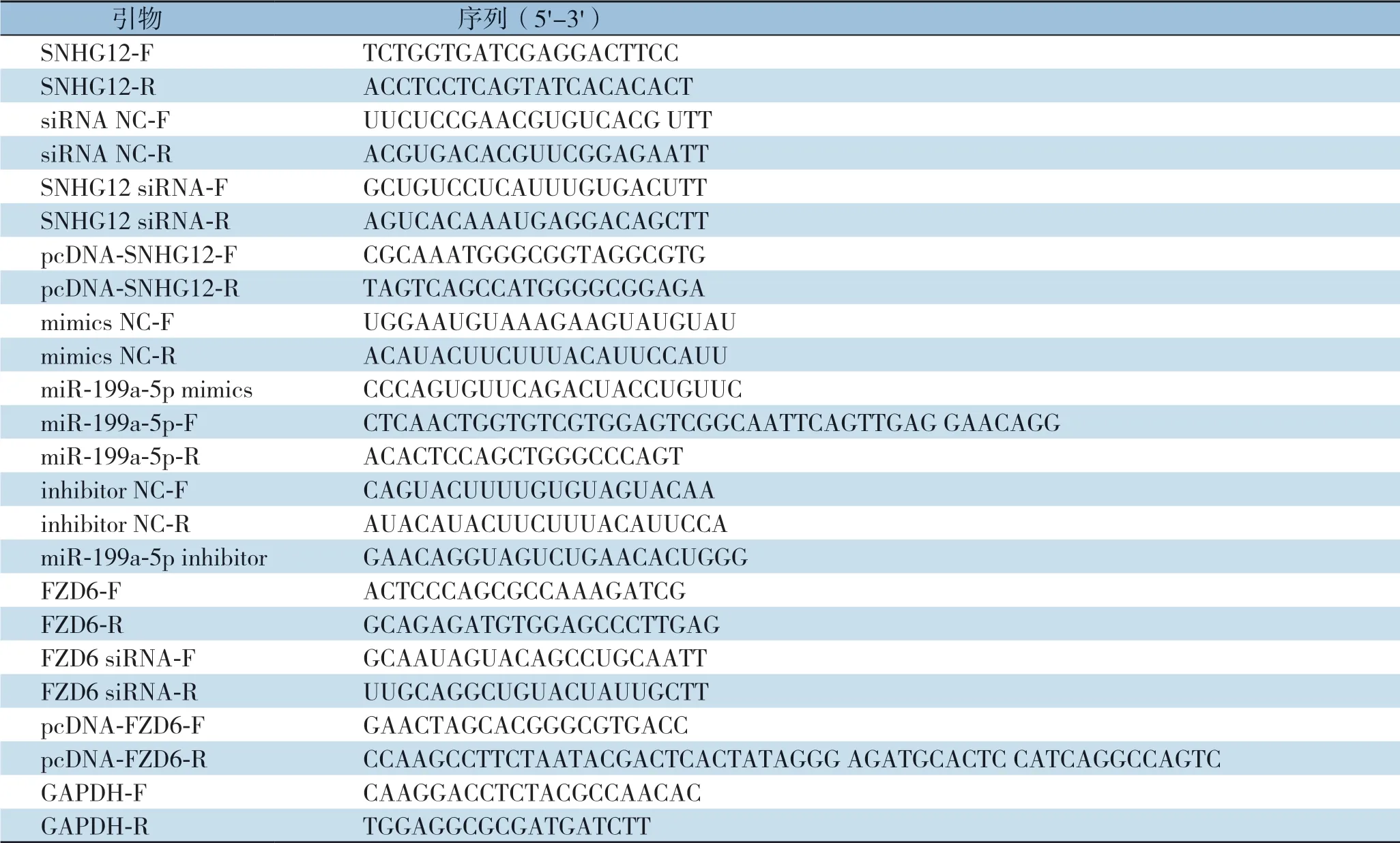
表1 引物序列Table1 Primer sequence
1.2.7 Western blot 检测质粒转染48 h 后收取细胞总蛋白样,蛋白样中加入100 μL 的蛋白裂解液、0.70 μL PMSF 配制预混剂,冰浴30 min,每隔10 min 弹1 次。4 ℃、12000 r/min 离心10 min。取2 μL 上清用BCA 检测法检测蛋白浓度,剩余上清加入5×SDS-PAGE 上样缓冲液,混匀,沸水浴10 min,取适量样品上样,进行SDSPAGE 电泳,将电压设置为70 V 30 min(浓缩胶),110 V 90 min(分离胶);电泳完毕后,蛋白胶经Bio-Rad 的半干转仪转印至0.22 μm 的PVDF 膜,在19 V 恒压状态下转膜30 min。封闭:转膜完成后,用含有50 g/L 脱脂奶粉的TBST 缓冲液室温封闭2 h;封闭完成,将PVDF 膜放入用含20 g/L 脱脂奶粉的TBST 缓冲液稀释好的一抗中,4 ℃过夜振荡孵育,一抗孵育好后,用TBST 洗膜6 次;二抗室温孵育2 h,TBST 缓冲液洗膜5 次后,使用凝胶成像仪曝光。
1.3 统计学处理
用GraphPad Prism5.0软件进行数据统计分析,数据用平均值±标准差(±s)表示,至少取3次独立实验结果。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,当P>0.05时,表示差异不显著;当P<0.05时,表示差异显著。
2 结果
2.1 下调SNHG12 对HepG2 细胞的增殖、侵袭和EMT 的影响
HepG2细胞中SNHG12的表达量明显高于HIBEC细胞(P<0.01)(图1A)。与siRNA NC组比较,SNHG12 siRNA组的SNHG12表达量明显降低(P<0.01)(图1B)。CCK-8结果显示,SNHG12 siRNA组的细胞增殖能力低于siRNA NC组(P<0.05)(图1C)。SNHG12 siRNA组细胞的侵袭数目低于siRNA NC组(P<0.05)(图1D-E)。与siRNA NC组比较,SNHG12 siRNA组E-cadherin蛋白表达量明显上升,N-cadherin、MMP-2和MMP-9蛋白表达量明显下降(均P<0.01)(图1F-I)。与SNHG12 siRNA组比较,siRNA NC组细胞形态变长,细胞间距变大,细胞间连接减弱(图1J)。以上结果表明下调SNHG12能够抑制HepG2细胞的增殖、侵袭和EMT。
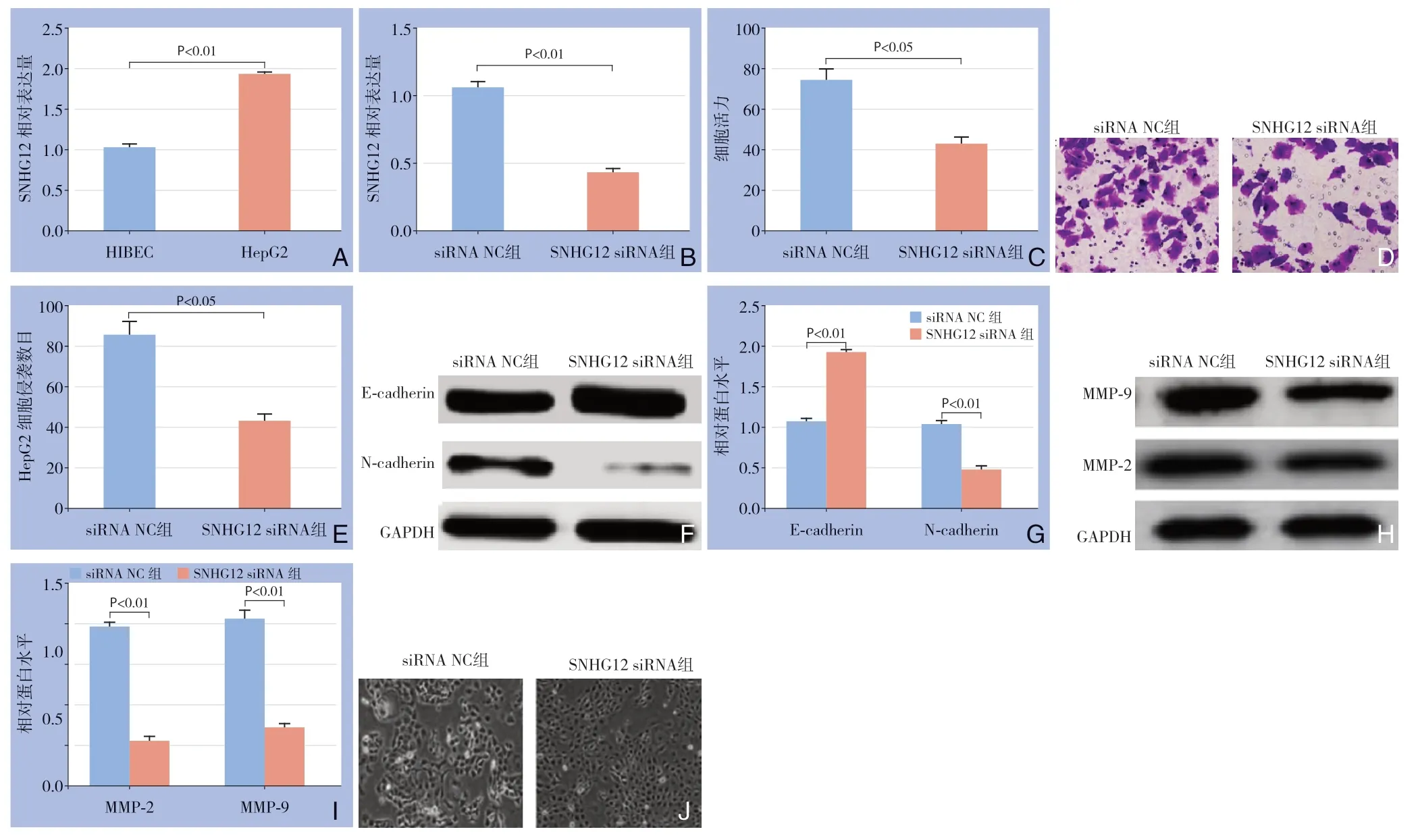
图1 下调SNHG12 抑制HepG2 细胞的增殖、侵袭和EMT A:qRT-PCR 检测SNHG12 在HepG2 和HIBEC 细胞中的表达量;B:qRT-PCR 检测干扰SNHG12 后HepG2 细胞中的SNHG12 的表达量;C:CCK-8 检测SNHG12 对HepG2 细胞增殖的影响;D:细胞侵袭实验检测SNHG12 对HepG2 细胞侵袭的影响;E:HepG2 细胞的侵袭数目;F:Western blot 检测SNHG12对HepG2 细胞内E-cadherin、N-cadherin 表达的影响;G:E-cadherin、N-cadherin 蛋白的相对表达量;H:Western blot检测SNHG12 对HepG2 细胞内MMP-2、MMP-9 表达的影响;I:MMP-2、MMP-9 蛋白的相对表达量;J:荧光显微镜观察HepG2 细胞形态Figure 1 Inhibitory effects of down-regulation of SNHG12 on proliferation,invasion and EMT of HepG2 cells A:The expression of SNHG12 in HepG2 and HIBEC cells detected by qRT-PCR;B:The expression level of SNHG12 in HepG2 cells after SNHG12 interference detected by qRT-PCR;C:The effect of SNHG12 on proliferation of HepG2 cells detected by CCK-8 assay;D:The effect of SNHG12 on invasion of HepG2 cells detected by Transwell assay;E:The invasion number of HepG2 cells;F:The effect of SNHG12 on the expressions of E-cadherin and N-cadherin in HepG2 cells determined by Western blot;G:Relative expression levels of E-cadherin and N-cadherin proteins;H:The effect of SNHG12 on the expressions of MMP-2 and MMP-9 in HepG2 cells determined by Western blot;I:Relative expression levels of MMP-2 and MMP-9 proteins;J:The morphology of HepG2 cells observed by fluorescence microscopy
2.2 SNHG12 和miR-199a-5p 之间的靶向关系
采用生物信息学软件miRanda预测SNHG12和miR-199a-5p之间的结合位点,结果见图2A。当质粒携带SNHG123'UTR wt时,miR-199a-5p的荧光素酶活性明显降低(P<0.01);当质粒携带SNHG123'UTR mut时,miR-199a-5p的荧光素酶活性无变化(P>0.05)(图2B)。表明SNHG12和miR-199a-5p具有靶向关系。
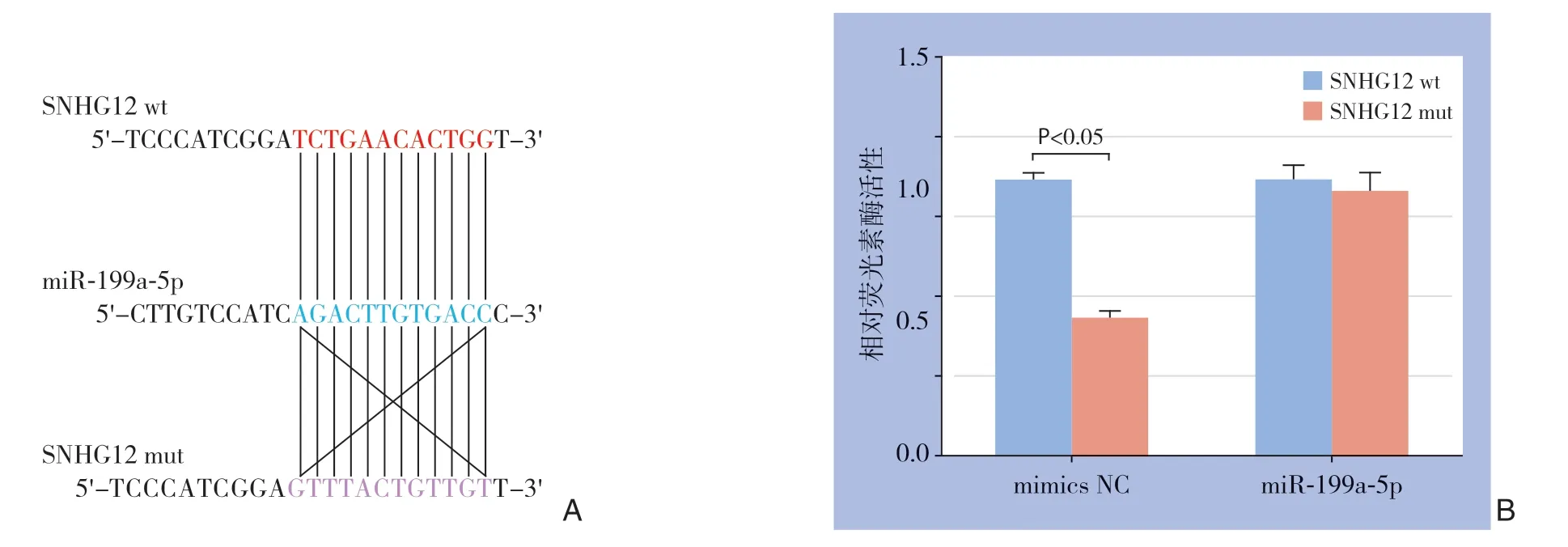
图2 SNHG12 和miR-199a-5p 之间的靶向关系 A:miRanda 预测SNHG12 和miR-199a-5p 之间的结合位点;B:荧光素酶表达量的测定Figure 2 Targeting relationship between SNHG12 and miR-199a-5p A:The binding sites between SNHG12 and miR-199a-5p predicted by miRanda;B:Determination of luciferase expression level
2.3 下调miR-199a-5p 对HepG2 细胞的增殖、侵袭和EMT 的影响
HepG2细胞中miR-199a-5p的表达量明显低于HIBEC细胞(P<0.01)(图3A)。与inhibitor NC组比较,miR-199a-5p inhibitor组的miR-199a-5p表达量明显下降(P<0.01)(图3B)。miR-199a-5p inhibitor组的细胞增殖能力明显高于inhibitor NC组(P<0.01)(图3C)。miR-199a-5p inhibitor组细胞的侵袭数目高于inhibitor NC组(P<0.05)(3D-E)。与inhibitor NC组比较,miR-199a-5p inhibitor组的E-cadherin蛋白表达量明显下降,N-cadherin、MMP-2和MMP-9蛋白表达量明显上升(均P<0.01)(图3F-I)。与inhibitor NC组比较,miR-199a-5p inhibitor组细胞间距变大,细胞形态拉长,排列不规则(图3J)。以上结果表明下调miR-199a-5p能够促进HepG2细胞的增殖、侵袭和EMT。
2.4 SNHG12 通过miR-199a-5p 调控HepG2 细胞的增殖、侵袭和EMT
与mimics NC组比较,miR-199a-5p mimics组m i R-199 a-5 p 的表达量明显增加(P<0.01)(图4 A)。与pcDNA-3.1(+)+mimics NC组比较,pcDNA-SNHG 12+mimics NC组细胞增殖能力明显增加(P<0.01),细胞侵袭数目明显增加(P<0.01),E-cadherin 蛋白表达量明显下降(P<0.01),N-cadherin、MMP-2和MMP-9蛋白表达量明显上升(均P<0.01),细胞形态出现细长、间距变宽、部分细胞伸出伪足;与pcDNA-3.1(+)+mimics NC组比较,pcDNA-3.1(+)+miR-199a-5p mimics组的细胞增殖能力下降(P<0.05),细胞侵袭数目明显减少(P<0.01),E-cadherin蛋白表达量明显上升(P<0.01),N-cadherin、MMP-2和MMP-9蛋白表达量明显下降(均P<0.01),细胞EMT形态学改变减弱;与pcDNA-3.1(+)+miR-199a-5p mimics组比较,pcDNA-SNHG12+miR-199a-5p mimics组的细胞增殖能力上升(P<0.05),细胞侵袭数目明显增加(P<0.01),E-cadherin蛋白表达量明显下降(P<0.01),N-cadherin、MMP-2和MMP-9蛋白表达量明显上升(均P<0.01),细胞间距变宽、形态逐渐变长,排列也不规整(图4B-I)。表明SNHG12通过miR-199a-5p调控HepG2细胞增殖、侵袭和EMT。
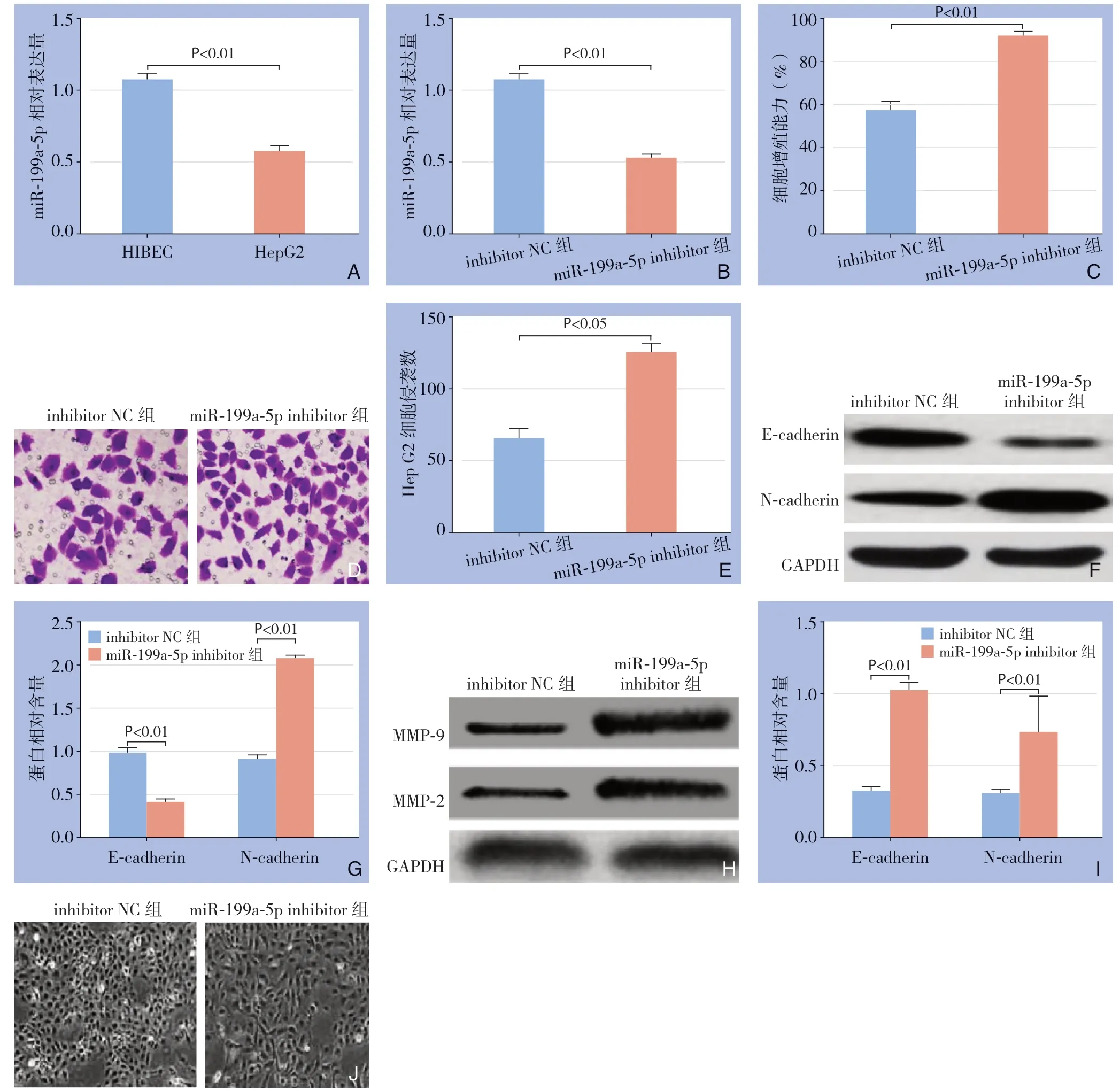
图3 下调miR-199a-5p 促进HepG2 细胞的增殖、侵袭和EMT A:RT-qPCR 检测miR-199a-5p 在HepG2 和HIBEC 细胞中的表达量;B:qRT-PCR 检测干扰miR-199a-5p 后细胞中miR-199a-5p 的表达量;C:CCK-8 检测miR-199a-5p 对HepG2 细胞增殖的影响;D:细胞侵袭实验检测miR-199a-5p 对HepG2 细胞侵袭的影响;E:HepG2 细胞的侵袭数目;F:Western blot 检测miR-199a-5p 对HepG2 细胞内E-cadherin、N-cadherin 表达的影响;G: E-cadherin、N-cadherin 蛋白的相对表达量;H:Western blot 检测miR-199a-5p 对HepG2 细胞内MMP-2、MMP-9 表达的影响;I:MMP-2、MMP-9 蛋白的相对表达量;J:荧光显微镜观察HepG2 细胞形态Figure 3 Enhancing effects of down-regulation of miR-199a-5p on proliferation,invasion and EMT of HepG2 cells A:The expression of miR-199a-5p in HepG2 and HIBEC cells detected by RT-qPCR;B:The expression level of miR-199a-5p in HepG2 cells after miR-199a-5p interference detected by qRT-PCR;C:The effect of miR-199a-5p on proliferation of HepG2 cells detected by CCK-8 assay;D:The effect of miR-199a-5p on invasion of HepG2 cells Transwell assay;E:The invasion number of HepG2 cells;F:The effect of miR-199a-5p on expressions of E-cadherin and N-cadherin in HepG2 cells determined by Western blot;G:Relative expression levels of E-cadherin and N-cadherin proteins;H:The effect of miR-199a-5p on the expressions of MMP-2 and MMP-9 in HepG2 cells determined by Western blot;I:Relative expression levels of MMP-2 and MMP-9 proteins;J:The morphology of HepG2 cells observed by fluorescence microscopy
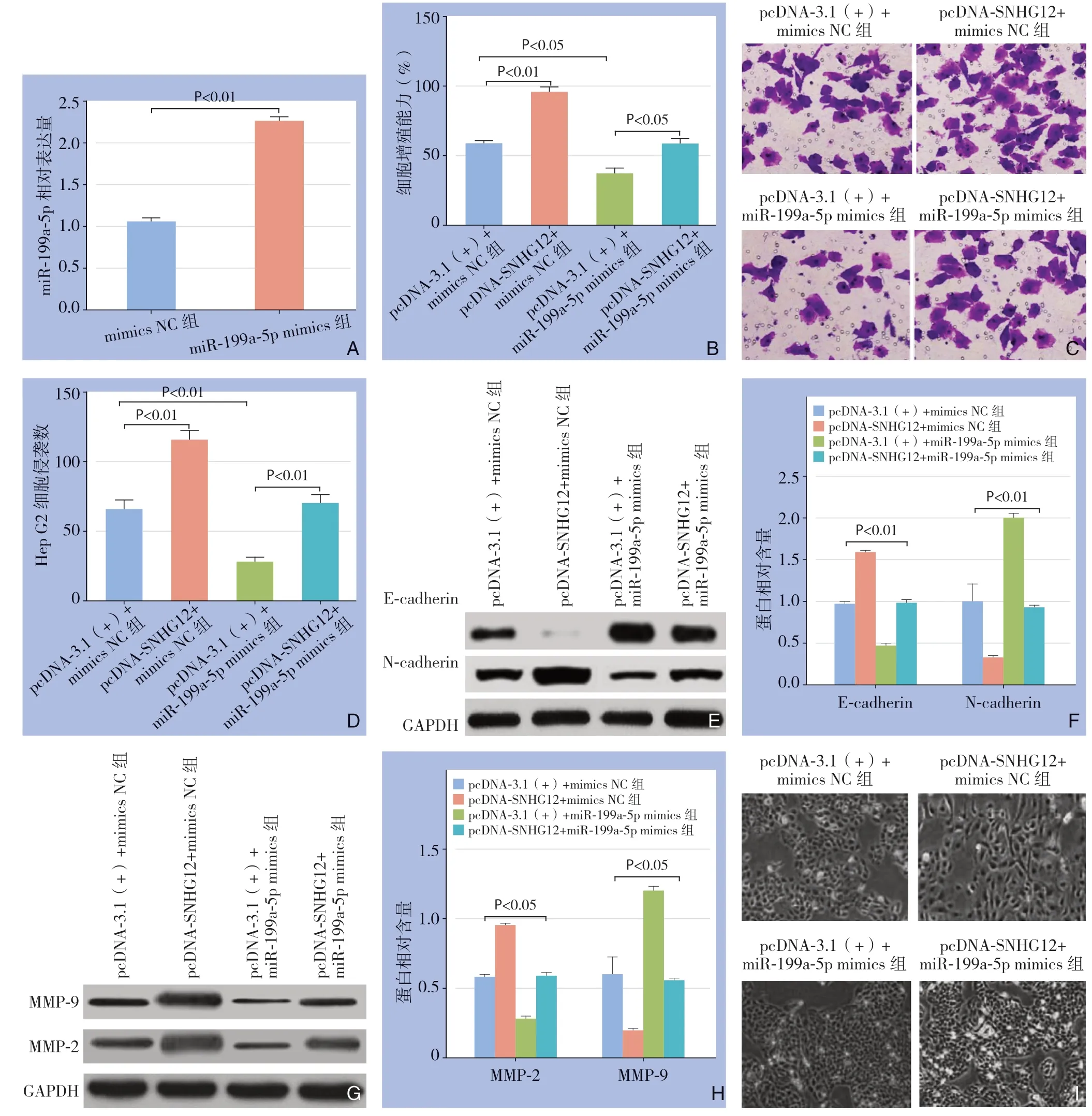
图4 SNHG12 通过miR-199a-5p 调控HepG2 细胞的增殖、侵袭和EMT A:qRT-PCR 检测过表达miR-199a-5p 后细胞中的miR-199a-5p 表达量;B:SNHG12 通过miR-199a-5p 影响HepG2 细胞增殖;C:SNHG12 通过miR-199a-5p 影响HepG2 细胞侵袭;D:HepG2 细胞的侵袭数目;E:SNHG12 通过miR-199a-5p 影响HepG2 细胞内E-cadherin、N-cadherin表达;F:E-cadherin、N-cadherin 蛋白的相对表达量;G:SNHG12 对通过miR-199a-5p 影响HepG2 细胞内MMP-2、MMP-9 表达;H:MMP-2、MMP-9 蛋白的相对表达量;I:荧光显微镜观察HepG2 细胞形态Figure 4 SNHG12 regulating the proliferation,invasion and EMT of HepG2 cells through miR-199a-5p A:The expression of miR-199a-5p in overexpressed miR-199a-5p cells detected by qRT-PCR;B:SNHG12 influencing the proliferation of HepG2 cells via miR-199a-5p;C:SNHG12 influencing the invasion of HepG2 cells via miR-199a-5p;D:The invasion number of HepG2 cells;E:SNHG12 influencing the expressions of E-cadherin and N-cadherin in HepG2 cells via miR-199a-5p;F:Relative expression levels of E-cadherin and N-cadherin proteins;G:SNHG12 influencing the expressions of MMP-2 and MMP-9 in HepG2 cells via miR-199a-5p;H:Relative expression levels of MMP-2 and MMP-9 proteins;I:The morphology of HepG2 cells observed by fluorescence microscopy
2.5 miR-199a-5p 和FZD6 之间的靶向关系
使用生物学软件TargetScan预测miR-199a-5p和FZD6之间的结合位点,结果见图5A。当质粒携带FZD63'UTR wt时,miR-199a-5p的荧光素酶活性下降(P<0.01);当质粒携带FZD63'UTR m u t 时,m i R-199 a-5 p 的荧光素酶活性无变化(P>0.05)(图5B)。表明FZD6和miR-199a-5p之间存在靶向关系。

图5 miR-199a-5p 和FZD6 之间的靶向关系 A:TargetScan 预测miR-199a-5p 和FZD6 之间的结合位点;B:荧光素酶表达量的测定Figure 5 Targeting relationship between miR-199a-5p and FZD6 A:TargetScan predicted binding sites between miR-199a-5p and FZD6;B:Determination of luciferase expression level
2.6 下调FZD6 对HepG2 细胞的增殖、侵袭和EMT 的影响
HepG2细胞中FZD6的表达量明显高于HIBEC细胞(P<0.01)(图6A)。与siRNA NC组比较,FZD6 siRNA组的FZD6表达量降低(P<0.05);和pcDNA-3.1(+)组比较,pcDNA-FZD6组的FZD6表达量明显升高(P<0.01)(图6 B)。由图6C CCK-8结果可知,FZD6 siRNA组的细胞增殖能力低于siRNA NC组(P<0.05);pcDNAFZD6组的细胞增殖能力高于pcDNA-3.1(+)组(P<0.05)。FZD6 siRNA组细胞的侵袭数目低于siRNA NC组(P<0.05);pcDNA-FZD6组的细胞侵袭数目明显高于pcDNA-3.1(+)组(P<0.01)(图6D-E)。与siRNA NC组比较,FZD6 siRNA组E-cadherin蛋白表达量明显上升(P<0.01),N-cadherin、MMP-2和MMP-9 蛋白蛋白表达量明显下降(P<0.01),细胞EMT形态学改变减弱;与pcDNA-3.1(+)组比较,pcDNA-FZD6组E-cadherin蛋白表达量明显下降(P<0.01),N-cadherin、MMP-2和MMP-9蛋白蛋白表达量明显上升(P<0.01),细胞出现排列不整齐,紧密连接逐渐变离散,有拉长现象(图6F-J)。以上结果表明下调FZD6能够抑制HepG2细胞的增殖、侵袭和EMT,过表达FZD6能够促进HepG2细胞的增殖、侵袭和EMT。
2.7 SNHG12 通过miR-199a-5p 调控FZD6 的表达
与siRNA NC组比较,SNHG12 siRNA组的FZD6表达量明显降低(P<0.01);与pcDNA-3.1(+)组比较,pcDNA-SNHG12组的FZD6表达量明显升高(P<0.01)(图7A-C),表明SNHG12和FZD6存在正调控关系。与siRNA NC组比较,SNHG12siRNA组的m i R-199 a-5 p 表达量明显升高(P<0.01);与pcDNA-3.1(+)组比较,pcDNA-SNHG12组的miR-199a-5p表达量明显降低(P<0.01)(图7D),表明SNHG12和miR-199a-5p存在负调控关系。与inhibitor NC组比较,miR-199a-5p inhibitor组FZD6表达量明显升高(P<0.01);与mimics NC组比较,miR-199a-5pmimics组FZD6表达量明显降低(P<0.01)(图7E-G),表明miR-199a-5p和FZD6存在负调控关系。与siRNA NC+inhibitor NC组比较,SNHG12 siRNA+inhibitor NC组的FZD6表达量明显降低(P<0.01),siRNA NC+miR-199a-5p inhibitor组FZD6表达量明显升高(P<0.01),而与siRNA NC+miR-199a-5p inhibitor组比较,SNHG12 siRNA+miR-199a-5p inhibitor组FZD6表达量明显降低(P<0.01)(图7H-J)。表明SNHG12能够通过miR-199a-5p调控FZD6的表达。
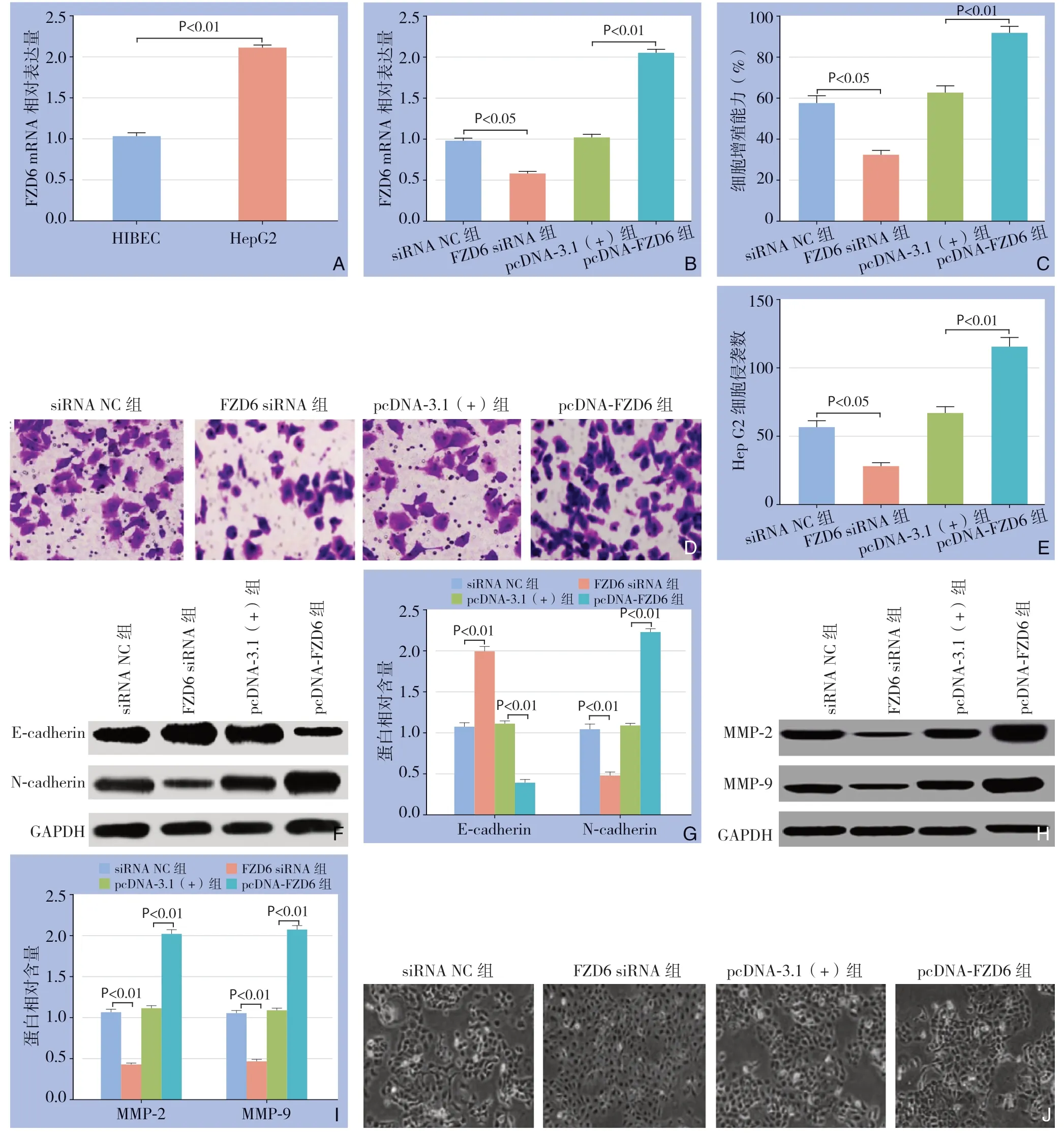
图6 下调FZD6 抑制HepG2 细胞的增殖、侵袭和EMT A:qRT-PCR 检测FZD6 在HepG2 和HIBEC 细胞中的表达量;B:qRT-PCR 检测干扰及过表达FZD6 后HepG2 细胞中FZD6 的表达量;C:CCK-8 检测FZD6 对HepG2 细胞增殖的影响;D:细胞侵袭实验检测FZD6 对HepG2 细胞侵袭的影响;E:HepG2 细胞的侵袭数目;F:Western blot 检测FZD6 对HepG2 细胞内E-cadherin、N-cadherin 表达的影响;G:E-cadherin、N-cadherin 蛋白的相对表达量;H:Western blot 检测FZD6 对HepG2 细胞内MMP2、MMP9 表达的影响;I: MMP2、MMP9 蛋白的相对表达量;J:荧光显微镜观察HepG2细胞形态Figure 6 Inhibitory effects of down-regulation of FZD6 on proliferation,invasion and EMT of HepG2 cells A:The expression of FZD6 in HepG2 and HIBEC cells detected by qRT-PCR;B:The expression level of FZD6 in HepG2 cells after FZD6 interference detected by qRT-PCR;C:The effect of FZD6 on proliferation of HepG2 cells CCK-8 assay;D:The effect of FZD6 on invasion of HepG2 cells detected by Transwell assay;E:The invasion number of HepG2 cells;F:The effect of FZD6 on the expressions of E-cadherin and N-cadherin in HepG2 cells determined by Western blot;G:Relative expression levels of E-cadherin and N-cadherin proteins;H:The effect of FZD6 on expressions of MMP-2 and MMP-9 in HepG2 cells determined by Western blot;I:Relative expression levels of MMP-2 and MMP-9 proteins;J:The morphology of HepG2 cells observed by fluorescence microscopy
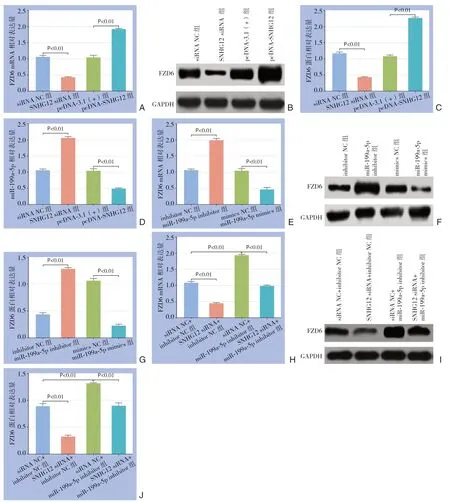
图7 SNHG12 通过miR-199a-5p 调控FZD6 的表达 A:qRT-PCR 检测过表达及下调SNHG12 后FZD6 的mRNA 表达;B:Western blot 检测过表达及下调SNHG12 后FZD6 的蛋白表达;C:FZD6 的蛋白相对表达量;D:qRT-PCR 检测过表达及下调SNHG12 后miR-199a-5p 的表达;E:RT-qPCR 检测过表达及下调miR-199a-5p 后FZD6 的mRNA 表达;F:Western blot 检测过表达及下调miR-199a-5p 后FZD6 的蛋白表达;G:FZD6 的蛋白相对表达量;H:qRT-PCR 检测SNHG12通过miR-199a-5p调控FZD6的mRNA表达;I:Western blot 检测SNHG12通过miR-199a-5p调控FZD6的蛋白表达;J:FZD6 的蛋白相对表达量Figure 7 SNHG12 regulating the expression of FZD6 through miR-199a-5p A:FZD6 mRNA expression after overexpression or down-regulation of SNHG12 detected by qRT-PCR;B:FZD6 protein expression after overexpression or down-regulation of SNHG12 detected by Western blot;C:The relative expression of FZD6 protein;D:The expression of miR-199a-5p after overexpression or downregulation of SNHG12 detected by qRT-PCR;E:The mRNA expression of FZD6 after overexpression or down-regulation of miR-199a-5p detected by qRT-PCR;F:FZD6 protein expression after overexpression or down-regulation of miR-199a-5p detected by Western blot;G:The relative expression of FZD6 protein;H:The expression of FZD6 regulated by SNHG12 through miR-199a-5p detected by qRT-PCR;I:FZD6 protein expression regulated by SNHG12 through miR-199a-5p detected by Western blot;J:The relative expression of FZD6 protein
3 讨论
越来越多的研究表明,lncRNA在多种生理、病理过程以及恶性疾病中失调[14-15],且发现lncRNA在各种癌症中异常表达,可作为癌症的诊断和预后标志物发挥作用[16-17]。如研究表明LncRNA SNHG15在胶质瘤血管内皮细胞中高表达,能通过负调控miR-153影响胶质瘤微血管内皮细胞的生长[18];lncRNA PVT1在胃癌组织和细胞中表达明显上调,通过海绵miR-186促进胃癌的进展[19]。最近研究发现lncRNA SNHG12与各种癌症的发展过程密切相关。如有文献[20]报道lncRNA SNHG12在非小细胞肺癌中通过海绵miR-181a激活MAPK/Slug通路,从而导致顺铂、紫杉醇、吉非替尼的耐药。研究表明长lncRNA SNHG12通过上调人骨肉瘤细胞中血管蛋白基因的表达来促进细胞增殖和迁移[12]。lncRNA SNHG12通过调节/β-catenin Wnt信号通路促进乳头状甲状腺癌的增殖和转移[21]。而本研究lncRNA SNHG12在HCC中的临床意义时,发现与正常细胞相比,SNHG12在HCC细胞中表达上调,干扰SNHG12的表达抑制了HepG2细胞的增殖、侵袭和EMT,而过表达SNHG12能够促进HepG2细胞的增殖、侵袭和EMT进程。以上结果表明SNHG12能够作为癌基因在HCC发展过程中发挥作用,提示SNHG12可作为HCC的预后标志物。
越来越多的研究[22-24]表明,lncRNA作为竞争内源性RNA或miRNA海绵,参与调控多种细胞生物学活动。本研究通过生物信息学分析观察到SNHG12与miR-199a-5p具有靶向关系,且通过双荧光素酶实验证实miR-199a-5p可以与SNHG12结合。最近研究表明miR-199a-5p能够在各种癌症中发挥关键作用。如miR-199a-5p在HCC中作为Warburg效应的抑制因子,和HIF-1α形成一个正反馈循环促进HCC细胞的糖酵解[25];下调miR-199a-5p通过调节MLK3/NF-κB通路有助于膀胱移行细胞癌的肿瘤发生[26];此外沉默miR-199a-5p能够上调DDR1和激活EMT相关信号通路促进结直肠癌的发展[27],miR-199a-5p在体外能减弱人肾透明细胞癌细胞的侵袭过程[28]。本研究首次研究miR-199a-5p的临床意义,并探讨其在HCC发展过程中的作用。结果表明,miR-199a-5p在HCC细胞中的表达明显低于正常细胞。干扰miR-199a-5p促进了HCC细胞的增殖、侵袭和EMT,过表达miR-199a-5 p 则抑制了HCC细胞的增殖、侵袭和EMT,且SNHG12能够通过miR-199a-5p调控HCC细胞的发展。此外本研究发现miR-199a-5p和FZD6具有靶向关系,并通过双荧光素酶实验证实miR-199a-5p可以与FZD6结合。
研究表明FZD6是一个与EMT进程和肿瘤发生发展息息相关的基因,如文献报道结直肠癌患者中FZD6高表达,过表达FZD6表达能够促进癌细胞发展[29];miR-21能够靶向FZD6激活非典型Wnt通路抑制胃癌细胞的增殖和迁移[30]。研究还表明NPTX2与FZD6相互作用,使MYC、cyclin D1、snail和N-cadherin的表达增加,同时E-cadherin的表达减少[31]。研究发现FZD6在60%~90%的肝细胞癌组中表达上调,在50%癌前病变组织中高表达,且研究表明敲低FZDs可以抑制癌细胞生长、侵袭、转移,表明FZD6可能在HCC发展中起作用。我们发现FZD6在HCC细胞中的表达明显高于正常细胞,下调FZD6的表达抑制了HepG2细胞的增殖、侵袭和EMT,而过表达FZD6能够促进HepG2细胞的增殖、侵袭和EMT进程。且过表达SNHG12能够促进FZD6的表达,下调SNHG12抑制FZD6的表达,表明SNHG12和FZD6存在正调控关系;而过表达miR-199a-5p抑制FZD6的表达,下调miR-199a-5p促进FZD6的表达,表明miR-199a-5p和FZD6存在负调控关系;另外发现SNHG12能够通过miR-199a-5p调控FZD6的表达。
综上所述,上调lncRNA SNHG12通过miR-199a-5p/FZD6轴促进HCC的增殖、侵袭和EMT。本研究为进一步了解HCC发展的分子机制提供了理论基础,同时也为HCC患者的临床诊断和治疗提供了试验依据。但是这仅仅只是一方面,有关lncRNA SNHG12、miR-199a-5p和FZD6在HCC中的作用机制还需更近一步研究。
