曙红催化的溴代芳烃硼化反应研究
2021-03-15冯乙巳
荣 春, 冯乙巳,2
(1.合肥工业大学 化学与化工学院,安徽 合肥 230009; 2.安徽省杂环实验室,安徽 合肥 230009)
芳基硼酸和酯是合成有机化学中的重要和常用合成原料,由于其对空气和水分的稳定性、低毒性和易于处理等优点,在化学、医药和材料科学等领域广泛用于形成碳碳或碳杂原子键构建有机分子[1]。
较早芳基硼酸酯的合成方法包括格氏试剂和有机锂试剂与硼酸三烷基酯反应制备[2-3],但是这些反应存在官能团耐受性差,需要严格的无水条件等限制。近几十年来,过渡金属催化芳香族卤化物或拟卤化物的硼化反应得到广泛研究[4-6],成为合成芳基硼酸酯的常用而有效的方法。该方法具有反应底物来源广泛和良好的官能团相容性。但过渡金属催化的芳烃硼酯化反应通常需要昂贵的配体助催化,以及反应液中剩有金属残渣难以去除等缺点,使其在工业实际应用中受到限制。近些年来,使用无过渡金属催化的卤代苯光催化芳基硼酸酯合成引起了人们的广泛关注[7-13]。文献[14]在紫外辐射条件下,利用连续流反应器,研究芳基碘化物和溴化物在低温水溶液中,能够快速且有化学选择性的合成芳基硼酸酯。文献[15]报道具有实用价值的芳基卤代物的光催化硼化反应,以fac-Ir(ppy)3为光催化剂,以CH3CN/H2O作为混合溶剂,在添加剂n-Bu3N的促进下,以良好的收率获得了芳基硼酸酯,反应的产率在48%~89%之间。然而该类贵金属光催化剂价格昂贵且毒性大。
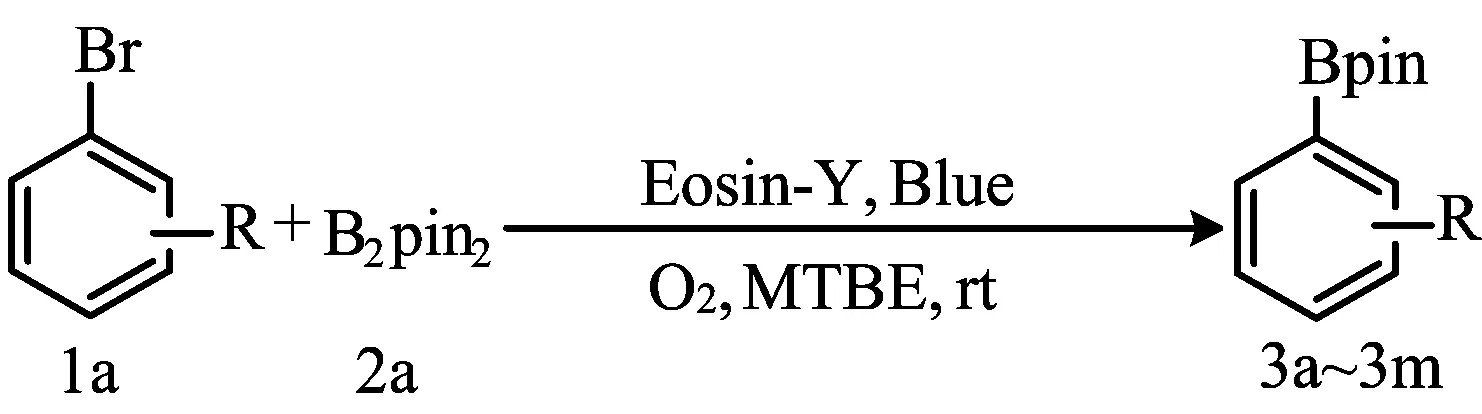
光催化有机反应被认为是最环保途径之一,是“绿色”化学合成的条件[16]。虽然已有一些有效的光催化芳基硼酸酯合成方法[17-18],但大多数需要贵金属光催化剂和在紫外光条件下实现反应转换,限制了该类方法工业生产的实用性。本文研究以廉价和易得的曙红为催化剂,在可见光辐射下催化卤代芳烃与频哪醇硼酸酯反应,实现C-B键偶联反应,并表现出较好的实际应用前景。研究涉及的反应如下:
1 实验部分
1.1 仪器与试剂
安捷伦VNMRS 600M型超导核磁共振波谱仪(nuclear magnetic resonance,NMR)(CDCl3为溶剂,TMS 为内标); Waters LCT Premier XE 型高分辨质谱仪(high resolution mass spectrometer,HR-MS); Trace 1300 型气相色谱仪;HSGF254高效薄层层析硅胶板(烟台汇友开发有限公司);HSGF254型薄层板硅胶(300 ~ 400目)(青岛海洋化工分厂)。所用试剂均为商品分析纯或化学纯。
1.2 卤代芳烃化合物的硼化反应
向带有螺纹盖的干燥的20 mL反应管中放入磁子后,依次加入联硼酸频哪醇酯(0.4 mmol,101.6 mg)、溴苯(0.2 mmol,31.4 mg)和2 mL无水叔丁基甲基醚;密封反应管并将其放置于2个36 W蓝色LED灯(距离2个灯位置5 cm)中间位置,在室温下搅拌反应48 h。反应完成后,加入3 mL乙酸乙酯淬灭反应溶液,抽滤、滤液浓缩后得到粗产物。使用200~300目硅胶柱色谱分离目标产物,并在45 ℃的真空干燥箱中过夜。称量产物质量并计算反应产物收率,与内标法检测产品收率比较。然后将获得的纯产品用无水CDCl3溶解,并通过核磁共振波谱仪检测来确定产物分子结构。
1.3 产物核磁共振谱
4,4,5,5-四甲基-2-苯基-1,3,2-二氧杂硼杂环戊烷(3a):淡黄色液体,收率50%;1H NMR (600 MHz, CDCl3)δ7.85 (d,J=7.0 Hz, 2H), 7.47 (d,J=7.4 Hz, 1H), 7.39 (t,J=7.4 Hz, 2H), 1.37 (s, 12H);13C NMR (151 MHz, CDCl3)δ134.76 (s), 131.27 (s), 127.72 (s), 83.75 (s), 77.29 (s), 77.08 (s),76.87 (s),24.89(s);11B NMR(CDCl3,102.7 MHz)29.9;EI-MS M+m/z204.1。
4,4,5,5-四甲基-2-邻甲苯基-1,3,2-二氧杂硼杂环戊烷(3b):淡黄色液体,收率52%;1H NMR(600 MHz, CDCl3)δ7.70 (d,J=7.8 Hz, 2H), 7.18 (d,J=7.7 Hz, 2H), 2.36 (s, 3H), 1.33 (s, 12H);13C NMR (151 MHz, CDCl3)δ141.37 (s), 134.77 (s), 128.49 (s), 83.59 (s), 77.21 (s), 77.00 (s), 76.79 (s), 24.83 (s), 21.71 (s);11B NMR (CDCl3, 102.7 MHz) 30.2;EI-MS M+m/z218.1。
2-(4-甲氧基苯基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(3c):淡黄色液体,收率45%;1HNMR (600 MHz, CDCl3)δ7.75 (d,J=8.6 Hz, 2H), 6.89 (d,J=8.7 Hz, 2H), 3.81 (s, 3H), 1.32 (s, 12H);13C NMR (151 MHz, CDCl3)δ162.11 (s), 136.48 (s), 113.27 (s), 83.52 (s), 77.22 (s), 77.01 (s), 76.80 (s), 55.06 (s), 24.84 (s);11B NMR (CDCl3, 102.7 MHz) 30.8; EI-MS M+m/z234.1。
2-(4-氯苯基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(3d):无色液体,收率55%;1H NMR (600 MHz, CDCl3)δ7.72 (d,J=8.2 Hz, 2H), 7.33 (d,J=8.3 Hz, 2H), 1.32 (s, 12H);13C NMR (151 MHz, CDCl3)δ137.49 (s), 136.09 (s), 127.97 (s), 83.98 (s), 77.21 (s), 76.99 (s), 76.78 (s), 24.83 (s);11B NMR (CDCl3, 102.7 MHz) 29.5; EI-MS M+m/z238.1。
4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯甲腈(3e):白色固体,收率44%;1H NMR (600 MHz, CDCl3)δ7.86 (d,J=8.1 Hz, 2H), 7.62 (d,J=8.1 Hz, 2H), 1.33 (s, 12H);13C NMR (151 MHz, CDCl3)δ135.06 (s), 131.09 (s), 118.83 (s), 114.49 (s), 84.46 (s), 77.22 (s), 77.01 (s), 76.80 (s), 24.83 (s);11B NMR (CDCl3, 102.7 MHz) 30.4; EI-MS M+m/z229.1。
2-(3-甲氧基苯基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(3f):无色液体,收率52%;1H NMR (600 MHz,CDCl3)δ7.40(t,J=8.4 Hz, 1H), 7.32 (d,J=2.5 Hz, 1H), 7.29 (dd,J=9.7, 5.7 Hz, 1H), 7.00 (ddd,J=10.9, 5.8, 0.7 Hz, 1H), 3.82 (s, 3H), 1.34 (s, 12H);13C NMR (151 MHz, CDCl3)δ159.00 (s), 128.91 (s), 127.15 (s), 118.64 (s), 117.89 (s), 83.80 (s), 77.22 (s), 77.01 (s), 76.80 (s), 55.22 (s), 24.95~24.75 (m);11B NMR (CDCl3,102.7 MHz)30.8;EI-MS M+m/z234.5。
2-(3-氯苯基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(3g):无色液体,收率60%;1H NMR (600 MHz, CDCl3)δ7.77 (d,J=1.3 Hz,1H),7.66 (d,J=7.3 Hz,1H),7.41(ddd,J=7.9,2.1,1.1 Hz,1H),7.29(t,J=7.7 Hz, 1H), 1.33 (s, 12H);13C NMR (151 MHz, CDCl3)δ134.53 (s), 134.00 (s), 132.62 (s), 131.23 (s), 129.16 (s), 84.10 (s), 77.22 (s), 77.01 (s), 76.80 (s), 24.93~24.74 (m);11B NMR (CDCl3,102.7 MHz)30.3;EI-MS M+m/z238.5。
4,4,5,5-四甲基-2-间甲苯基-1,3,2-二氧杂硼杂环戊烷(3h):淡黄色液体,收率59%;1H NMR (600 MHz, CDCl3)δ7.63 (s, 1H), 7.62~7.58 (m, 1H), 7.28~7.25 (m, 2H), 2.35 (s, 3H), 1.34 (s, 12H);13C NMR (151 MHz, CDCl3)δ137.11 (s), 135.30 (s), 132.01 (s), 131.74 (s), 127.67 (s), 83.69 (s), 77.21 (s), 77.00 (s), 76.79 (s), 24.84 (s), 21.25 (s);11B NMR (CDCl3, 102.7 MHz) 30.2;EI-MS M+m/z218.1。
4,4,5,5-四甲基-2-对甲苯基-1,3,2-二氧杂硼杂环戊烷(3i):淡黄色液体,收率45%;1H NMR (600 MHz, CDCl3)δ6.52 (d,J=6.9 Hz, 1H), 6.22~6.11 (m, 1H), 6.02 (dd,J=12.6, 7.2 Hz, 2H), 1.35 (s, 3H), 0.18 (s,12H);13C NMR (151 MHz, CDCl3)δ149.78 (s), 140.81 (s), 136.08 (s), 135.00 (s), 130.02 (s), 122.55 (s), 88.76 (s), 29.55 (d,J=0.9 Hz), 26.72 (s), 6.07 (s), 5.93 (s), 5.79 (s), 5.65 (s), 5.51 (s), 5.38 (s);11B NMR (CDCl3, 102.7 MHz) 29.9;EI-MS M+m/z218.1。
2-(2-氯苯基)-4,4,5,5-四甲基-1,3,2-二氧硼戊环(3j):无色液体,收率52%;1H NMR (600 MHz,CDCl3)δ7.67 (dd,J=7.3, 1.0 Hz, 1H), 7.35~7.29 (m, 2H), 7.26~7.18 (m, 1H); 1.36 (s, 12H).13C NMR (151 MHz, CDCl3)δ139.52 (s), 136.39 (s), 131.81 (s), 129.35 (s), 125.78 (s), 84.12 (s), 77.25 (s), 77.04 (s), 76.82 (s), 24.77 (d,J=2.7 Hz);11B NMR(CDCl3,102.7 MHz) 30.5;EI-MS M+m/z238.5。
2-(3,5-二甲基苯基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(3k):无色液体,收率42%;1H NMR (600 MHz,CDCl3)δ7.46(s,2H),7.11(s, 1H), 2.33 (s, 6H), 1.35 (s, 12H);13C NMR (151 MHz, CDCl3)δ137.13 (s), 132.97 (s), 132.39 (s), 83.65 (s), 77.25 (s), 77.04 (s), 76.83 (s), 24.96~24.78 (m), 21.13 (s);11B NMR (CDCl3,102.7 MHz)30.8;EI-MS M+m/z248.5。
2-均三甲苯基-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(3l):无色液体,收率37%;1H NMR (600 MHz, CDCl3)δ6.77 (s, 2H); 2.36 (s, 6H), 2.23 (s, 3H), 1.37 (s, 12H);13C NMR (151 MHz, CDCl3)δ142.08 (s), 138.88 (s), 127.41 (s), 83.43 (s), 77.22 (s), 77.01 (s), 76.79 (s), 24.93 (s), 22.17 (s), 21.22 (s);11B NMR (CDCl3, 102.7 MHz) 32.3; EI-MS M+m/z262.5。
2-(联苯-4-基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(3m): 无色液体,收率37%;1H NMR (600 MHz, CDCl3)δ7.88 (d,J=8.0 Hz, 2H), 7.63~7.58 (m, 4H), 7.44 (t,J=7.7 Hz, 2H), 7.35 (t,J=7.4 Hz, 1H),1.36 (s,12H);13C NMR (151 MHz,CDCl3)δ143.85(s),140.98(s),135.22 (s), 128.74 (s),127.53(s),127.21(s),126.44(s),83.80(s),77.21 (s),77.00 (s),76.79 (s),24.87 (s).11B NMR (CDCl3, 102.7 MHz) 31.2; EI-MS M+m/z280.1。
2 结果与讨论
2.1 模型反应优化
以溴苯(1a)为卤代芳烃底物,与双频哪醇二硼(B2pin2)(2a)的C-B偶联反应为模型反应,研究催化剂、光源、反应溶剂和反应时间等因素对模型反应的影响,反应结果见表1所列。
本文首先研究筛选了常见的有机染料光催化剂Eosin Y、 Eosin B、罗丹明B和荧光素等对模型反应的影响(序号1~4)。结果发现该类有机光催化剂都能够有效催化卤代芳烃与频那醇硼酸酯的偶联反应,产物收率分别为31%、19%、24%和26%,因此选择Eosin Y作为反应催化剂进行深入研究。
不同波长的光源(序号5~8)对模型反应研究发现,在无光照射的黑暗条件下和绿光照射下,几乎没有检测到产物;相同条件下在白光照射反应产率为8%;在蓝光下,反应的收率达到了31%。由此可见照射光源的能量越高,对反应越有利,反应产率越高。但紫外光条件下反应产率却下降为20%,可能由于高能量紫外光破坏反应中间体而导致产物收率降低。因此蓝光为模型反应的最优光源。
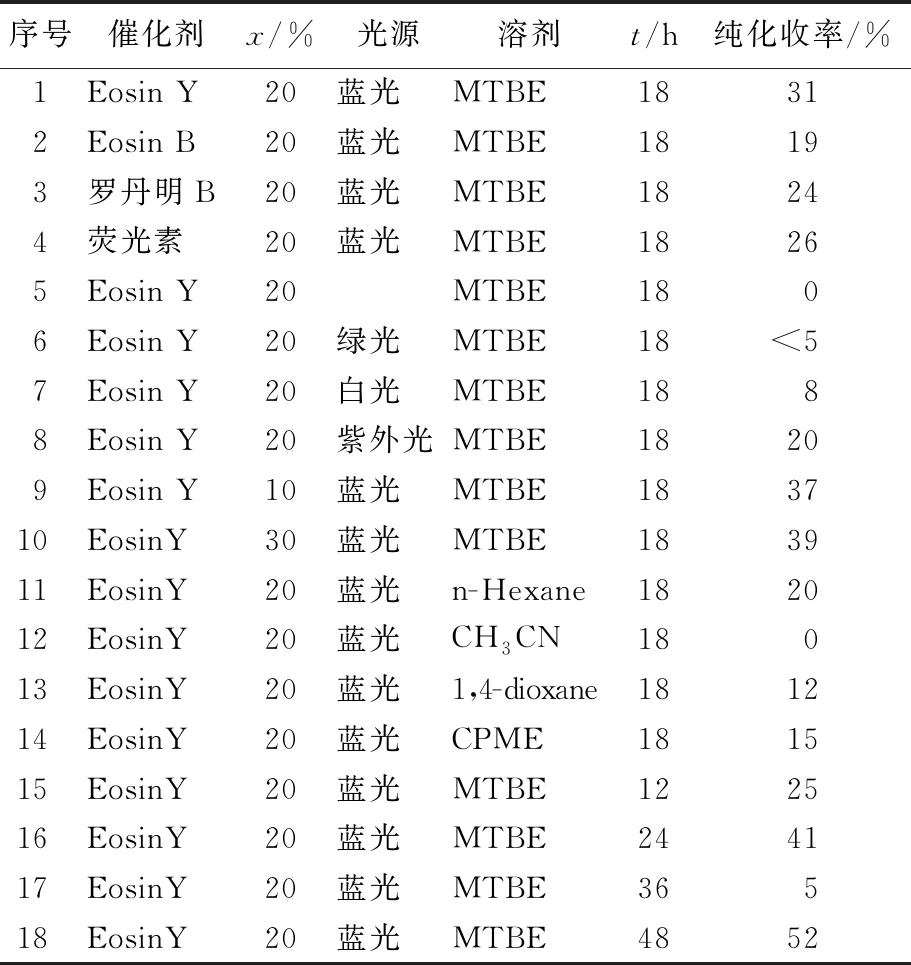
表1 模型反应条件优化
研究催化剂的用量(序号9~10)对反应收率影响,发现Eosin Y用量从10%增加到30%,对反应收率影响较小,因此后续试验选用较低催化剂用量。筛选不同溶剂(序号11~14)对硼化反应影响发现,溶剂对产物收率有较大影响。乙腈溶剂未检测到反应产物,而苯、1,4-dioxane和正己烷等溶剂中得到较低收率的反应产物。应用甲基叔丁基醚作为溶剂反应收率最高,可达31%,而改换成其他醚类试剂时,收率均没有提高(表1未列出)。
最后进行反应时间(序号15~18)对模型反应影响研究。随着反应时间从15 h延长到48 h,反应的产率由25%升高到52%。但反应时间从36 h延长到48 h时,产物产率只提高了2%,产物收率提高有限,因此以36 h为后续反应优选时间。
通过模型优化条件研究,确定反应的最优条件为:10% EosinY为催化剂,36 W 蓝光作为激发光源,4 eq B2pin2为硼源,叔丁基甲基醚为溶剂,在室温下反应36 h。
2.2 底物适应性研究
在模型反应优化条件基础上,进一步对该反应产物适应性进行研究,结果如图1所示。反应结果显示,在优化条件下拓展的反应产物都具有较好的收率。当卤代芳烃苯环无论烷烃、有卤和各种含氧官能团时,反应都能顺利进行,并具有中等以上产物收率。当溴代芳烃对位具有常见吸电子基团时,产物收率中等及偏上(如图1d~图1e)。如对位有吸电子基—Cl时,收率可达到55%(图1d);对位取代基为氰基(—CN)收率则达到44%(图1f)。而溴代芳烃底物对位有供电子基团如甲基(—CH3)和甲氧基(—OMe)等时,产物收率都低于取代基在间位的收率,收率最高也只有52%(如图1b、图1c)。对卤代芳烃具有邻位有取代基时,电子效应对产物收率影响较小,与未取代溴苯接近(如图1i、图1j)。
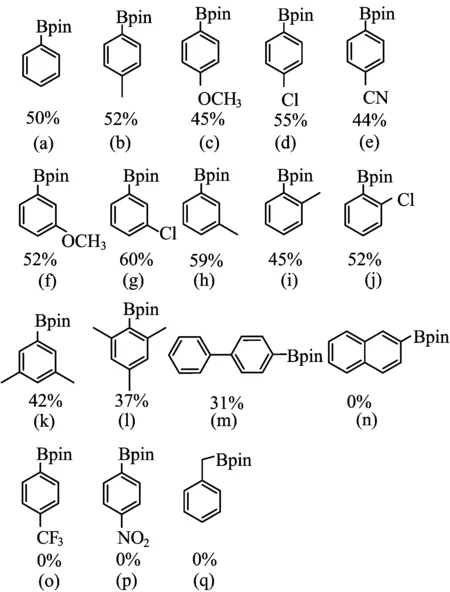
图1 产物及其收率
而当间位是给电子取代基,产物收率有提高,如间甲氧基溴苯收率只有52%(图1f)。与已经报道的金属催化的芳基卤代物的硼化反应比较,该反应体系对多取代芳烃也可顺利进行反应,虽然由于多取代空间位阻和电子云效应反应产物收率有所降低,但也表现出较好的反应性能(图1k、图1l)。如邻氯溴苯(图1k)延长反应时间至60 h产物收率也能够达到42%。另外,反应体系对萘环以及强吸电子基团并不兼容(图1n、图1q)。此外,体系中加入苄基溴和对二溴苯也并没检测到产物,体系的兼容性局限在苯环以及常见的供电子基团,这是反应的局限性,在后续研究中将会进一步拓展其产物范围。
2.3 反应机理研究
结合文献调研,当向该反应体系中额外加入1,1-二苯乙烯时,产物3a~3m的收率均有不同程度下降。可见自由基捕捉剂抑制反应的进行。加入其他自由基捕捉剂TEMPO(2,2,6,6-四甲基哌啶氮氧化物)、BHT(2,6-二叔丁基-4-甲酚),目标产物3a~3m同样检测到被抑制生成。据此本文推测反应可能为自由基加成反应。
3 结 论
本文以有机染料Eosin Y为催化剂,溴代芳烃与频那醇硼酸酯在光照条件下直接偶联合成芳烃硼酸酯反应。确定的优化条件为:在10% Eosin Y为催化剂,36 W 蓝光作为激发光源,4倍当量的B2pin2为硼源,叔丁基甲基醚为溶剂,在室温下反应36 h。在最优条件下该反应对不同溴代芳烃产物都表现出良好的反应适应性,且条件温和,操作简单,避免使用昂贵贵金属光催化剂,特别是对邻位取代卤代芳烃底物表现出特殊的兼容性,是一种高效和廉价芳香硼酸酯的合成新方法。后续可通过研究反应机理,进一步了解反应实质,并开展放大实验和实际有机中间体合成应用研究,为工业生产芳香硼酸酯提供新的选择途径。
