ALPPS治疗巨大原发性肝癌患者近远期疗效研究*
2021-03-15徐绍强
莫 娟,闫 文,徐绍强
原发性肝癌(PLC)起病隐匿、生长快速,大多数患者就诊时肿瘤已为中晚期。在临床上,直径>10 cm的巨大PLC非常常见[1]。巨大PLC多并发有门静脉内癌栓、肝内肿瘤播散、卫星结节,手术难度和危险性均较大,且多发于肝硬化的肝脏,迅速侵犯肝实质,导致肝功能衰竭的发生,患者总体预后较差[2]。近年来,随着肝胆外科技术的发展,PLC大小和部位不再是限制手术切除的主要因素。有研究表明,术前行经肝动脉化疗栓塞术(transcatheter hepatic arterial chemoembolization,TACE) 可提高巨大PLC患者的临床疗效[3]。 然而,对于一些晚期患者来说,正常肝脏组织被过多的破坏,手术中过多地切除正常肝组织,对于有肝硬变背景的患者容易发生肝功能衰竭[4]。联合肝脏分隔和门静脉结扎的二步肝切除术(associated liver partition and portal vein ligation for staged hepatectomy,ALPPS)技术的出现为巨块型PLC患者的手术切除提供了新选择。ALPPS通过选择性结扎一侧门静脉主干来调整入肝血流,促进余肝实质(future liver remnant,FLR)再生,增加了手术切除肿瘤的机会[5]。本研究对比分析了单纯巨大PLC切除术、TACE后手术切除和ALPPS三种治疗方法治疗巨大PLC患者近远期疗效的差异,旨在为临床治疗方法的选择提供参考,现报道如下。
1 资料与方法
1.1 一般资料 2016年1月~2018年2月我院诊治的巨大PLC患者98例,男性78例,女性20例;年龄43~76岁,平均年龄为(56.8±5.5)岁;肿瘤直径为10~20 cm,平均为(14.4±1.4)cm。符合《中国常见恶性肿瘤诊治规范》中原发性肝癌的诊断标准[6],肿瘤直径≥10 cm,术前肝功能Child-Pugh分级为A级,术后组织病理学检查证实为肝细胞癌(HCC),无肺、骨等远处转移。排除标准:(1)合并其他原发性肿瘤;(2)妊娠或哺乳期妇女;(3)在随访过程中因非PLC因素导致的死亡。将ALPPS治疗的20例患者归为A组,TACE治疗后手术切除的38例患者归为B组,行巨大PLC直接切除的40例患者归为C组,三组一般资料比较,无统计学差异(P>0.05),具有可比性。所有患者给出知情同意书,本研究经我院医学伦理委员会批准。
1.2 治疗方法 在A组,采取腹腔镜辅助下ALPPS治疗。患者取仰卧位,全身麻醉,在上腹部行切口,置入腹腔镜。第1步,结扎门静脉右支,离断肝实质。在靠近第一肝门Glisson 鞘内解剖门静脉右支,夹闭,于镰状韧带右侧1.0 cm位置入路使用超声刀断肝,分离Ⅳb段肝动脉、切断,分割肝组织,解剖肝左静脉分支,止血,冲洗腹腔,置引流管。第2步,在第1步后7 d,再次手术,切除病灶。患者取平卧位,全身麻醉,行上腹部切口,逐层切开腹腔,经原位前入路,切除右侧三叶,打开下腔静脉和尾状叶覆膜,分离短静脉,暴露无血管区,分离残留肝实质,离断肝中静脉,游离韧带,检查左肝外叶血供,冲洗腹腔,放置引流管;在B组,先行辅助性 TACE治疗,即采用 Seldinger法穿刺股动脉,将导管沿股动脉插入腹腔动脉,进入肝动脉。造影明确病灶部位和供血状态。将导管尽可能接近肿瘤供血动脉支,从动脉支内注入顺铂50~100 mg、5-氟尿嘧啶1000~2000 mg、阿霉素20~40 mg、丝裂霉素10~20 mg,以碘化油或/和明胶海绵栓塞。本组术前接受TACE治疗1次者19例 ,2次者13例,3次者5例,4次者1例。在最后一次TACE术后行肝肿瘤切除术,间隔时间为1~3个月,平均为(1.9±0.2)个月。经肋缘下切口进腹,探查肿瘤部位、剥离肝脏粘连、探查肝内外转移和肝硬化等情况。游离肝脏,采用Pringle法阻断血流,每次阻断时间为15~20 min。根据手术情况分2~4次阻断,间隔时间为5 min。以钳夹法或者用手术闭合分割器离断肝脏,用血管缝线缝扎肝切面、止血。对伴有门静脉癌栓者,则经肝切面门静脉断端将癌栓吸出,再用血管缝线连续缝合门静脉;在C组,仅行肝肿瘤切除术,手术方法同B组。
1.3 肝再生评估 术后,行64排螺旋CT增强扫描,应用IQQA-Liver肝脏CT解读分析系统进行肝脏三维重建,包括肝脏、肿瘤病灶、肝动脉系统、门静脉系统和肝静脉系统,测量全肝体积(total liver volume, TLV)、残余肝脏体积(remnant liver volume, RLV)、术后3个月肝脏体积(future remnant liver volume, FRLV),计算肝增生体积和肝增生率。肝增生体积(regenerative volume,RV)= FRLV-RLV;肝增生率(regeneration rate,RR)= (FRLV- RLV)/RLV×100%。
1.4 肝功能指标检测 使用全自动血生化分析仪测定血生化指标,常规检测凝血功能指标。
1.5 术后随访 术后,每3个月通过门诊复查血清指标和肝脏B超,每6个月复查腹部CT扫描和(或)MRI检查,随访终点为术后2年或患者死亡,随访方法为门诊复诊或电话随访。疾病无进展生存是指受试者在手术至肿瘤恶化或死亡的时间;总生存指受试者在手术至随访终点(或死亡)的时间。
2 结果
2.1 三组术后肝再生情况比较 A组肝增生体积显著大于B组和C组,肝增生率也显著高于B组和C组(P<0.05,表1)。
2.2 三组肝功能指标比较 在治疗后15 d,A组血清ALT水平显著低于,而血清ALB水平显著高于其他两组(P<0.05,表2)。
表1 三组术后肝再生情况比较
2.3 三组术后并发症发生率比较 三组术后并发症发生率比较,无显著性差异(P>0.05,表3)。
表2 三组肝功能指标比较
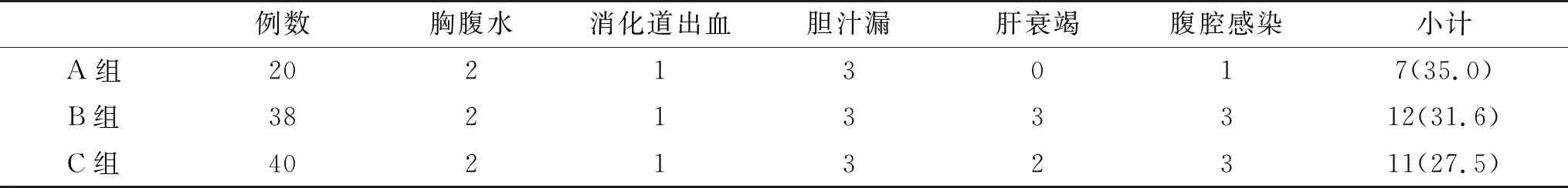
表3 三组术后并发症发生率【n(%)】比较
2.4 三组术后生存率比较 A组2 a总生存率为70.0%,无进展生存率为55.0%,B组分别为55.3%和36.8%,C组分别为52.5%和42.5%,三组生存率比较,无显著性差异(P>0.05,图1、图2)。
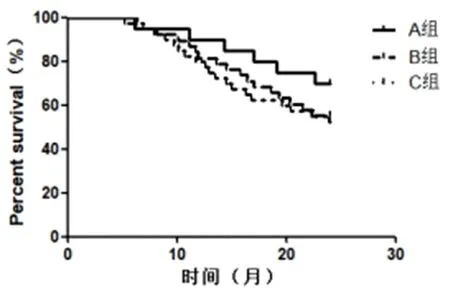
图1 三组术后2a总生存曲线
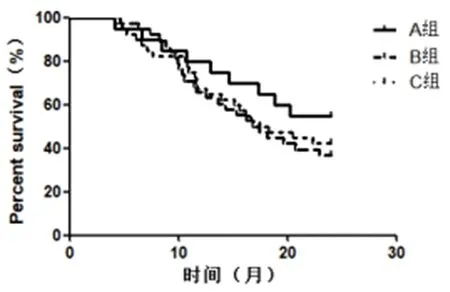
图2 三组术后2a无进展生存曲线
3 讨论
手术切除巨大肝脏肿瘤是肝脏外科发展的重要标志之一。国内外多项研究表明[7],通过积极的手术切除可改善巨大PLC患者远期疗效,使得部分患者获得长期生存。然而,由于巨大PLC占据空间较大,肿瘤对毗邻脏器甚至对重要管道结构造成挤压,再加上多数患者合并有肝硬化,手术难度大且风险高[8,9]。手术切除仍是治疗巨大肝癌的首选方法。ALPPS是近年来较为新颖的一种手术方法,为肝胆外科领域的一次革命性的突破,通过两次手术治疗巨大肝癌,使患者第一期手术后的肝脏在短时间内得到迅速增长,使其在第二期手术时可安全地切除肿瘤,实现二期根治性切除,确保足够的剩余肝脏体积,有效预防了肝衰竭的发生,确保手术安全和术后康复[10-12]。
肝脏作为体内重要代谢器官,再生潜能强大,受到手术切除等损伤性刺激后,残余肝脏体积可迅速增大,促进肝功能的恢复[13,14]。研究发现,采用ALPPS 术式可使得患者剩余肝脏体积显著增加,其肝脏增生时间约为9 d左右[15]。本研究中A组患者术后肝增生体积和肝增生率显著高于B组或C组。同时,本研究结果显示A组术后血清ALB水平显著高于其他两组。肝脏再生需富含肝脏再生因子的门静脉血流供应,ALPPS手术通过选择性结扎患侧门静脉,调整入肝血流,增加剩余肝脏门静脉供血量,分隔了肝脏组织,促进术后剩余肝组织再生,同时在带瘤一侧肝脏组织缺乏相应的门静脉血供,但仍然保留了一部分肝动脉血供,有效避免了急性肝衰竭的发生,为不可进行切除的PLC患者赢得了根治性手术的机会[16-20]。本研究对三组患者随访2年,结果显示三组患者生存率比较无显著性。有人研究发现 ALPPS可减少癌残留而降低复发,提高巨大肝癌患者术后远期疗效[21],需要认真研究。
在选择ALPPS术时,需预防术后并发症的发生,(1)胆瘘预防:对于直径超过0.5 mm的管道均需用血管缝线缝合,术后对肝创面行持续低负压引流;(2)肿瘤转移:尽量减少不必要的手术操作,避免过度游离肝脏;(3)组织粘连:尽量减少止血材料等的置入,于肝脏分隔面和第一肝门等部位喷涂透明质酸钠凝胶,可预防术后组织粘连,术后尽早拔除引流管;(4)手术损伤:仔细操作,避免组织损伤。
